酿酒酵母表达中华绒鳌蟹甲壳肽及其抗菌功能研究
*杜婕 张容彬 徐浩鹏 周广帅
(江苏农林职业技术学院 江苏 212400)
中华绒螯蟹(Eriocheir sinensis)是我国淡水水产养殖中的重要经济物种。随着现代集约化水产养殖的发展,由细菌、病毒和螺原体引起的各种疾病在中华绒鳌蟹的主要养殖区种群中频繁爆发[1-6],给我国淡水蟹类养殖造成了灾难性的经济损失。
中华绒鳌蟹作为甲壳动物代表物种之一,虽其机体缺乏获得性免疫系统-特异性免疫,但它们具备非特异性先天免疫系统来保护自己免受微生物病原体的侵害。甲壳动物的血淋巴细胞在其先天性免疫系统发挥着最为重要的免疫防御作用。虽然至今国际上仍没有一个明确的分类标准,但一般认为可分为3类:大颗粒细胞(granular cells,GC)、小颗粒细胞(semi-granular cells,SGC)又称为半颗粒细胞,以及无颗粒细胞(agranular)或透明细胞(hyaline cells,HC)。通常认为酚氧化酶类主要存在于大颗粒细胞中,而小颗粒细胞和透明细胞在吞噬病原和凝集作用中发挥着重要的作用。甲壳动物先天免疫系统包括酚氧化酶原激活系统(proPO系统),血淋巴的凝血过程、细胞吞噬和包裹作用、细胞凝集及各种机体通用和特有的抗菌肽(AMP)等来共同抵御病原菌的入侵[7]。AMP几乎是所有甲壳动物生命体中存在的关键防御效应因子[8]。抗菌肽在甲壳动物先天免疫中表现出多种功能,包括杀菌活性和选择性免疫调节作用[9-10]。由于抗菌肽具有抗革兰氏阴性和阳性菌,以及真菌、病毒和原生动物病原体的特性,因此非常适合作为新型抗生素及治疗剂进行开发研究[7,11]。
甲壳肽(Crustin)是甲壳动物中重要的抗菌肽之一。第一个报道的甲壳肽是从滨蟹(Carcinus maenas)的血淋巴细胞中分离出来的。它是一种分子量为11.5kDa的阳离子蛋白,为一种疏水性抗菌肽,可用于抵御海洋革兰氏阳性细菌[12]。至今约60多种甲壳肽类基因已经在多种不同的甲壳动物中发现,包括蟹类和对虾类[13-19]。在对虾中的这些甲壳肽蛋白通常具有共同的结构:它们均为疏水性蛋白质,在C端区域具有单个乳清酸性蛋白(WAP)结构域[20]。此结构域包含50个氨基酸残基和8个半胱氨酸残基,形成四个二硫键,称为四二硫键核心结构[13],该结构域包含多种功能,如蛋白酶抑制[21]和抗菌反应[22]。关于抗菌活性,大多数研究表明有活性的甲壳肽(天然和重组的)表现出对革兰氏阳性菌的抗菌活性。例如上文提到的从C.maenas纯化的甲壳肽对藤黄微球菌和草绿色气球菌等有活性,而这些都是革兰氏阳性海洋细菌[12]。中国明对虾的甲壳肽具有抑制革兰氏阳性菌生长的活性,然而却几乎没有检测到针对革兰氏阴性细菌或真菌的活性[23]。此外,也有部分研究[14-16,23]表明,甲壳肽对革兰氏阳性和革兰氏阴性细菌菌株均具有抗菌活性。
目前,多数研究人员集中在对中华鳖重要免疫基因全长cDNA序列的克隆和分析,以及分子水平的表达模式和功能分析,但对其蛋白功能的研究报道较少。此外,对这些重要免疫因子在甲壳类动物中蛋白表达的研究主要是通过大肠杆菌原核系统[21-24],而利用酵母真核系统表达基因的研究则较为有限。与大肠杆菌相比,酵母具有先进的异源蛋白质折叠途径,此外,利用酵母信号序列可以让酵母细胞分泌正确折叠和加工的蛋白质。随着工业发酵技术的广泛应用,酵母在临床和工业重要蛋白质的表达方面也表现出极大的优势[25-26]。
酿酒酵母作为一种普遍被认为安全的(GRAS)生物体,它广泛应用于食品和饮料行业,且已成功表达多种外源真核蛋白,例如:乙肝疫苗、人胰岛素、人粒细胞集落刺激因子和人体血管抑制剂等[27]。然而,利用酿酒酵母真核系统表达中华绒鳌蟹甲壳肽基因的研究较少。
在本研究中,我们利用酿酒酵母系统表达了一种中华绒鳌蟹甲壳肽(以下简称EsCrustin)。将EsCrustin基因的ORF克隆到质粒载体pHAC181中,然后利用同源重组技术将重组质粒整合到酿酒酵母菌株GAL1-ScRCH1中的GAL1的启动子下游以启动表达。在D-半乳糖的诱导下,目的蛋白EsCrustin在酵母细胞中表达,并对重组蛋白的抗菌活性和抗菌功能进行了初步研究。本研究旨在为甲壳类动物先天免疫提供有价值的理论基础及实验依据,以期预防和控制水生甲壳动物疾病的发生。
1.实验材料和方法
(1)实验动物及实验菌株
健康的中华绒螯蟹(平均体重25g)来自中国江苏省句容的某水产养殖场。购买的中华绒鳌蟹饲养在紫外水循环养殖系统中,该系统可保持在水温为28±1℃下进行充气和过滤。在实验前2周,每天以4%体重的比例投喂商业虾饲料(巴大饲料,南通)。
实验所用质粒载体pHAC181在LB液体培养基(10g/L蛋白胨,5g/L酵母提取物,10g/L NaCl,pH7.0)中于37℃培养,酿酒酵母菌株GAL1-ScRCH1在30℃ YPD培养基(10g/L酵母提取物、20g/L蛋白胨、20g/L葡萄糖)中进行培养。
(2)中华绒鳌蟹血淋巴中分离RNA及cDNA合成
用75%乙醇擦拭健康的中华绒鳌蟹进行消毒,以500μL ACD-B(14.7g/L葡萄糖,4.8g/L柠檬酸,13.2g/L柠檬酸钠)作为抗凝剂置于1mL注射器中从其腹部第二附肢中进行血淋巴抽取。然后,将稀释后的血淋巴在20℃以4000g离心5min,获得血淋巴细胞,然后根据Trizol试剂盒(Takara,日本)的方法提取血淋巴总RNA。具体步骤为:将0.2mL氯仿及Trizol试剂(Takara,日本)加入到血淋巴细胞中,剧烈摇晃,静置15min。将混合物4℃ 12000g离心15min,然后将分离出的上层水相中加入异丙醇(0.5mL),4℃、12000g离心10min。去上清,将所得沉淀用75%乙醇洗涤,然后进行空气干燥,最后溶解于20μL DEPC处理过的无菌水中。通过在紫外-可见分光光度计(Eppendorf,德国)中测量260/280nm和260/230处的吸光度来评估RNA的浓度和质量。选择符合质量标准的RNA(1.8≤OD260/280≤2.1且OD260/230≥2.0)用于后续cDNA合成。使用1.0%琼脂糖凝胶电泳检测总RNA的总体完整性。使用PrimeScript RT Reagent Kit(Takara,日本)对1μg RNA进行cDNA合成。
(3)表达载体的构建及同源重组
将获得的中华绒鳌蟹甲壳肽cDNA序列(EsCrustin,GenBank登录号GQ200833.1)[28]使用5'末端分别带有EcoR I和Sph I位点的特异性引物进行PCR扩增。本实验使用质粒pHAC181[29]作为目的基因克隆的载体(pHAC181是一种多拷贝质粒,它是在商业化质粒YEplac181中插入了三个HA标签)。在经过酶切和T4 DNA连接酶(Takara,日本)孵育连接后,将混合物转化到感受态细胞Trans1-T1(TransGen,中国)中。菌落PCR后,通过限制酶来验证阳性转化子,进一步通过DNA测序验证阳性重组质粒是否正确。使用同源重组技术将目标基因与重组质粒的HA标签整合到酿酒酵母菌株GAL1-ScRCH1的GAL1启动子(S.cerevisiae GAL1-ScRCH1为实验室构建的菌株,用GAL1代替ScRCH1菌株的原启动子)下游,利用高保真PrimeSTARGXL DNA聚合酶(Takara,日本)和同源重组引物(表1)来扩增同源重组长片段,采用检测引物用于验证整合是否成功(表1)。

表1 实验中用到的特异性引物
(4)重组蛋白EsCrustin的表达
将成功同源重组的菌株在D-半乳糖诱导培养基YPG(20g/L Peptone、20g/L D-半乳糖、10g/L酵母提取物;D-半乳糖为诱导剂)30℃条件下220rpm剧烈振荡培养,当细胞培养物OD600达到1.0-1.5时,提取蛋白,用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)和Western Blot分析检测重组蛋白EsCrustin的表达情况。
(5)SDS-PAGE及Western Blot分析
使用标准10% SDS-PAGE分析重组EsCrustin的表达。通过考马斯亮蓝染色使蛋白质条带可视化。通过SDS-PAGE分离的蛋白质在电泳转移装置(Trans-blot SD,Bio-Rad)中以25V电转移到硝酸纤维素膜(Bio-Rad)上30min。然后将硝酸纤维膜用Tris缓冲盐水(TBS:10mM Tris-HCl,150mM NaCl,pH7.5)在室温下洗涤10min,并在室温下在封闭缓冲液(TBS缓冲液中的3%BSA)中孵育2h。随后将膜用含有0.05%(v/v)Tween 20(TBST)的TBS在室温下洗涤10min,并与抗HA抗体(Abcam,英国)在室温下孵育2h。用TBS洗涤3次后,加入与辣根过氧化物酶(Abcam,英国)偶联的二抗。孵育2h后,洗膜3次,采用曝光显影法检测重组蛋白,通过与蛋白Maker比对,以确认重组表达的EsCrustin的分子量。
(6)抗菌活性测定
本实验抗菌活性验证所使用的菌株包括4种革兰氏阴性菌(大肠杆菌、嗜水气单胞菌、副溶血性弧菌和铜绿假单胞菌)和三种革兰氏阳性菌(枯草芽孢杆菌、苏云金芽孢杆菌和葡萄球菌)。对于抗菌活性,最低抑菌浓度(MIC)值是通过液体生长抑制试验确定的[30]。本实验中使用贫肉汤营养培养基(10g/L胰蛋白胨,5g/L NaCl,pH7.5)来进行细菌的标准培养,细菌在30℃剧烈摇动下培养24h,然后测定细菌悬浮液的OD600来检测细菌生长浓度,统一选择对数期细菌进行实验,且将细菌浓度统一调整为OD600=0.001。将10μL的重组蛋白EsCrustin样品(同时以酿酒酵母GAL1-ScRCH1空菌株作为阴性对照)在无菌96孔板中进行孵育,在该板中每个孔中均有100μL对数期细菌培养物(统一稀释为OD600=0.001)。MIC值为观察到细菌生长的重组蛋白EsCrustin最高浓度和导致100%抑制细菌生长(杀菌)最低浓度之间的范围。
(7)细菌凝集实验
重组蛋白EsCrustin对细菌识别和凝集作用通过细菌凝集实验来进行测定[31]。本研究选取4种革兰氏阴性菌(大肠杆菌、嗜水气单胞菌、副溶血性弧菌和铜绿假单胞菌)和3种革兰氏阳性菌(枯草芽孢杆菌、苏云金芽孢杆菌和葡萄球菌)进行实验。在贫肉汤培养基中将以上细菌进行培养且细菌浓度调整为1.0×107cells/mL,将10μL的重组蛋白EsCrustin(终浓度为20ug/μL)加入至90μL细菌悬浮液中,同时将不表达目的蛋白的酿酒酵母菌株GAL1-ScRCH1蛋白作为阴性对照。将细菌与重组蛋白混合物在30℃下孵育过夜,然后在光学显微镜下观察细菌。
(8)琼脂平板扩散法测定抑菌活性
将4种革兰氏阴性菌(大肠杆菌、嗜水气单胞菌、副溶血性弧菌和铜绿假单胞菌)和三种革兰氏阳性菌(枯草芽孢杆菌、苏云金芽孢杆菌和葡萄球菌)培养至对数期且浓度统一调整为1.0×107cells/mL来进行实验。用玻璃珠将每种菌悬液100μL均匀涂布在LB平板中,然后将直径为5mm的滤纸贴在平板上,在滤纸上滴入10μL重组EsCrustin蛋白。将平板在30℃培养过夜,观察抑菌圈。同时,设定不表达目的蛋白的酿酒酵母菌株GAL1-ScRCH1为阴性对照。
(9)数据分析
所有实验均进行3次生物学重复,采用SPSS 20.0软件进行数据统计分析。使用one-way ANOVA分析的数据表示为平均值±SE,统计显着性定义为P<0.05。
2.实验结果
(1)EsCrustin cDNA的克隆和同源重组
图1A为本实验中酿酒酵母表达系统的构建策略。从中华绒鳌蟹血淋巴中提取总RNA,并使用甲壳肽蛋白的特异引物进行扩增。扩增出的目的cDNA开放阅读框(ORF)为336bp(图1B),共编码112个氨基酸。在酶切和T4DNA连接酶后,将cDNA片段与载体pHAC181连接并转化到感受态细胞Trans1-T1中。通过限制酶验证阳性转化子(图1C)。同源引物INT-F和INT-R扩增的同源重组大片段为4705bp(图1D),而检测引物扩增的633bp则表明该转化子为正确的同源重组(图1E)。

图1 酿酒酵母菌株表达中华绒螯蟹Crustin的真核表达构建策略图
图1A为酵母真核表达系统的构建过程;图1B表示中华绒鳌蟹Crusin的cDNA开放阅读框(ORF)为336bp;图1C表明通过酶切验证阳性转化子。图1D表示重组质粒采用高保真PrimeSTARGXLDNA聚合酶通过同源重组引物扩增,其目的片段长度为4705bp,图1E表示检测引物用于验证阳性同源重组转化子,目的片段为633bp的为同源重组成功的转化子,M:Marker。
(2)蛋白表达及Western Blot分析
中华绒鳌蟹甲壳肽EsCrustincDNA在酵母真核系统中进行表达。该表达载体在氨基末端具有3个HA标签,因此估测重组EsCrustin的分子量约为20kDa。将重组质粒整合到酿酒酵母菌株GAL1-ScRCH1的GAL1启动子下游,YPG(20g/L蛋白胨、20g/LD-半乳糖、10g/L酵母提取物)用作诱导培养基,通过D-半乳糖诱导重组EsCrustin的表达。通过10%SDS-PAGE电泳分析表明,含有重组蛋白的酿酒酵母菌株可表达大小约为20kDa的蛋白质,Western Blot分析表明,HA抗体与重组蛋白EsCrustin结合,且其分子量为20kDa,表明重组蛋白成功表达(图2)。
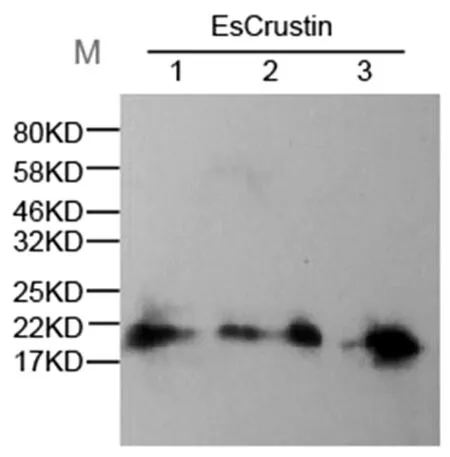
图2 Western blot验证重组蛋白EsCrustin的表达
用HA抗体进行Western blot验证表明,重组蛋白EsCrustin分子量约为20kDa,泳道1-3代表3个不同的同源重组转化子均表达了目的蛋白。M:蛋白Marker。
(3)重组蛋白EsCrustin的抗菌活性
为了测定EsCrustin的抗菌活性,我们检测了最低抑菌浓度(MIC)和最低杀菌浓度(MBC),以评价抑菌和杀菌活性。重组蛋白EsCrustin对4种革兰氏阴性菌(大肠杆菌、嗜水气单胞菌、副溶血性弧菌和铜绿假单胞菌)和3种革兰氏阳性菌(枯草芽孢杆菌、苏云金芽孢杆菌和葡萄球菌)的生长有不同程度的抑制作用。MIC和MBC值分别在0.467-0.921μM和0.887-1.135μM的范围之内(表2)。
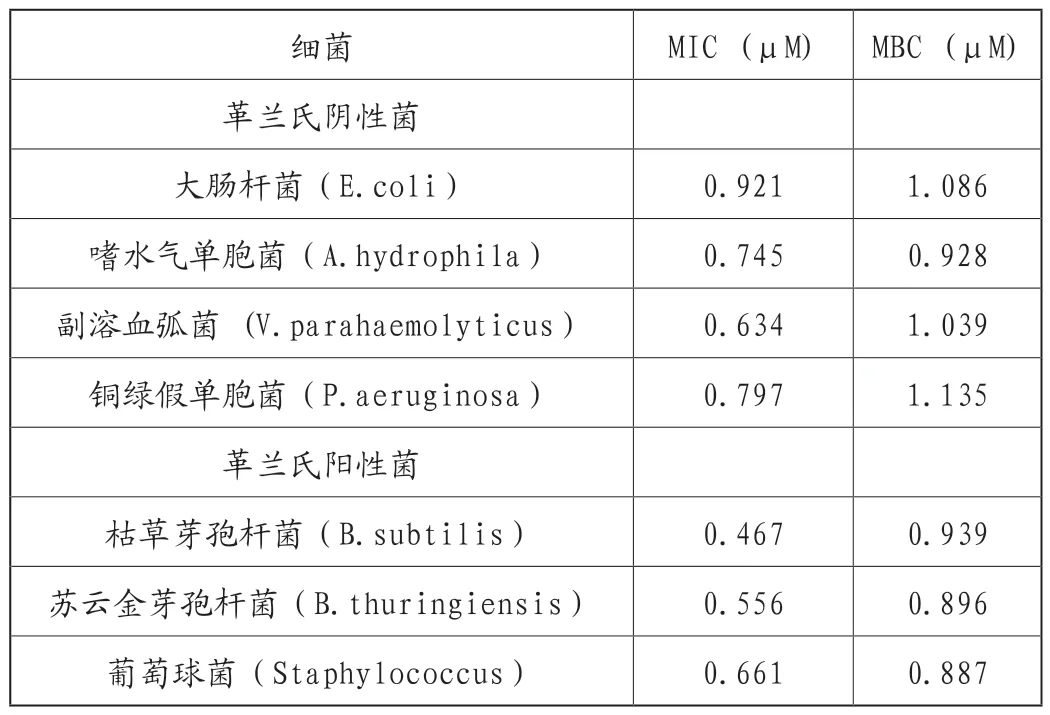
表2 重组蛋白的抗菌功能
(4)细菌凝集实验
为验证重组蛋白EsCrustin是否可以与微生物表面产生相互作用,我们用4种革兰氏阴性菌(大肠杆菌、嗜水气单胞菌、副溶血性弧菌和铜绿假单胞菌)和三种革兰氏阳性菌(枯草芽孢杆菌、苏云金芽孢杆菌和葡萄球菌)进行细菌凝集试验。结果表明,除铜绿假单胞菌外,所有革兰氏阴性菌株都能被EsCrustin凝集(图3A)。此外,实验中3种革兰氏阳性细菌均可被重组蛋白凝集(图3B)。以上结果表明,重组蛋白EsCrustin可识别部分革兰氏阴性菌和革兰氏阳性菌的表面分子。另一方面,两株甲壳动物病原菌嗜水气单胞菌(A.hydrophila)和副溶血弧菌(V.parahaemolyticus)发生凝集,表明重组蛋白EsCrustin可能为中华绒鳌蟹的一种重要的抗菌免疫蛋白。

图3 细菌凝集实验
图3A显示除铜绿假单胞菌外,其他3种革兰氏阴性菌都被重组蛋白EsCrustin凝集,而图3B中3种革兰氏阳性菌与对照蛋白相比均出现凝集现象。Bar:5μm。
(5)琼脂糖平板扩散法检测重组蛋白抑菌活性
在涂布有嗜水气单胞菌(A.hydrophila)的平板上,重组蛋白EsCrustin明显抑制其生长,在平板上出现明显的抑菌圈,且重组蛋白EsCrustin的抑菌圈明显大于对照蛋白C。
本研究中采用琼脂平板扩散法检测重组蛋白EsCrustin对不同细菌的抑制能力,观察抑菌圈的出现及其大小。采用了革兰氏阴性菌(大肠杆菌、嗜水气单胞菌、副溶血性弧菌和铜绿假单胞菌)和革兰氏阳性菌(枯草芽孢杆菌、苏云金芽孢杆菌和葡萄球菌)进行测定。将这7种细菌均匀涂布在LB平板上,同时在平板上贴有滤纸,其上滴有10μL重组EsCrustin蛋白,将平板在30℃培养过夜后,可以观察到在嗜水气单胞菌平板上滤纸周围出现明显的抑菌圈,且重组蛋白的抑菌圈明显大于对照蛋白(对照蛋白为未表达目的蛋白的酿酒酵母菌株GAL1-ScRCH1)(图4)。其他6种菌在平板上抑菌圈不明显。

图4 琼脂平板扩散法检测细菌抑菌圈
3.讨论
Crustin作为一种甲壳动物抗菌肽,因其抗菌的完整性而被认为是一种重要的免疫基因,并且它被认为在甲壳类动物的非特异免疫中非常重要,具体表现为它存在于机体血淋巴颗粒细胞,在其对病原微生物的胞吐中发挥重要作用[32]。本研究采用酿酒酵母表达中华绒鳌蟹甲壳肽,我们将EsCrustincDNAORF(336bp)克隆到载体pHAC181中,然后利用同源重组技术将重组质粒整合到酿酒酵母菌株GAL1-ScRCH1中GAL1启动子的下游,最后成功构建重组蛋白,通过在培养基中添加D-半乳糖使重组甲壳肽蛋白过表达,经过收集、裂解将总蛋白在10%SDS-PAGE上进行分析。WesternBlot表明重组蛋白EsCrustin的分子量约为20kDa(图2)。
前期的研究表明,甲壳肽EsCrustin序列在N端包含一个19个氨基酸的信号肽,在C端包含一个WAP结构域[28],WAP结构域已被描述为具有多种功能,例如包括蛋白酶抑制作用[21]和抗菌活性[22-33]。多数报道中,甲壳肽对革兰氏阳性菌有活性,例如从C.maenas纯化的第一个甲壳肽,它对柑橘假单胞菌、科库里假单胞菌、藤黄假单胞菌和草绿色细菌均表现了抗菌活性[12]。此外,也有研究表明,甲壳肽对革兰氏阳性和阴性细菌均具有抗菌活性[14-18]。在我们的研究中,重组蛋白EsCrustin的抗菌活性在4种革兰氏阴性菌(大肠杆菌、嗜水气单胞菌、副溶血性弧菌、铜绿假单胞菌)和三种革兰氏阳性菌(包括枯草芽孢杆菌、苏云金芽孢杆菌、葡萄球菌)中进行。结果表明,重组蛋白EsCrustin对4种革兰氏阴性菌和3种革兰氏阳性菌的生长有不同程度的抑制作用,其中MIC和MBC值分别为0.467-0.921μM和0.887-1.135μM(表2)。本实验结果与之前的报道相似,斑节对虾的甲壳肽重组蛋白对革兰氏阳性菌和阴性菌[17-18]均表现出明显的抗菌活性。此外,高等动物中的几种含有WAP结构域的蛋白质,例如SLPI(分泌性白细胞蛋白酶抑制剂)[34-35]、弹性蛋白[36-37]对革兰氏阳性菌和革兰氏阴性菌也都表现出抗菌活性。以上结果表明,不同的甲壳肽可能具有不同的生物学功能,它们在甲壳动物的免疫防御系统中对细菌的抗菌活性具有选择性。
本研究用细菌凝集实验来检测重组蛋白EsCrustin是否与微生物表面相互作用,结果显示重组蛋白EsCrustin可凝集除铜绿假单胞菌外的其他六种细菌。因此,重组表达的EsCrustin可有效地凝集某些入侵的细菌并抑制其进一步的感染到机体组织。重组蛋白EsCrustin可识别细菌细胞壁的脂多糖并与其底物结合,从而有效识别并凝集病原体。根据Christie的研究,蛋白质中WAP结构域的存在为甲壳肽蛋白分子提供了蛋白酶抑制活性和抗菌活性[38]。本文的细菌凝集实验也表明EsCrustin是一种有效的抗菌肽,可抵抗部分革兰氏阴性菌和革兰氏阳性菌。此外,琼脂平板扩散法也表明重组蛋白EsCrustin对嗜水气单胞菌具有明显的抑菌作用。因此,本研究结果表明EsCrustin是甲壳类动物中一种重要的先天免疫因子,它是可直接对细菌起到效应作用的抗菌蛋白。
综上,本研究将中华绒鳌蟹甲壳肽EsCrustin在酿酒酵母真核系统中成功表达且预测其蛋白分子量约为20kDa。重组蛋白的抗菌活性表明,EsCrustin是甲壳类先天免疫系统中一种重要的免疫因子,而这种具有抗菌活性的甲壳肽可应用于水产健康养殖领域以控制细菌和病原体的侵染及促进水产养殖业生态、健康发展。

