水稻矮化宽叶突变体osdwl1 的生理特性和基因定位
黄 妍 贺焕焕 谢之耀 李丹莹 赵超越 吴 鑫黄福灯 程方民 潘 刚,*
1 浙江大学农业与生物技术学院, 浙江杭州310058; 2 浙江省农业科学院作物与核技术利用研究所, 浙江杭州310021
水稻是我国最重要的粮食作物之一, 对保障我国粮食安全起重要作用。然而, 随着我国人口数量的持续增长、可耕种面积的逐年减少, 粮食安全形势日益严峻[1-2]。因此, 培育高产稳产水稻新品种依旧是水稻育种工作者的重要目标之一[3]。株高是水稻重要农艺性状之一, 直接影响水稻生物学产量,与水稻的抗倒伏及抗病虫能力线性相关, 最终影响水稻的丰产性和稳产性[4-5]。传统水稻品种一般表现为高秆, 矮秆则是突变性状[4-5]。遗传学研究显示,矮秆性状受主效基因或多个微效基因控制, 同时受内源激素及外源光温水气肥的影响[4-6]。利用正向或反向遗传学手段, 迄今已克隆调控水稻株高的基因超过70 个, 这些基因多数与赤霉素、油菜素内酯、独脚金内酯、生长素等激素生物合成代谢或信号传导有关[4-5]。研究表明, 现已克隆的多数矮秆或半矮秆基因表现出“一因多效”的遗传效应, 即引起水稻植株矮化的同时其他农艺性状也发生改变, 如d3[7]、d10[8]、d14[9]、fc1[10]和htd1[11]具多分蘖特征;sgd2[12]和SRS5[13]与籽粒大小有关; 而DNL1[14]则表现为窄叶;dlt[15]则引起少蘖宽叶。
当然, 叶片是水稻进行光合作用的主要场所,是最重要的源器官, 其形态直接影响植株形态并最终关系到稻谷产量与品质。而叶片的长、宽、面积、厚、倾角、披垂度、卷曲度等是界定叶形态及空间姿态的重要因素[16], 因此增加叶宽将影响有效光合叶面积, 从而影响单个叶片的光合产物。研究认为, 叶片是沿基-顶轴、近-远轴以及中-边轴3 个轴向生长发育, 其中中-边轴调控叶宽[17]。因此, 可以利用窄叶或宽叶突变体研究水稻叶宽调控分子机理, 迄今已克隆诸如NAL1[18]和DNL3[19]等窄叶基因, 但有关宽叶突变体却仅有Wl[20]和dlt[15]等少量报道。
本课题组前期利用60Co 辐射诱变中籼恢复系自选1 号, 获得一个矮化宽叶突变体, 暂名为osdwl1(Oryza sativadwarf and wider-leaf 1,osdwl1)。该突变体在苗期(约3~4 片期)就表现为宽叶, 且除上部一片完整展开叶及心叶外, 其他叶片的中上部均表现为黄叶。之后随着叶龄的增加, 除叶片形态发生变化外, 植株还明显矮化。本文对突变体osdwl1的基本表型、生理细胞变化及基因定位等方面进行了研究, 为进一步克隆该基因并揭示其矮化宽叶的分子细胞生理机理奠定基础。
1 材料与方法
1.1 试验材料
矮化宽叶突变体osdwl1来源于籼稻恢复系自选1 号(来源于湖北省恩施市农业科学院水稻研究所)的60Co 辐射诱变后代, 经杭州和海南连续多代回交和自交, 突变性状已稳定遗传。之后利用突变体osdwl1分别与原始对照自选1 号、籼稻恢复系93-11以及常规粳稻02428 杂交, 获得osdwl1/自选1 号、osdwl1/93-11 和osdwl1/02428 三个F1并自交获得相应F2群体, 用于突变性状的遗传分析和基因定位。所有材料均种植于浙江大学紫金港农业试验站, 常规肥水管理。水稻幼苗期和抽穗开花期, 分别调查20 个单株的幼叶和剑叶宽度。水稻成熟后, 随机选取osdwl1及自选1 号各20 株, 考查其株高、茎节长、穗长、有效穗数、每穗粒数、结实率和千粒重等主要农艺性状。
1.2 生理指标测定
随机选取osdwl1及自选1 号处于孕穗期(剑叶叶枕与倒二叶叶枕重合的分蘖)的剑叶、倒二叶和倒三叶的上部叶片, 根据Gong 等[21]的方法分别测定叶绿素、可溶性蛋白、H2O2、O2-和MDA 含量、以及CAT 和SOD 酶活。同时, 利用Li-6400XT 光合仪以及PAM-2000 叶绿素荧光仪分别测定剑叶、倒二叶和倒三叶相应部位的净光合速率及Fv/Fm[22-23]。每个生理指标测定5 个生物学重复。
1.3 叶片及茎节细胞学观察
取抽穗当天osdwl1及自选1 号剑叶的上部边缘叶片, 用刀片切成1 mm × 2 mm 的样品, 立即放入预冷的2.5%戊二醛固定液中并抽真空至样品完全浸没, 4℃固定过夜, 根据Yang 等[24]的方法制片, 于扫描电镜(Hitachi TM-1000)和透射电镜(JEM-1230)下分别观察叶片表皮细胞和叶肉细胞显微结构并拍照。同时, 选取抽穗当天osdwl1及自选1 号相同部位剑叶, 将叶片横剪成2 mm 宽的小片段, 立即放入70% FAA 固定液并抽真空至样品完全浸没, 4℃固定3 d, 而后依次进行乙醇脱水、二甲苯透明、石蜡包埋、切片以及番红固绿染色, 最后用1︰1 的二甲苯和中性树胶封片, 置于42℃恒温箱处理48 h, 后于NIKON E6000 显微镜下观察并拍照。此外, 根据曹剑波等[25]的方法, 选取抽穗当天osdwl1及自选1 号相同部位倒二节茎段进行树脂半薄切片, 于倒置显微镜(Nikon TE2000-U)下观察细胞形态并照相。
1.4 基因遗传分析与定位
大田栽培条件下, 首先观察osdwl1/自选1 号及osdwl1/93-11 的杂种F1的株高及叶片表型, 确定控制osdwl1矮化宽叶的显隐性; 其次, 根据osdwl1/自选1 号及osdwl1/93-11 的F2群体中具有野生型表型的单株数与具有突变体表型的单株数比例, 确定控制osdwl1矮化宽叶的基因数。同时, 剪取osdwl1/02428 的F2定位群体中具有突变体性状和野生型性状的各10 个单株、以及其亲本osdwl1和02428 的叶片, 采用CTAB 法提取基因组总DNA。选取SSR (http://www.gramene.org/)及InDel 分子标记, 利用BSA 法进行基因定位。
2 结果与分析
2.1 突变体osdwl1 的表型及主要农艺性状
osdwl1的叶片从苗期(三至四叶期)开始, 除上部1 片完整展开叶及心叶外, 其他叶片在完整展开3~4 d 后, 叶尖开始变黄并逐步扩展至叶片中上部(图1-A~C)。之后随着叶龄增长,osdwl1植株高度也逐渐矮于野生型对照, 到水稻成熟期(图 1-D, E),osdwl1株高仅有野生型对照的64.18% (表1)。进一步分析植株每一个茎节长度, 结果显示osdwl1倒一节、倒二节、倒三节、倒四节和倒五节分别仅有野生型对照的62.86%、75.42%、79.24%、79.93%和77.03% (图1-E, F)。倒二茎节纵切面的树脂半薄切片结果显示, 突变体的细胞长度明显变短, 但细胞数目显著增加(图1-G, H)。由于叶片出现黄化症状,导致突变体osdwl1的主要农艺性状, 如穗长、每穗粒数和结实率分别比野生型对照下降 35.60%、37.35%和42.15%, 而突变体千粒重则极显著高于对照(表1)。
2.2 突变体osdwl1 叶片表型特征
图1-C 及图2-A 显示突变体osdwl1幼苗期叶片及抽穗开花早期剑叶极显著宽于对照, 分别增宽16.17%和12.88%。剑叶石蜡切片(图2-B)结果显示,osdwl1与野生型对照之间的大维管束数无显著性差异, 但突变体的小维管束数及小维管束之间距均极显著增加, 分别增加10.98%和27.95% (图2-C, D);而且, 与对照相比, 突变体小维管束间的表皮细胞数显著增加(图2-E), 而其宽度无明显变化(图2-F)。同时, 利用SEM 分析突变体剑叶表皮细胞结构特征,进一步证实突变体小维管束之间的间距极显著增加(图2-G), 此外, 与对照相比,osdwl1剑叶下表皮的小刺毛数也极显著增加, 达3384.85% (图2-G, H);而其上表皮的大刺毛和小刺毛数则分别增加36.70%和211.08% (图2-G, I)。
2.3 突变体osdwl1 的生理分析
2.3.1 叶绿素含量及其光合作用效率 图3-A~D结果显示, 孕穗期osdwl1除叶绿素a/b比值(图3-D)及剑叶叶绿素含量(图3-A~C)外, 其倒二叶、倒三叶的叶绿素a(图3-A)、叶绿素b(图3-B)及叶绿素总含量(图3-C)依次极显著下降且极显著低于野生型对照。与野生型对照相比,osdwl1倒二叶和倒三叶的总叶绿素含量分别下降 13.48%和 26.59%。尽管osdwl1剑叶叶绿素含量无显著性变化, 但TEM 结果(图3-E~H)显示突变体剑叶叶肉细胞的部分叶绿体类囊体结构松散(图3-H), 部分已开始降解(图3-G),这势必影响突变体叶片的净光合速率(图3-I)及PSII光化学效率(Fv/Fm) (图3-J)。结果显示, 突变体剑叶、倒二叶和倒三叶的净光合速率和Fv/Fm明显低于野生型对照, 净光合速率分别下降27.22%、28.31%和22.25% (图3-I), 而其Fv/Fm的变化趋势与净光合速率基本一致, 分别下降13.34%、10.78%和20.40%(图3-J)。含量无显著性差异, 而osdwl1则依次升高且倒二叶和倒三叶显著高于剑叶, 分别增加 11.44%和24.72%。为了平衡植物细胞内的活性氧含量, 如H2O2和O2-, 防止其对细胞造成损伤, 植物细胞会表达多种保护酶, 如SOD 和CAT 等抗氧化酶。因此,进一步测定了叶片的CAT (图4-C)和SOD (图4-D)酶活。结果显示, 野生型剑叶、倒二叶和倒三叶间的SOD 和CAT 酶活无显著性差异, 而突变体osdwl1则依次极显著下降。与osdwl1剑叶相比, 其倒二叶和倒三叶的SOD 酶活分别下降8.00%和20.08%,CAT 酶活则分别减少39.84%和51.32%。
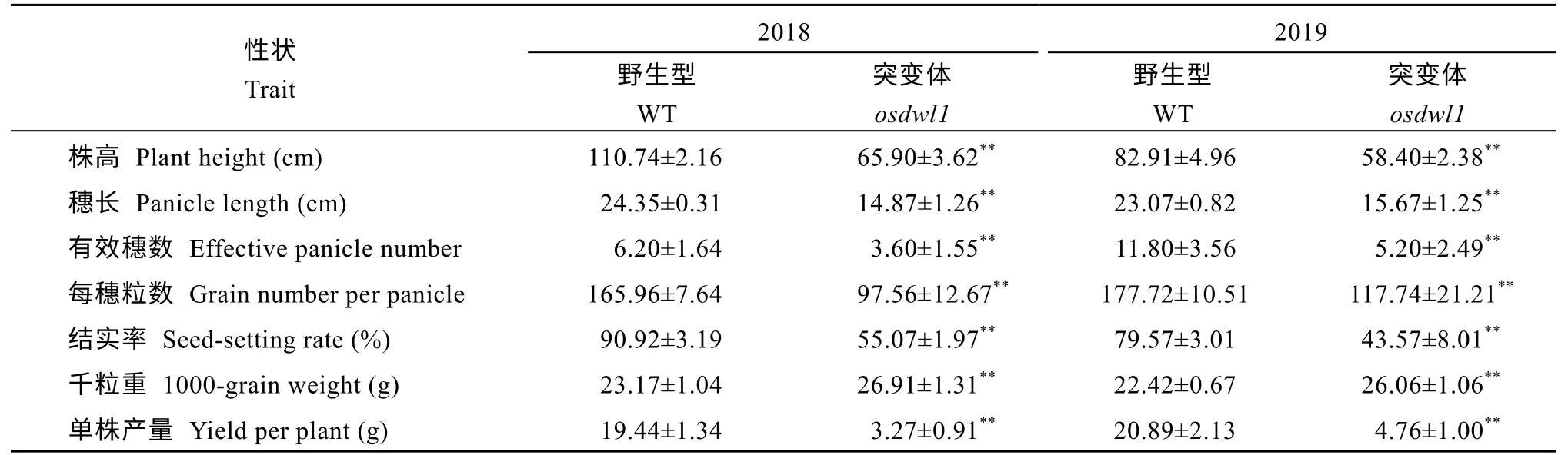
表1 突变体及其野生型的主要农艺性状Table 1 Main agronomic traits of osdwl1 and its wild-type plants
2.3.3 MDA和可溶性蛋白含量 图5显示, 野生型对照的剑叶、倒二叶和倒三叶间的MDA含量(图5-A)和可溶性蛋白含量(图5-B)均无显著性差异。而osdwl1的剑叶、倒二叶和倒三叶间的MDA含量则依次显著升高, 除剑叶外, 倒二叶和倒三叶含量显著高于野生型对照(图5-A); 与突变体osdwl1剑叶相比,其倒二叶和倒三叶的MDA含量分别增加50.29%和79.87% (图5-A)。osdwl1的剑叶、倒二叶和倒三叶间的可溶性蛋白含量依次降低且均极显著低于野生型对照, 尤其是其倒三叶的含量极显著低于剑叶和倒二叶, 分别下降31.93%和28.53% (图5-B)。
2.4 遗传分析与基因定位
osdwl1/自选1 号和osdwl1/93-11 杂交F1植株形态均正常, 说明突变性状是由隐性位点控制。而osdwl1/自选1 号的1105 个F2群体中, χ2检验正常植株数(836)与具矮化及宽黄叶的植株数(269)的分离比 符 合 3 ∶1 [χ2= 0.25 < 3.84 (χ2(0.05,1))]; 而osdwl1/93-11 的612 个F2定位群体中, 正常单株数(455)与矮化及宽黄叶单株数(157)的分离比亦符合3∶1 [χ2=0.46 < 3.84 (χ2(0.05,1))]的孟德尔遗传定律。这些结果表明osdwl1的矮化及宽黄叶性状由单隐性核基因控制。
利用osdwl1/02428 的F2群体中具有矮化及宽黄叶性状的673 个单株作为基因定位群体。为了定位OsDWL1基因, 首先分别提取osdwl1/02428 F2群体中的10 株野生型表型和10 株具有矮化宽叶性状的单株基因组DNA, 分别等量混合成正常基因池和突变基因池。合成水稻12 条染色体上的500 对SSR标记及50 对InDel 标记, 逐条对02428 和突变体osdwl1进行多态性分析, 而后选用均匀分布于12 条染色体上的多态性分子标记, 利用BSA 法分析其与OsDWL1基因间的连锁性关系。结果发现水稻6 号染色体短臂上的SSR 标记RM7399、RM19288、RM3805 和RM19549 与OsDWL1紧密连锁。利用这4 个标记对osdwl1/02428 的F2群体中的673 个矮化宽叶单株进行基因型分析, 发现 RM7399、RM19288、RM3805 和RM19549 的交换单株分别是80、23、19 和121 株, 初步将OsDWL1基因定位在RM19288 和 RM3805 之间。为进一步精细定位OsDWL1基因, 继续合成位于RM19288 和RM3805之间的10 对SSR 和InDel 标记(附表1), 其中2 对标记在02428 和突变体osdwl1间存在多态性, 利用这2 对标记将OsDWL1基因限定在RM19297 与ID269-2 之间, 物理距离约333 kb, 横跨AP001168、AP002838、AP000391 和AP000559 四个BAC (图6), 其间有 EST 支持的 ORF 为 37 个(http://rapdb.dna.affrc.go.jp/viewer/gbrowse/irgsp1/) (表2)。

表2 定位区间内的基因及功能注释Table 2 Gene names and their functional annotations in the target interval
3 讨论
株高是影响农作物株型、生物量、抗倒性及机械收割的重要因素[4-5]。研究表明, 植株过高是引起水稻倒伏的最主要原因[4-5]; 而植株过矮, 会造成水稻生长量不足, 故适当增加株高, 不仅可以降低叶面积密度(叶面积指数与株高的比值), 还有利于CO2扩散及中下部叶片吸收利用太阳光能, 增加光合速率, 进而提高植株生物量[26]。影响水稻株高的因素包括穗长、节间数和节间长度, 除少部分因穗长和节间数量发育缺陷的突变体外, 大多数矮秆水稻是由于节间长度变短造成的[4-5]。本研究中osdwl1的节间长度均极显著比野生型对照缩短, 导致osdwl1株高显著低于野生型对照(图1-E, F), 茎节的树脂半薄切片证实节间缩短的根本原因在于突变体细胞长度更小(图1-H)。
植物株高既受诸如光温水气肥等外界环境的影响, 也受植物内源激素及基因的调控, 但归根结底受内源基因网络的精细调控[4-6]。大量研究结果证实,水稻株高一般受1~3对主效基因控制, 但也受微效基因调控[4-5]。迄今已证实, 调控株高的基因包括GA代谢途径的DELLA蛋白基因、参与油菜素内酯和独脚金内酯合成代谢的细胞色素P450基因与钙调蛋白、RNA编辑相关的PPR (pentatricopeptide repeat)蛋白基因以及核糖体蛋白基因等[4-5]。如水稻编码PPR蛋白的OGR1基因的功能缺失突变体ogr1表现为矮化及不育等特性[27]; 与油菜素内酯合成代谢相关的水稻P450基因CYP90D2/D2的缺失突变[28]、拟南芥钙调蛋白基因DWL1的部分缺失过表达转基因后代均表现矮化症状[29]; 参与GA信号通路的水稻DELLA蛋白基因SLR1的功能缺失也导致水稻矮化[30]; 此外, 拟南芥编码核糖体蛋白L10基因SAC52的突变可以恢复acl5-1突变体的矮化症状[31]。在本研究的OsDWL1基因的定位区间内(图6), 已克隆了一个矮化基因, 即LOC_Os06g03710, 该基因DLT/OsGRAS-32编码一个GRAS蛋白(GAI-RGA-SCR), 其双碱基缺失突变体d62表现为矮化少蘖、宽叶浓绿等特征[32]。本研究中的osdwl1则表现为矮化少蘖、宽叶黄化(图1), 因此与d62性状不完全一样。进一步通过测序分析osdwl1中的DLT基因, 证实其序列与野生型对照一致。而与报道相关的导致水稻矮化相关的基因分别为PPR蛋白基因(LOC_Os06g03530和LOC_Os06g03570) 、 细 胞 色 素P450基 因(LOC_Os06g03930)、钙调蛋白基因(LOC_Os06g03676)、以及核糖体蛋白基因(LOC_Os06g03790) (表2)。当然,候选基因的最终确定要依赖于这些基因的测序分析及遗传互补验证。
大量研究表明, 矮化基因一般具有“一因多效”的特点, 即矮化突变体除植株矮化外, 还伴随分蘖、叶片和籽粒等组织器官的变化[4-5]。本研究中osdwl1除表现矮化少蘖外, 叶片从苗期开始就表现为黄化宽叶特性(图1和图2)。研究表明, 叶片黄化是叶片衰老的重要外在表现, 而其内在表现则为程序性细胞死亡(programmed cell death, PCD), 并由此带来叶绿体降解、蛋白质降解、ROS (reactive oxygen species)累积、膜脂过氧化以及光合速率下降等生理生化变化[32]。因此, 叶绿素含量和叶片净光合速率是衡量叶片衰老的重要生理指标[33]。本研究结果显示, 突变体osdwl1的倒二叶和倒三叶的总叶绿素含量及其光合速率均极显著低于其野生型自选1号(图3), 预示其叶片已开始衰老(图1)。伴随叶片衰老, 突变体叶绿体也开始降解(图3), 进而造成叶绿体中的电子传递链受到抑制, 致使H2O2和O2-等ROS急剧增加[34-35](图4-A, B)。同时, 过量ROS将作用于细胞膜脂质, 使其过氧化而产生大量MDA[34-35](图5-A)。与此同时, 为了清除细胞内的过多ROS并保护细胞膜系统, 正常植物细胞会及时启动属于可溶性蛋白的抗氧化酶, 如SOD和CAT的表达[36-37]。其中, SOD是的专一作用酶[36-37], 突变体osdwl1的剑叶、倒二叶和倒三叶的SOD酶活极显著低于野生型自选1号(图4-D), 从而导致突变体叶片中的O2-含量显著增加(图4-A)。而CAT是作用于H2O2的保护酶[36-37], 突变体osdwl1的倒二叶和倒三叶之间的CAT酶活显著低于野生型(图4-C), 致使其倒二叶和倒三叶中的H2O2显著增加(图4-B)。
4 结论
osdwl1是一个新鉴定到的矮化少蘖、宽叶黄化的突变体, 其宽叶黄化症状始于三至四叶期幼苗。与野生型对照相比,osdwl1的剑叶、倒二叶和倒三叶的叶绿素含量极显著降低, 从而导致其净光合速率极显著下降。osdwl1倒二叶和倒三叶CAT、SOD 活性极显著下降, 降低其清除H2O2的能力, 导致ROS明显增加并促使细胞膜脂过氧化, 致使MDA 含量极显著升高。遗传分析表明,osdwl1的矮化宽叶性状由一对隐性核基因控制, 进一步利用图位克隆技术将OsDWL1定位于6 号染色体短臂的RM19297 与ID269-2 之间, 其间物理距离约333 kb, 这为进一步克隆该基因并揭示其矮化宽黄叶分子生理机理奠定基础。

附表1 用于OsDWL1 基因定位的分子标记Table S1 Molecular markers used for OsDWL1 gene mapping

