一个新的水稻脆秆突变体bc17 的鉴定及基因定位
姜鸿瑞 叶亚峰 何 丹 任 艳 杨 阳 谢 建 程维民陶亮之 周利斌 吴跃进 刘斌美,*
1 中国科学院合肥物质科学研究院, 安徽合肥 230031; 2 中国科学技术大学, 安徽合肥 230026; 3 中国科学院近代物理研究所, 甘肃兰州 730000
水稻茎秆的机械强度是重要的农艺性状之一,直接影响着植株的抗倒伏能力。水稻脆性突变体是一类比较常见的突变体[1], 是研究细胞壁合成机制的重要材料。脆性突变一般是指植株茎秆机械强度下降, 通常表现为纤维素和半纤维素含量下降, 木质素含量升高[2], 在结构上表现为厚壁组织次生细胞壁变薄[3]。由于茎秆机械强度下降, 存在倒伏发生的隐患, 生产上一般认为是不利的性状。然而脆性突变体秸秆脆嫩、纤维素含量下降, 有利于反刍动物采食, 消化更加容易, 具备成为粮饲兼用型水稻品种的应用潜力[4]。另外, 脆秆突变体的茎秆易粉碎降解, 对于秸秆生态还田有着很好的应用前景, 是一种重要的种质资源[5]。
从第一个水稻脆秆基因bc1[6]被发现以来, 对水稻脆性突变体的研究已有50 多年的历史了。截止目前, 报道的水稻脆性突变体仅有20 多个, 大多数基因都是涉及细胞壁纤维素合成酶OsCesA (cellulose synthase)的变异, 其中以bc (brittle culm)命名的水稻脆性突变体有16 个(bc1~bc16), 相对研究的比较系统和深入, 并且对细胞壁合成调控的机制做了详细解析[7-8]。细胞壁化学成分的变化、合成和转运的阻滞以及厚壁组织结构发育异常等都可能引起水稻茎秆机械强度的改变[9-19]。近来发现水稻转录因子也参与细胞壁生物合成的过程[20-22]。水稻纤维素合酶基因是引起脆秆特性的关键基因, 其中最重要的是OsCesA4、OsCesA7、OsCesA9, 可能形成一个纤维素合成复合体参与次生细胞壁的合成[12]。水稻脆秆基因bc7和bc11基因[13-14]是OsCesA4的等位变异;bc6和bc13基因[15-16]是OsCesA9的等位变异。bc10、bc14、bc15可能参与细胞壁的修饰, 其中bc10基因编码一个定位在高尔基体的Ⅱ型内整合膜蛋白, 调节细胞壁纤维素合成和阿拉伯半乳聚糖蛋白含量[17],bc14基因编码核苷酸糖转运蛋白OsNST1, 定位于高尔基体, 转运 UDPG, 可能为多糖生物合成提供底物[18]。bc15基因编码一个膜相关的类几丁质酶蛋白[19]。转录因子MYB 家族和NAC 家族参与到细胞壁的合成途径, 比如NAC29/31-MYB61-CESA 通路调控细胞壁生物合成和组装来影响次生细胞壁纤维素合成[20-22]。bc12基因编码一个双靶向的驱动蛋白4, 控制水稻细胞周期进程, 揭示细胞生长和细胞壁修饰存在潜在的联系[23]。细胞壁的合成主要由不同类型的糖基转移酶来完成, 而且目前被揭示功能的酶还很少, 明确具体生化特征的更少[8]。由于水稻细胞壁的生物合成过程非常复杂, 涉及的调控途径类型多样, 新基因的发掘和研究有助于完善细胞壁合成机制, 为水稻细胞壁定向改良育种奠定理论基础。
本实验以重离子辐照诱变粳稻品种武运粳7 号(Wuyunjing 7, wyj7)获得的一个脆秆突变体为研究对象, 根据水稻脆秆突变基因命名规则和顺序, 将其称为bc17突变体(brittle culm 17), 分析bc17突变体的脆性性状对农艺特征及机械强度的影响, 通过茎秆组织结构的解剖学及细胞壁成分的测定来分析脆性形成的生物学机制, 利用遗传学及图位克隆技术将bc17突变位点进行染色体定位, 通过生物信息学分析鉴定可能的候选基因, 为进一步分离目标基因奠定基础, 同时为育种应用提供高效的筛选标记。
1 材料与方法
1.1 材料
脆秆突变体bc17、野生型武运粳7 号以及用于遗传分析和基因定位的群体材料, 均种植于中国科学院合肥物质科学研究院水稻实验基地(安徽合肥),种植方式为人工栽插, 常规田间管理。
1.2 农艺性状分析
在田间随机取10 株成熟期供试水稻材料, 考察其主要农艺特征和经济性状, 包括株高、穗长、分蘖数、每穗粒数、千粒重、结实率等。
1.3 细胞壁组分含量分析
根据Van Soest 等[24]方法测定细胞壁纤维素、半纤维素和木质素等主要组成组分含量。取成熟期的水稻材料, 将茎秆和叶片分开, 剪成适当的长度放入65℃烘箱中, 待完全烘干后取出, 用旋风磨分别将茎秆和叶片粉碎, 粉末装入干净的封口袋中以备后续实验使用。重复3 次。
1.4 bc17 茎秆机械强度测定
1.4.1 茎秆拉伸力的测定 在成熟期从田间选取新鲜水稻材料, 将茎鞘分离后截取第2 节间茎秆夹持在万能力学试验机(LD23.502, 力试(上海)科学仪器有限公司)上, 在茎秆断裂失去载荷后自动停止拉伸, 记录数据。
1.4.2 茎秆抗折力的测定 在成熟期从田间选取新鲜水稻材料, 将茎鞘分离后截取第2 节间茎秆, 放置在等间距的支架上, 用数显式拉压力计(HP-50, 乐清市艾德堡仪器有限公司)从茎秆中部向下施压使水稻茎秆折断, 记录施加力的峰值, 即为茎秆抗折力。
1.4.3 倒伏指数的计算 根据章忠贵等[25]的方法略有修改, 在成熟期采集新鲜样品, 测量相应位置的长度和重量, 计算突变体和野生型第2 节间的弯曲力矩和倒伏指数。
弯曲力矩 = 节间基部至穗顶的长度(cm) × 该节间基部至穗顶的鲜重(g) × 0.001 × 9.8
倒伏指数 = (弯曲力矩/抗折力) × 100
倒伏指数越大, 则茎秆越易倒伏, 以倒伏指数200 为抗倒伏临界值。
1.5 茎秆结构的电镜观察
取成熟期相同部位的脆秆突变体及其野生型茎秆切成2~4 mm 的小段, 投入含有2.5%戊二醛的PBS 缓冲液(4 mmol L–1sodium phosphate, pH 7.2;200 mmol L–1NaCl)中, 4℃固定48 h 后用1%锇酸PBS (phosphate buffer saline)溶液固定。固定后的样品经过PBS 缓冲液充分漂洗后, 顺序用10%、20%、40%、60%和80%的乙醇梯度各处理30 min 脱水,再用100%乙醇处理2 次各30 min, 100%丙酮处理2次各 5 min。脱水后的材料依次用 London Resin White (Sigma, USA)树脂与乙醇顺序以1∶3、1∶1和3∶1 的比例混合进行置换和浸透, 最后换入纯树脂继续浸透 48 h, 并于模块中包埋, 60℃聚合24 h。样品修块后以80 nm 超薄切片, 放置于铜网上, 观察前用醋酸铀和柠檬酸铅复染。样品放置在透射电镜上观察[26]。
1.6 脆秆突变体bc17 的遗传学分析
利用bc17突变体分别与粳稻品种(武运粳7 号和当粳8 号)和籼稻品种(特青、黄花占和9311)进行人工杂交, F1代经自交获得F2代种子。在成熟期对F2代植株进行茎秆脆性鉴定, 统计野生型和突变表型个体的数目, 并用统计学方法计算分离比例和卡方检验。
1.7 bc17 基因的染色体定位
利用对bc17/9311 杂交构建的F2分离群体对bc17基因进行初定位, 采用BSA (bulked segregant analysis)法进行基因定位, 即混合分组分析, 也称分离群体分组分析, 是一种通过在群体中挑选极端或代表性性状的个体组成混池进行分析的方法。通过研究混池之间等位基因/分子标记频率的差异, 将与性状相关的位点在基因组上进行定位。选择在水稻12 条染色体上均匀分布的408 个SSR (simple sequence repeat)标记进行亲本多态性检测, 利用筛选出的差异SSR 标记对亲本、F1植株以及混合池(20个脆秆单株等量DNA 混合)进行PCR 扩增, 对电泳产物的统计分析。在精细定位阶段, 根据网上公布的Nipponbare 和9311 序列, 并选择定位区间中存在差异的序列进行引物设计与合成。用这些引物分别对bc17和9311 基因组DNA 进行PCR 扩增。PCR程序按常规方法进行。如果PCR 产物在bc17突变体和9311 间产生多态性, 就直接用作新的SSR 或者InDel (insertion and deletion)分子标记。
1.8 数据分析
采用Origin 2018 对本文实验数据进行差异性分析和作图。
2 结果与分析
2.1 bc17 突变体的表型特征
通过对突变体bc17和野生型wyj7 在整个生育期中农艺特征的观察发现: 该突变体从抽穗期开始,株高显著低于野生型, 分蘖数明显减少(图1-A), 在拔节期时通过手工折断实验, 突变体bc17茎秆表现出韧性丧失, 能够明显折成两截折断且断口清晰,而野生型茎秆则表现出韧性, 没有断口出现难以折断(图1-B)。突变体的叶片和野生型的类似, 均只能折出痕迹, 无明显断裂(图1-C), 突变体的穗子比野生型变短, 穗粒数减少, 结实率显著降低(图1-D)。
2.2 bc17 突变体的农艺性状分析
与野生型相比, 突变体bc17的株高、穗长以及结实率极显著降低, 降低程度分别为 26.61%、27.51%以及18.54%, 每穗粒数降低了13.18%, 达到显著水平, 而分蘖数和千粒重虽然降低, 但是差异不显著(表1)。农艺性状的变化表明,bc17脆秆性状的突变对于植株的生长和发育也产生了较大的影响,可能存在一因多效。
2.3 细胞壁组分含量的分析
木质素(lignin)、纤维素(cellulose)、半纤维素(hemi-cellulose)以及灰分(主要成分是二氧化硅)是构成水稻细胞壁的主要成分。通过测定成熟期突变体bc17和野生型wyj7 茎秆、叶片的细胞壁组分含量, 结果表明, 突变体bc17叶片和茎秆的纤维素含量比野生型分别降低18.67%和22.70%, 半纤维素含量分别升高31.36%和45.76%; 野生型叶片中木质素含量显著低于突变体, 而灰分含量显著高于野生型,但是在茎秆中差异不明显(表2)。细胞壁成分在不同组织中比例的差异, 可能是引起脆性特征特异表达的主要因素。

表1 突变体bc17 与野生型wyj7 农艺性状分析Table 1 Agronomic traits of mutant bc17 and wild type wyj7
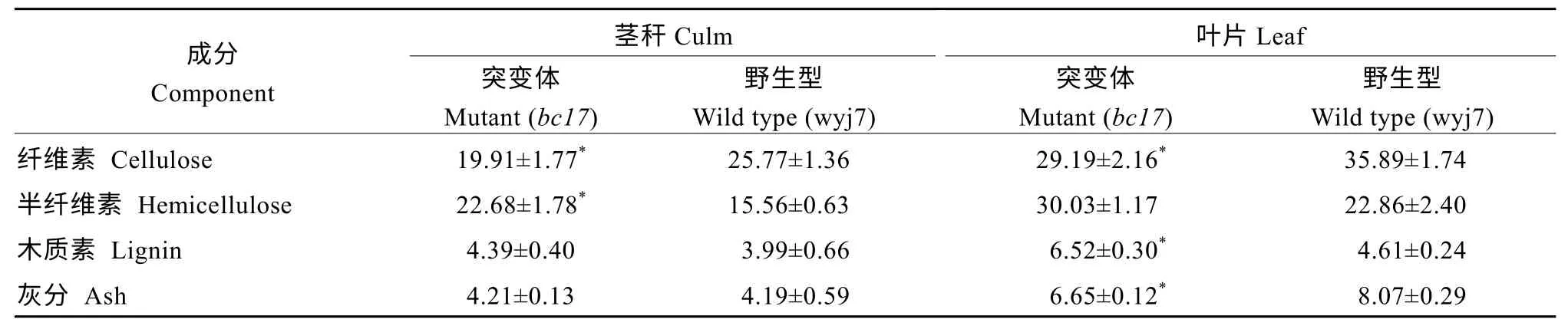
表2 野生型和突变体bc17 茎秆和叶片细胞壁成分分析Table 2 Cell wall components between wild type wyj7 and mutant type bc17 (%)
2.4 脆秆突变体bc17 茎秆的物理特征
机械强度是水稻茎秆重要的物理特征之一, 而脆秆突变是引起机械强度改变的。在成熟期时测定水稻茎秆的第2 节间和第3 节间的折断力、拉伸力。野生型wyj7 与突变体bc17茎秆的第2 节间茎秆抗折力分别为6.38 和3.33, 第3 节间茎秆抗折力分别为7.30 和4.73。bc17茎秆第2 节间抗折力比野生型降低了47.80%, 第3 节间茎秆抗折力降低了35.20%(图2), 这与田间观察的茎秆脆性特征相符, 突变体所需要的茎秆折断力明显减少, 拉伸力的测定也验证了这一点, 第2 节间突变体相对于野生型分别降低了63.65%。第3 节间突变体相对于野生型分别降低了60.34%。脆秆突变体茎秆抗折力比野生型显著下降, 可能会引起倒伏的发生, 因此计算了第2 节间的倒伏指数。结果表明bc17突变体第2 节间弯曲力矩比野生型显著下降, 引起倒伏指数比野生型升高, 但是二者差异不显著, 说明bc17突变体抗倒伏能力较强, 可能是由于突变体株高下降, 植株重心下移产生的后果。
2.5 组织解剖学观察
为了观察茎秆性状对细胞壁结构的影响, 成熟期分别对野生型wyj7 和突变体bc17茎秆第2 节间横切样品进行电镜观察, 结果发现, 突变体茎秆的厚壁组织明显变薄, 细胞之间空隙变大, 相应地细胞密度降低, 细胞数目减少, 从而造成支撑力下降,对外力响应变得敏感(图3)。
2.6 遗传分析
将突变体bc17分别与野生型wyj7 正反交得到F1, 杂交后F1代表型正常。统计杂交组合F2代中的群体单株总数以及具有脆秆表型的单株数, 计算分离比例并进行卡方检验, 结果表明, 突变体bc17与不同品种杂交的F2群体脆秆植株分离比例均符合3∶1 (P>0.05)的理论比值(表4), 这表明bc17的脆秆特征是由一对单隐性核基因控制的。

表3 野生型和突变体bc17 倒伏指数计算Table 3 Lodging index of wild type and mutant type bc17
2.7 基因定位
用bc17/9311 杂交组合F2分离群体中的97 株脆秆表型植株作为定位群体。选取均匀分布于12 条染色体上的408 对SSR 分子标记对bc17和9311 两亲本进行多态性筛选, 将具有多态性的110 对引物检测亲本。F1基因组DNA 以及突变混池DNA (选取20 个脆性单株等量DNA 混合)进行连锁分析, 其中7 号染色体上的SSR 引物RM500 和RM3743 与突变体具有良好的连锁性。利用bc17/9311 杂交组合的682 株F2 脆秆表型植株扩大群体进行精细定位, 在RM500~RM3743 之间设计多个InDel 分子标记, 最终将bc17定位在UP-81 至DN-25 之间, 物理距离约162 kb 的区间内(表5 和图4)。在水稻基因组注释网站(http://rice.plantbiology.msu.edu/)上进行生物信息学分析, 结果发现定位区间内有25 个编码蛋白, 查询这25 个蛋白的RNA-Seq FPKM (fregments per kilobase per million) 表达量, 该区间内蛋白表达量差异较大, 其中10 个蛋白FPKM 值很低, 几乎检测不到; 结合基于序列比对的生物信息学的预测发现,其中 8 个蛋白预测结果为转座相关蛋白, 成为bc17的候选基因可能性较低。通过对其中7 个功能基因测序, 在序列上没有发现涉及功能改变的序列差异, 需要进一步进行启动子测序或者表达分析来确定可能的候选基因。在bc17定位区间预测有功能的基因涉及到氨基转移酶(LOC_Os07g27780)、O-甲基转移酶(LOC_Os07g27880)、硫酯酶(LOC_Os07g 27870)等, 都有可能影响到细胞壁组分的改变, 而这些基因目前还没有相关研究报道。除了O-甲基转移酶在RNA-seq 数据库中仅在叶片中表达外, 氨基转移酶和硫酯酶全生育期表达, 其中硫酯酶在萌发前的花序中FRKM 值为9.61, 萌发后花序中FRKM值为31.63, 表达量具有时空特异性, 很可能是bc17的候选基因。
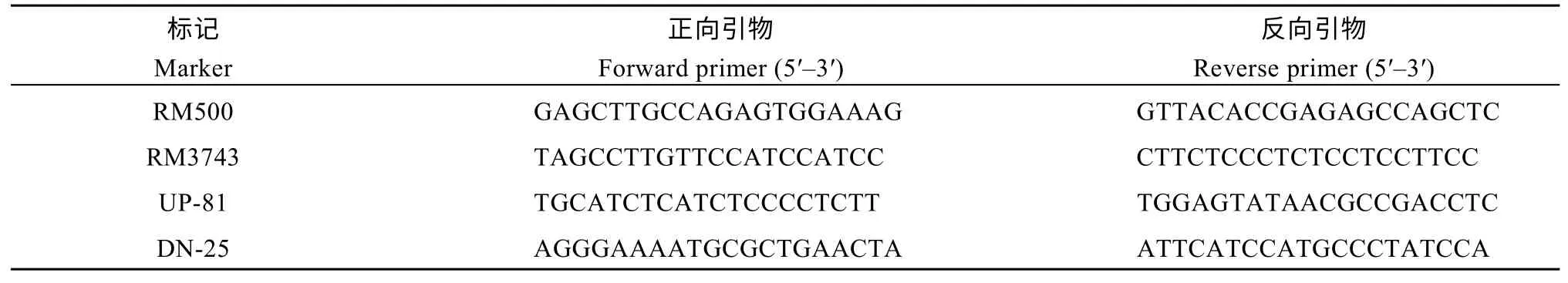
表5 bc17 基因定位部分引物Table 5 Part of the primers for bc17 gene mapping
3 讨论
目前报道的许多水稻脆性突变体都伴随着明显的表型变化, 如植株矮小, 分蘖数减少, 结实率降低以及产量下降等, 且脆性全生育期、全组织表达, 类似的有bc3和bc12等[23,26]。bc3突变体出现轻微矮化,与野生型相比bc3突变体的茎、叶、根中纤维素含量降低了28%~36%, 而其他细胞壁组分含量没有发生变化[26]。bc12突变体由于细胞数目的显著减少导致植株矮化, 纤维素微纤维的方向和细胞壁组分改变致使出现脆秆表型[23]。bc17突变体虽然植株变矮,但是脆性特征比较独特, 具有组织特异性和时间表达特异性, 与其他矮秆脆性突变体具有明显的差异。茎秆和叶片细胞壁成分测定显示, 与野生型相比,bc17茎秆和叶片都出现纤维素含量降低, 半纤维素含量升高。值得一提的是, 与野生型相比,bc17叶片木质素含量降低, 灰分升高, 也可能是导致叶片没有表现出脆性的原因。
水稻脆秆性状发生的原因, 除了涉及经典的纤维素合成途径(纤维素合酶)、多糖生物合成转运途径外, 转录因子调控途径以及细胞壁多糖乙酰化修饰等[27]对细胞壁的功能也起到重要的调控作用。叶亚峰等[20]发现OsMYB103L是MYB 家族转录因子, C端具有较高的转录活性, 可直接与OsCesA4、OsCesA7、OsCesA9以及bc1启动子区域结合调控他们的表达, 此外,OsMYB103L还参与GA 介导的纤维素合成途径的调控。周奕华等发现水稻BS1蛋白为木聚糖乙酰酯酶[28], 可从木糖吡喃糖基残基的O-2和O-3 位置的木聚糖骨架上切割乙酰基部分。在维持木聚糖主链上适当的乙酰化水平中起重要作用,参与次生细胞壁的形态建成, 这表明水稻次生细胞壁的生物合成过程非常复杂。本研究将bc17定位在7 号染色体分子标记UP-81 和DN-25 之间, 没有发现相关报道的其他脆秆基因。在bc17定位区间预测有功能的基因涉及到氨基转移酶、O-甲基转移酶、硫酯酶等, 都有可能影响到细胞壁组分的改变, 而这些基因目前还没有相关研究报道, 可能会为次生细胞壁合成的机制解析发现一条新的调控途径。
农作物传统秸秆处理如弃置农田或者直接焚烧, 由于自然状态下降解速率缓慢, 容易造成环境污染和资源浪费[29]。水稻脆秆突变体, 由于其独特的细胞壁组成和结构的变化, 收获时秸秆易破碎降解, 有利于水稻秸秆的生态还田[30]。同时, 还可以将脆性材料直接作为家畜饲料, 较低的纤维素含量更有利于反刍动物消化, 具有良好的饲料应用前景[31]。水稻秸秆是可再生的生物质原料, 可以经过水解发酵产生生物乙醇[32-33]。黄峰等利用水稻脆性秸秆为原料, 利用酸预处理且酶促糖化发酵72 h 后,脆性秸秆发酵的乙醇产量可达为普通秸秆的1.1 倍[34]。bc17突变体细胞壁纤维素含量降低, 半纤维素含量升高, 有望通过优异等位基因的发掘, 应用到生产中, 从秸秆饲料化和能源化角度解决秸秆利用的难题。
4 结论
利用重离子辐照武运粳7 号(wyj7)获得一个脆秆突变体bc17, 在抽穗后茎秆出现脆性特征, 且随着生育期进程脆秆脆性程度增加, 叶片基本表现正常。较野生型,bc17叶片和茎秆纤维素含量显著降低,半纤维素含量显著升高, 厚壁组织变薄, 细胞之间空隙变大, 相应地细胞密度降低, 细胞数目减少。该性状受一对隐性核基因控制, 被定为在7 号染色体长臂上162 kb 区间内, 生物信息学分析表明bc17可能是一个新的脆秆基因, 为进一步揭示水稻细胞壁合成机制奠定材料基础。

