高效液相色谱-串联质谱法同步检测饲料中4 种常见霉菌毒素
陈 甫,朱风华,韦 宁,王倩文,王雪琪,陈雪晓,李景景,朱连勤
(青岛农业大学动物医学院,山东青岛 266109)
霉菌毒素是由产毒真菌在适宜的环境条件下产生的有毒代谢产物,种类繁多,在自然界分布广泛,超过300 多种可在粮食生产、加工运输和贮藏等环节产生毒素[1-2]。据联合国粮农组织资料显示,全世界每年约有25% 的农作物不同程度地受到霉菌毒素污染,失去营养和经济价值,造成的损失可达数千亿美元[3-4]。霉菌毒素可以通过饲料或食品进入食物链,损伤肝脏、肾脏和神经组织等,导致畜禽生产性能下降、免疫抑制和死亡,严重威胁着畜牧业生产和畜产品质量安全[3-5]。我国是霉菌毒素污染的重灾区,黄曲霉毒素B1(AFB1)、呕吐毒素(DON)、伏马毒素B1(FB1)和玉米赤霉烯酮(ZEN)等多种霉菌毒素的污染尤为严重[3,6-8]。严格控制霉菌毒素对粮食及其加工产品的污染是保障人类和动物健康的必然要求,而检测和调查饲料中霉菌毒素的污染是防控霉菌毒素危害的重要手段之一。现今,霉菌毒素的检测方法主要有液相色谱法、荧光光度法、酶联免疫吸附法、薄层色谱法和液相色谱-串联质谱法(HPLC-MS)等[9-12]。与其他方法比,HPLC-MS 法不需要用免疫亲和柱等净化柱进行固相萃取,进行多个样品检测时具有精确度高、简便、快速、成本较低等优势,可同时测定样品中的多种霉菌毒素[9-12]。而利用HPLCMS法同时检测饲料中AFB1、FB1、ZEN 和DON 等主要霉菌毒素的研究报道较少[8]。因此,本研究在探索毒素提取方法的基础上,建立了能同时测定饲料中AFB1、FB1、ZEN 和DON 等4 种毒素的HPLC-MS 法,以期为饲料中霉菌毒素的检测、污染调查及风险评估提供技术支撑。
1 材料与方法
1.1 样品采集 本试验所用样品采集自山东部分地区不同厂家生产的饲料,采样方法按照国家标准(GB/T 14699.1-2005)进行,共采集潍坊、青岛、烟台三地饲料厂肉鸡配合饲料20 份和玉米34 份。样品处理前-20.0℃保存,处理时从冰箱取出,恢复至常温,混匀后应用粉碎机碎粉,过40 目筛,备用。
1.2 主要仪器与试剂 高效液相色谱串联三重四极杆质谱仪(1290 Infinity/6460 HPLC-MS,Agilent 公司)、粉碎机(HC-400Y,永康市石柱铂欧五金厂)、分析天平(JA2003A,上海精天电子仪器有限公司)、漩涡混匀器(MX-S/F,大龙兴创实验仪器(北京)股份公司),C8 柱:150.0 mm×3.0 mm,粒径 3.0 μm。AFB1、FB1、ZEN 和DON 毒素标准溶液和ELISA 检测试剂盒(青岛普瑞邦生物工程有限公司);乙腈(色谱纯,德国默克)、纯甲醇(色谱纯,德国默克)、甲酸(色谱纯,美国FISHER),醋酸铵(色谱纯,ACS 恩科)。
1.3 高效液相色谱串联质谱(HPLC-MS)法
1.3.1 样品处理条件优化 称取样品5.0 g,加入50 mL 离心管中,加入提取液25 mL 进行提取,涡旋混匀2 min,置气浴摇床中提取1 h;取出样品,定量滤纸过滤,滤液经0.22 μm 有机滤膜过滤,待测。
1.3.1.1 提取液的筛选 称取同一样品25 份,每份5.0 g,分为5 组,每组5 个重复。每组分别加入以下5 种提取液(表1):84%乙腈:水、50%乙腈:水、75%甲醇:水、50%甲醇:水、水25 mL 进行提取,按照上述处理后待测。

表1 5 种毒素提取液配比
1.3.1.2 氮吹干试验 称取同一样品10 份,随机分为2 组,每组5 个重复。每个重复加入乙腈:水(84:16,V/V)25 mL 进行提取,按照上述处理后得滤液。一组取滤液经0.22 μm 滤膜过滤直接检测,另一组在50℃下氮吹干,残留物加1.0 mL 乙腈:水溶液,0.22 μm 滤膜过滤,待测。
1.3.2 液质条件 以各毒素标准品为检测对象,在正负离子模式下进行全扫描,形成扫描检测图,以选择合适的准分子离子峰和电离方式,确定每种毒素的扫描模式。依据基质空白同基质标准溶液的离子扫描图,优化锥孔电压、碰撞能量等仪器的参数,把每个检测离子的强度调节到最高,寻找各毒素在多反应检测模式下相应的特征离子对,确定最佳质谱条件。
1.3.2.1 洗脱条件 C8 色谱柱柱温25~33℃,进样量20.0 μL,流动相为1.0%甲酸醋酸铵溶液,梯度洗脱流速条件见表2。

表2 ESI 源梯度洗脱条件
1.3.2.2 质谱条件 离子源为电喷雾离子源,扫描方式为正负离子扫描,检测方式为多反应监测。质谱测定参数见表3。

表3 质谱测定参数
1.4 标准曲线的绘制 将不同浓度的毒素梯度标准样品分别进行测定,以峰面积(x)为横坐标,毒素浓度(Y,μg/L)为纵坐标,进行线性回归,计算线性范围、系数(R2)、线性回归方程。
1.5 加样回收率和精密度试验 取配合饲料、玉米各12份,共计24 份,每份5.0 g。每类样品12 份分别加入3 个浓度水平(50、100、500 μg/kg)的AFB1、FB1、ZEN 和DON,按照1.3 进行样品处理和毒素检测,平行测定6 次,观察方法的精密度和回收率。
1.6 重复性试验 取一份配合饲料和玉米样品,按照样品制备方法平行制备8 次,分别测定AFB1、FB1、ZEN和DON 含量,计算各毒素的相对标准偏差(RSD)值。
1.7 统计分析 应用SPSS 22.0 统计分析软件对提取液、氮吹干试验毒素检测结果进行单因素方差分析,并应用Duncan's 多重比较进行差异显著性检验,试验数据用(平均值± 标准差)表示,差异显著水平为P<0.05。回收率、精密度和重复性试验检测结果用平均值表示,计算RSD 值,判定回收率、精密度和重复性。
2 结果与分析
2.1 质谱定性定量分析结果 分别在正离子和负离子模式下对4 种霉菌毒素的标准溶液进行全扫描,发现DON、FB1和AFB1在正离子模式下响应高,ZEN 在负离子模式下响应高。对4 种毒素的标准溶液在正负离子模式下进行全扫描,AFB1、DON、FB1和ZEN 分别得到313.1、722.4、297.2 和 317.0 准分子离子峰。将不同毒素对应的峰分别进行二级质谱全扫描。AFB1、FB1、DON 在正离子模式下形成的定量离子对为313.1、297.2 和722.4,ZEN 在负离子模式下形成的定量离子对为 317.0,AFB1、DON 和FB1在正离子模式下形成的定性离子对为241.0、334.1、265.1 和ZEN 在负离子模式下形成的定性离子为175.1。应用HPLC-MS 法检测4 种霉菌毒素色谱图发现,FB1在2.8~3 min 出峰,AFB1在3.8~4 min 出峰,DON 在4.7~4.9 min 出峰,ZEN在5.1~5.3 min 出峰。
2.2 样品前处理条件结果
2.2.1 不同提取液对毒素检测结果的影响 如图1 所示,应用不同的提取液对同一样品中的4 种霉菌毒素提取检测后发现,应用84%乙腈水、75%甲醇水和50%甲醇水提取FB1优于50%乙腈水和水,应用84%乙腈水提取AFB1优于其他4 种提取液,应用84%乙腈水和50%乙腈水提取DON 优于其他3 种提取液,应用84%乙腈水和水提取ZEN 优于其他3 种提取液。综上所述,选取84%乙腈水作为AFB1、FB1、ZEN 和DON 的提取液。
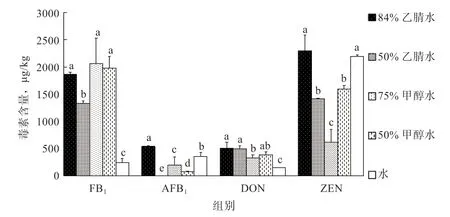
图1 5 种提取液对4 种霉菌毒素提取效果的比较
2.2.2 氮吹干对毒素检测结果的影响 由图2 所示,样品经氮气吹干浓缩5 倍后,AFB1、FB1、ZEN 和DON浓度均较未浓缩时的毒素浓度显著下降。这说明毒素在氮气吹干的过程中可能会因挥发导致回收率下降,检测值降低。若检测过程需要浓缩,建议降低氮气吹干的温度或加入保护剂。

图2 氮吹干对4 种毒素检测结果的影响
2.3 标准曲线与检出限结果 将毒素标准样品根据配合饲料和原料中的毒素含量倍比稀释,AFB1、FB1、ZEN、DON 浓度分别在0.01~1 000 μg/kg、10~2 000、0.1~2000、10~100 000 μg/kg 时,峰面积和毒素浓度呈现出良好的线性关系,相关系数R2值均在0.99 以上,如图3 所示。另外,本方法AFB1、FB1、ZEN 和DON的检出限分别为0.005、10、10、0.1 μg/kg,定量限分别为0.01、10、1.0 μg/kg 和1.0 μg/kg,说明同时检测DON、AFB1、FB1和ZEN 的HPLC-MS 法灵敏度高。

图3 HPLC-MS 法检测AFB1、FB1、ZEN 和DON 毒素的标准曲线
2.4 回收率和精密度结果 由表4 可知,DON、AFB1、FB1和ZEN 检测回收率分别为95.93%~100.29%、95.12%~106.04%、99.83%~103.28%、98.73%~100.73%,RSD值分别为0.18%~1.58%、3.20%~3.61%、0.32%~1.70%、0.95%~0.98%。说明同时检测DON、AFB1、FB1和ZEN 的HPLC-MS 法回收率高,精密度好。

表4 不同毒素在基质中的加样回收率和精密度
2.5 重复试验结果 配合饲料和玉米样品平行8 次检测,计算得出AFB1、DON、FB1和ZEN 的RSD 值为0.26%、0.08%、3.52% 和0.20%。说明本方法检测AFB1、DON、FB1和ZEN 重复性良好。
3 讨 论
3.1 样品前处理条件优化 毒素的提取处理对检测方法的准确性至关重要,而不同毒素在水和有机溶剂中的溶解度不同,提取率也不相同。因此,选择提取率高的毒素提取液能同时提取多种霉菌毒素至关重要。本研究利用5 种提取液对4 种毒素进行提取,结果发现84% 乙腈水提取AFB1、FB1、ZEN 和DON 的效果优于其他4种提取液。这与朱聪英等[13]研究结果相同。赵健等[14]和辛媛媛等[15]研究发现,乙腈-水-甲酸混合液提取大米和玉米中的真菌毒素效果好,回收率高。赵健等[14]研究发现,乙腈-水-甲酸混合液提取小麦中的真菌毒素效果好,回收率高。本研究没有在提取液中加入甲酸,需要在以后的实验中进一步研究。另外,为提高毒素检测的精确度,多项研究均在毒素提取后对提取液进行了浓缩,而未对氮吹干技术进行验证。本研究经过对氮吹干技术探索,发现经氮吹干浓缩提取液后4 种毒素的浓度均较未浓缩时的毒素浓度显著下降。溶剂和温度均能对毒素浓度产生影响,毒素在氮气吹干的过程中可能会因温度高和挥发导致回收率下降,检测值降低[16]。若检测过程需要浓缩,建议降低氮气吹干的温度或加入保护剂。因此,检测样品中毒素进行提取后,为提高毒素检测精度,应对氮吹干技术对毒素检测效果的影响进行评测。
3.2 液质条件的优化 液质条件是决定HPLC-MS 法分离目标化合物与检测成功的关键,目标化合物在液相色谱柱中的分离是粗分离,进入质谱后,由一级质谱选择母离子,将其打碎,再由二级质谱选择碎片离子,从而进行定性定量。通过正离子模式和负离子模式的全扫描可选择合适的准分子离子峰和电离方式。霉菌毒素的极性较弱,通过HPLC-MS 法在正离子和负离子模式下进行全扫描,AFB1、FB1、DON 在正离子模式下形成定量离子,ZEN 在负离子模式下形成的定量离子对。通过色谱图发现色谱峰保留时间适中,峰形较好,说明色谱峰响应较好。这些结果与应永飞等[17]和郑荣等[10]的研究结果相似,是检测此4 种毒素较好的液质条件。
3.3 方法可行性分析 方法验证在分析方法建立过程中具有重要的作用,并已成为质量研究和质量控制的重要组成部分,其中,线性、回收率、精密度和重复性试验等是评价分析检测方法确实可行的主要检验项目和验证指标。本研究发现,HPLC-MS 法检测饲料中AFB1、FB1、ZEN 和DON 的峰面积和毒素浓度呈现出良好的线性关系,检出限和定量限均较低,回收率和精密度高,重复性良好。通过前期的调查应用,确定了HPLC-MS 法能同检测多种饲料中的AFB1、FB1、ZEN和DON[8]。这些结果进一步说明HPLC-MS 法检测霉菌毒素确实可行,而且具有简便、快速、准确度高和灵敏度好的优点[18-20]。
4 结 论
本研究建立同时检测饲料中4 种霉菌毒素的HPLC-MS 法,经线性、精确度、精密度和重复性试验,确认本方法简单、快速、线性良好、精密度高、重现性好,适用于饲料中霉菌毒素的定量定性检测。

