熊果酸经NF-κB 通路抑制LPS 诱导奶牛子宫内膜上皮细胞炎性反应
王俊博,高 峰,韩文昌,曹荣峰,付开强
(青岛农业大学动物医学院,山东青岛 266109)
奶牛子宫内膜炎是导致奶牛不孕的主要原因之一[1],其病因主要是大肠杆菌等革兰氏阴性菌感染[2]。临床上多采用子宫灌注抗生素来治疗奶牛子宫内膜炎[3],但抗生素治疗易产生细菌耐药性且造成牛奶中抗生素残留,因此“减抗和替抗”、中药治疗成为当今的研究热点。本课题组前期用革兰氏阴性菌细胞壁的脂多糖(LPS)成功构建了奶牛子宫内膜炎细胞模型[4],并对系列中药单体的抗炎作用进行初步研究,发现多种中药成分均能抑制炎性反应,抗子宫内膜炎复方中药中一般都含天然三萜羧酸化合物——熊果酸(UA),UA 广泛分布于7个科46 个属的62 种植物中,其参与植物的防御作用,对动物有抗氧化、抗炎和抗癌等作用,是我国批准的二类新药[5-6]。UA 具有抗炎、抗氧化等生物活性[7],能通过调节MAPK/NF-κB 信号通路来抑制四氯化碳诱导的肝脏炎症[5]。而UA 对奶牛子宫内膜上皮细胞炎性反应的作用及其机制尚未见报道。本实验旨在探讨在体外细胞模型中UA 对炎性细胞因子和NF-κB 信号通路活化情况,研究该药对奶牛子宫内膜炎的抗炎作用及其调控信号通路,为挖掘熊果酸的临床应用提供数据支持,也为筛选抗奶牛子宫内膜炎的中药成分提供方法。
1 材料与方法
1.1 细胞系、主要试剂和仪器 奶牛子宫内膜上皮细胞(GD-C0507,上海冠导生物工程有限公司);熊果酸(纯度≥98%,北京索莱宝科技有限公司);脂多糖(O111:B4,美国Sigma-Aldrich 公司);HiScript II One Step qRT-PCR SYBR Green Kit 试 剂 盒、FastPure Cell/Tissue Total RNA Isolation Kit V2 试剂盒、BCA 试剂盒(南京诺唯赞生物科技股份有限公司);CCK8 试剂盒(北京比奥生物科技有限公司);Phospho-NF-κB P65、NF-κB P65、Phospho-IκBα(bs-0982R、bs-0465R、bs-18129R,北京奥博森生物技术有限公司);IκBα(10268-1-AP,武汉三鹰生物技术有限公司);β-actin(ab8227,英国Abcam 公司);二抗Goat Anti-rabbit IgG/HRP(bs-0295G,北京博奥森生物技术有限公司)。荧光定量PCR 仪(瑞士Roche 公司);全自动酶标仪(RT-6000 型,美国Rayto 公司)等。
1.2 CCK8 比色法测定细胞活力 BEECs 用含10%胎牛血清的EMEM,5%二氧化碳37℃培养,用0.25%胰蛋白酶进行传代。将细胞接种于96 孔板中,1×104个/孔,培养24 h,加0、1、5、10、20、50 和100 μmol/L UA 100 μL 处 理3 h,再 加10 μL 的CCK8,孵 育3 h,用酶标仪在450 nm 处检测吸光值。
1.3 试验设计 根据课题组建立的BEECs 炎性反应模型,利用1 μg/mL 的LPS 刺激3 h 使BEECs 发生炎症反应,换液后用合适浓度UA(5、10、20 μmol/L)处理BEECs 3 h。试验分为5 组,分别为空白对照组、LPS 组和LPS+UA(5、10、20 μmol/L)组,以进行后续试验。
1.4 qRT-PCR 测mRNA 含量 用试剂盒提取各组中BEECs 总RNA,检测RNA 浓度。试剂盒检测mRNA 含量的反应条件为:50℃反转录3 min,95℃预变性30 s,95 ℃ 10 s,60 ℃ 30 s 循环40 次。PCR反应体系20 μL:10 μL 2 × One Step SYBR Green Mix,1 μL One Step SYBR Enzyme Mix,0.4 μL 引物(10 μmol/L,序列见表1),2 μL RNA模板(20 ng/μL),RNase-free ddH2O补至20 μL,检测IL-1β、IL-6、TNF-α的mRNA 表达。

表1 引物信息
1.5 蛋白免疫印迹分析 试剂盒提取各组细胞蛋白并测蛋白浓度,加入等体积的2×Buffer,95℃煮5 min。分别用10% 分离胶和5% 浓缩胶制作电泳凝胶板,每孔加入30 μg 样品,电压120 V,电泳70 min。切割凝胶在转膜液中浸泡后,置于转膜槽中,电流220 mA,转膜90 min。5% 脱脂奶粉,摇床2 h 封闭;弃封闭液,TBST 洗3 次,将膜放入一抗孵育液中 4℃过夜。回收一抗,TBST 洗膜3 次,每次10 min;加入二抗(1:2000)孵育,摇床2 h 后,TBST 洗膜3 次,每次10 min;ECL 孵育、显影并用Image J 计算各蛋白带灰度值,以β-actin 作为内参。
1.6 统计分析 使用GraphPad Prism 8.0 的单因素方差分析(One-way ANOVA)进行统计分析,P<0.05 和P<0.01 分别表示差异显著和极显著。
2 结果
2.1 UA 对BEECs 活力的影响 如图1 所示,与空白对照组相比,UA 浓度为100 μmol/L 时BEECs 的存活率极显著降低。

图1 UA 对BEECs 活力的影响
2.2 UA 对LPS 诱导BEECs 促炎性细胞因子基因表达水平 的影响 由图2 可知,LPS 刺 激后,IL-6、TNF-α和IL-1β的基因表达水平较空白对照组均有提高(P<0.01);而加入UA 后3 种促炎性细胞因子的基因表达水平较LPS 组均下降(P<0.01)。
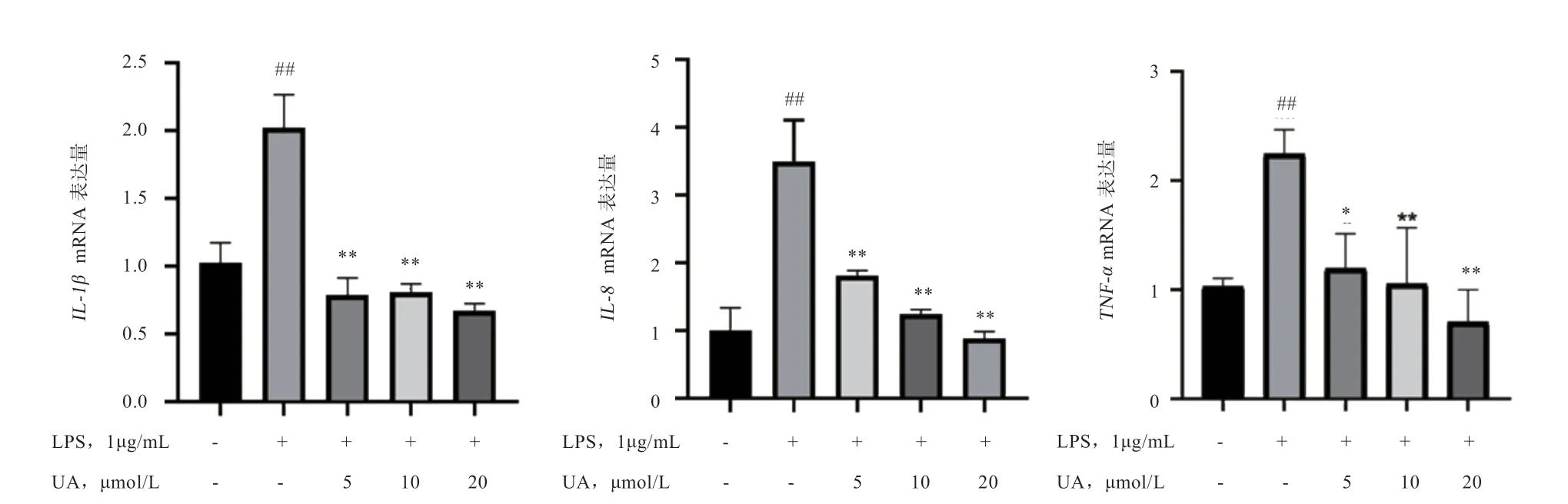
图2 UA 对LPS 诱导BEECs 促炎性细胞因子基因表达水平的影响
2.3 UA 抑制BEECs炎性反应中NF-κB通路相关蛋白含量的变化 如图3 所示,用LPS 刺激BEECs 3 h 后,与空白对照组相比,p65 和IκBα的磷酸化水平显著升高,IκBα的表达水平显著降低;而在加入UA 处理后,与空白对照组相比,p65 和IκBα的磷酸化水平显著降低,IκBα的表达水平显著升高,且与空白对照组表达水平基本相同,p65 蛋白含量未发生变化。
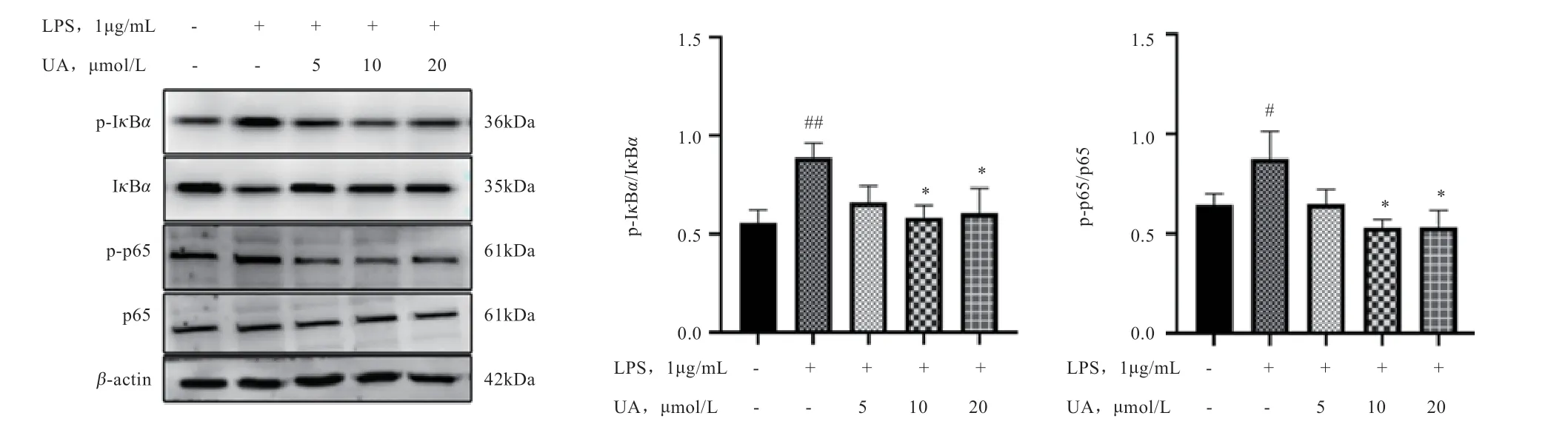
图3 UA 对LPS 诱导BEECs NF-κB 信号通路的变化
3 讨 论
奶牛子宫内膜受到革兰氏阴性菌侵袭,细菌释放的LPS 被子宫内膜上皮细胞的TLR 识别,进入细胞内使IκB激酶(IKK)活化,IKK 将IκB/NF-κB复合物中的IκB 亚基调节位点的丝氨酸磷酸化,使得IκB 亚基被泛素化修饰,NF-κB p65 活化为p-p65 转移到细胞核中,致使上述促炎因子转录,并翻译大量TNF-α、IL-6和IL-1β等促炎性细胞因子,进而使子宫内膜上皮细胞发生炎性反应[9-14]。本研究发现,1 μg/mL LPS 处理BEECs 3 h 后,IL-1β、IL-6和TNF-α的mRNA 显著升高,能够促进p65 和IκB 磷酸化。因此LPS 能够代表革兰氏阴性菌的侵袭作用,构建奶牛子宫内膜炎的细胞模型。
通过围绕奶牛子宫内膜炎的细胞模型进行研究后发现,小檗碱、丹参酮等中药单体能下调促炎性细胞因子,抑制子宫内膜的炎症反应[15-17]。UA 不论单独使用,还是与其他药物配合使用,均具有显著治疗病毒性肝炎[7]和抑制胃肿瘤细胞的增殖和炎症反应的作用[18]。本试验通过CCK-8 发现,UA 浓度在1~50 μmol/L 时对BEECs 活力无影响,UA 浓度为100 μmol/L 时BEECs的存活率较空白对照组极显著降低,因此,本试验选用UA浓度是5、10、20 μmol/L处理BEECs 3 h 进行后续试验。
qRT-PCR 结果表明,LPS 刺激后,IL-6、TNF-α和IL-1β3 种促炎性细胞因子的基因表达水平均极显著提高,说明BEECs 发生了炎性反应。而加入UA 处理后,3 种促炎性细胞因子的基因表达水平均显著下降,因此,可以认为UA 可以抑制LPS 诱导BEECs 发生的炎性反应。通过Western blot 结果表明,LPS 激活了BEECs炎性反应中NF-κB 通路。而加入UA 处理后能够降低p65 磷酸化,并减少IκB 降解及磷酸化,说明作为抗氧化、抗炎的UA 能够通过抑制NF-κB 信号通路减轻LPS 诱导BEECs 的炎性因子基因表达。
4 结 论
本试验结果表明,LPS(1 μg/mL)刺激3 h 能诱导BEECs 炎性反应,UA 可通过抑制NF-κB 信号通路减轻LPS 诱导奶牛子宫内膜炎细胞模型的炎性反应,有望成为抗奶牛子宫内膜炎的新型药物。

