马遗传缺陷的研究进展
张叶青,曾申明
(中国农业大学动物科学技术学院,北京 100193)
我国是传统养马大国,品种资源丰富。2020 年末,我国马匹存栏量为367.16 万匹,共有29 个地方品种,13 个培育品种,9 个引进品种[1-2]。近年来,随着现代马业的逐渐兴起,与其紧密相关的体育运动、休闲骑乘、文化旅游、马产品开发等新业态蓬勃发展,需要不断扩大优秀马的群体规模,以适应产业转型升级需求[3]。遗传缺陷是由于染色体或染色体所携带的遗传物质发生异常而导致个体生理状态出现不同程度的损害,可引起马匹身体缺陷或生理功能障碍,进而影响生产、运动性能和生活力,甚至导致死亡,具有垂直传递和终生携带的特点[4]。根据诱因不同,遗传缺陷可分为染色体畸变和基因突变2 种,迄今所发现的家畜遗传缺陷大部分由相关基因突变所致[4]。
遗传缺陷会大大降低马的经济价值,同时对优秀马种的繁育和稀有马种保护带来较大危害,最终影响整个马产业的可持续发展。然而,在我国马的主要先天缺陷及相关基础数据缺乏,遗传缺陷的监测体系处于空白状态。因此,本文将从马遗传缺陷的发展历程、马常见单基因遗传缺陷、国外马遗传缺陷检测技术和我国马遗传缺陷的研究现状等方面,概述国内外马遗传缺陷的研究进展,并探讨构建我国马群遗传缺陷监测体系、降低遗传缺陷对我国马产业的重要意义。
1 马遗传缺陷的发展历程
马遗传检测始于20 世纪60 年代,最早采用血液进行亲子鉴定[5]。20 世纪70 年代,Hughes 等[6]首次报道了与母马不育相关的染色体变异,如XO、XO/XY、XO/XX 和XY 型。随后,染色体显带技术的应用促进了常染色体缺失、3 倍体和染色体易位的鉴定和诊断[7]。1992 年,Rudolph 等[8]首次在分子水平上发现与马遗传缺陷相关联的遗传标记。此后15 年内,人们仅发现9 种引起马遗传缺陷的基因突变[9]。
2007 年,国际马基因组计划完成了纯血母马血样测序工作,并将马基因组序列草图数据全部存入公共数据库,该参考基因组命名为EquCab2.0[10]。2018年,第2 版的马基因组组装草图宣布完成,命名为EquCab3.0。自马参考基因组发布以来,极大地推动了马遗传学的研究,对于马健康和运动性能研究产生了革命性影响,与遗传缺陷关联的因果突变或高度相关突变的发现随之加速。截至目前,距马基因组数据公布仅14 年,根据OMIA 的统计,现已发现马遗传缺陷共245 种,其中鉴定为单基因遗传的共60 种,已阐明分子机制的共46 种,作为人类疾病潜在模型的共计138 种,同时催生了多种分子遗传学诊断技术与服务平台[11]。
2 马常见单基因遗传缺陷
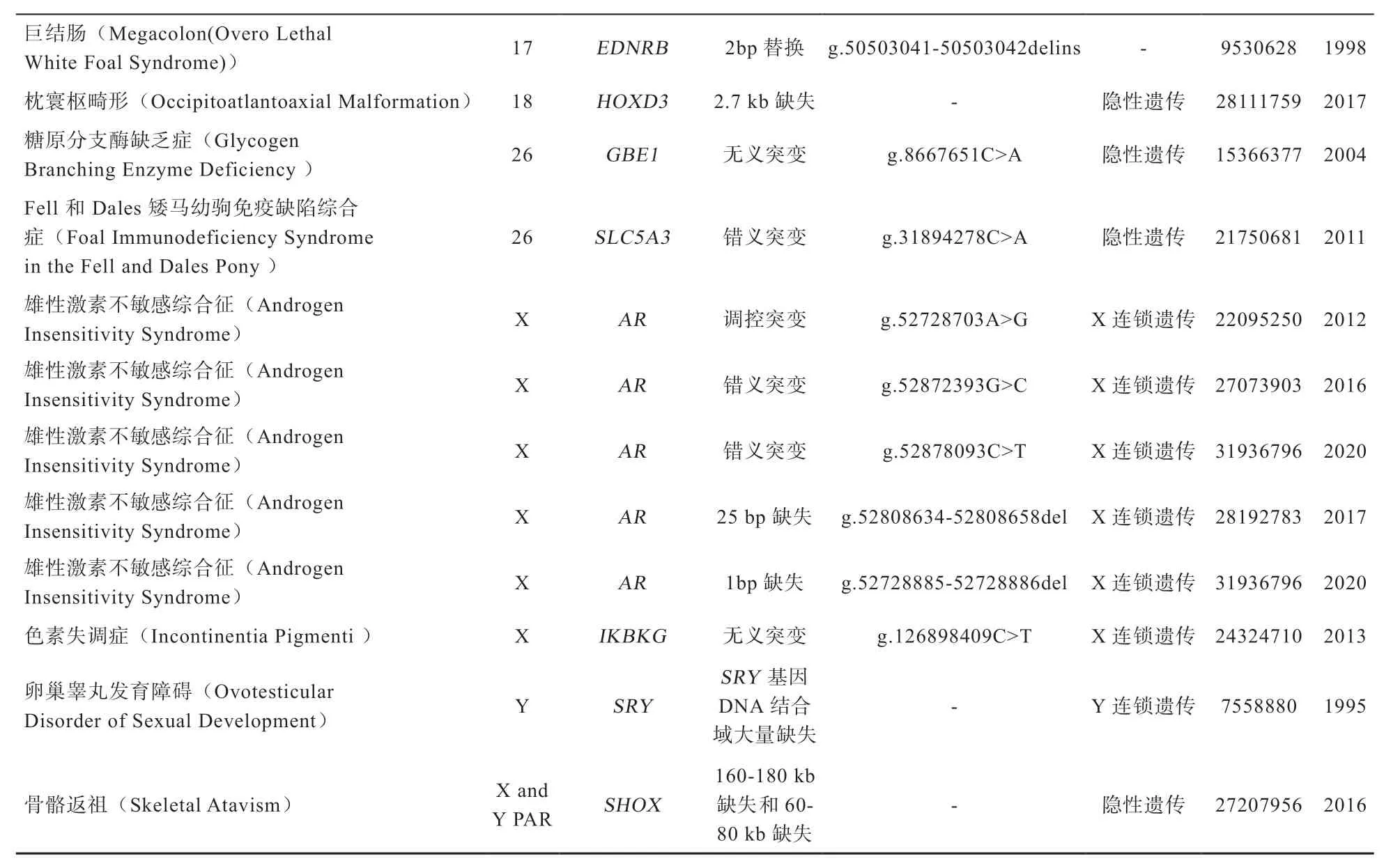
单基因遗传缺陷是指由一对等位基因控制并符合孟德尔定律遗传的缺陷。迄今为止,几乎所有已完全表征的马遗传缺陷都属于单基因遗传缺陷,虽然数量相对较少,但对马的生产性能和生活力产生明显影响[12]。表1汇总了近年来报道的马单基因遗传缺陷[6,13-22],后文将对5 种常见单基因遗传缺陷作进一步介绍。
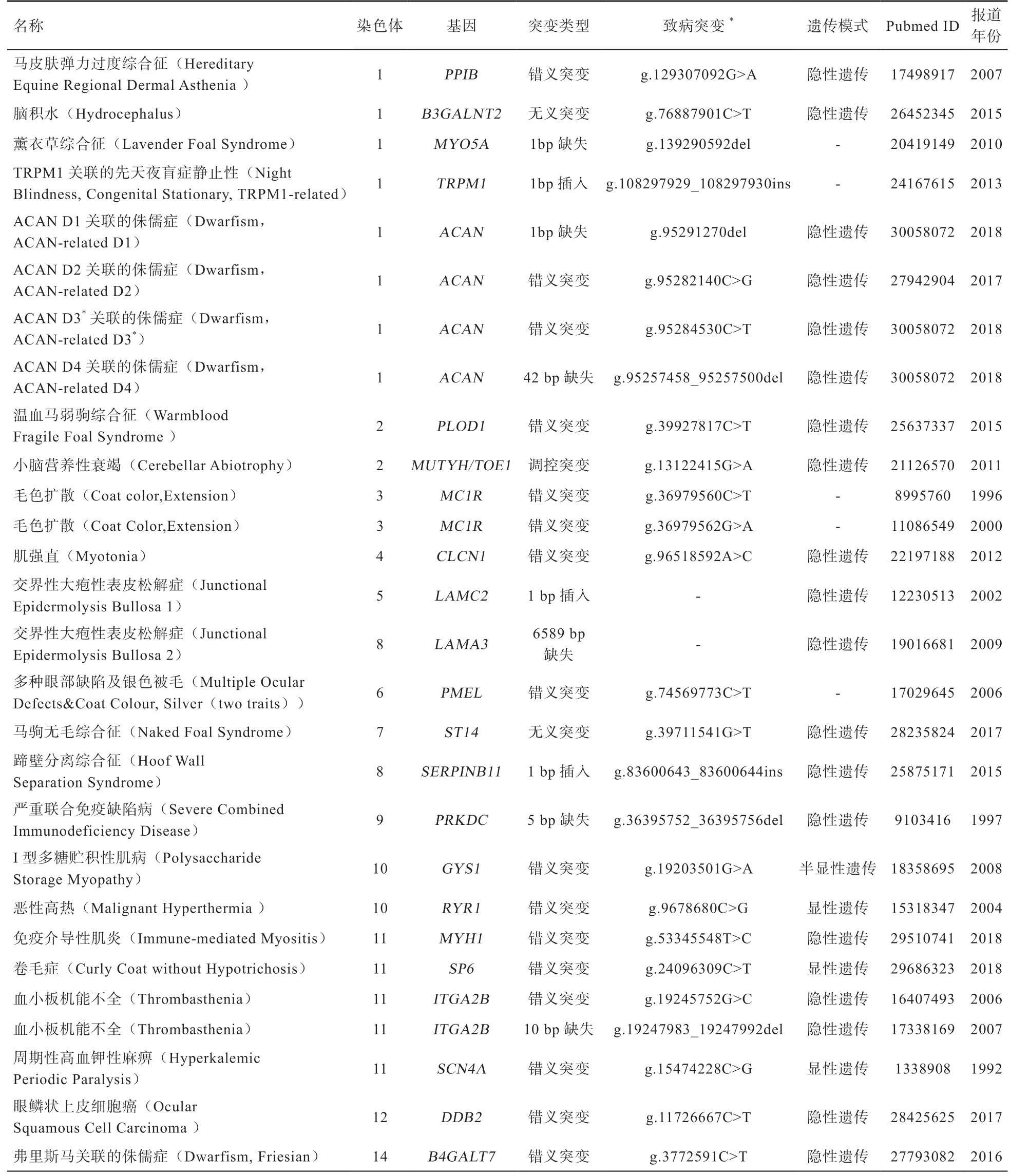
表1 马常见的单基因遗传缺陷列表
注:*致病突变位置基于马参考基因组 EquCab3.0 版本。
2.1 周期性高血钾性麻痹(Hyperkalemic Periodic Paralysis,HYPP)HYPP 是常染色体单基因显性遗传病,HYPP马由于SCN4A基因发生错义突变(c.4248C>G),导致电压门控钠通道α亚基的跨膜结构域IVS3的苯丙氨酸被亮氨酸取代,致使钠通道的持续开放与钠离子持续内流,细胞膜持续去极化,机体表现出非自主性肌肉痉挛[23]。HYPP 典型症状包括肌肉痉挛、无力或麻痹,患病马通常由于上呼吸肌麻痹而呼吸困难,严重时可因窒息或心力衰竭而猝死。HYPP 临床症状常见于2~3 岁幼驹,因发作时间较短(通常持续15~60 min)而被忽视。在一项SCN4A 基因突变起源研究中,所有HYPP阳性夸特马均可追溯至一匹1969 年出生的夸特种公马“IMRESSIVE”[24]。在1992—1995 年的一项研究中,对收集2 万多份夸特马样本进行HYPP 的基因检测,发现杂合突变个体占36%,纯合突变个体占1%[25]。
2.2 糖原分支酶缺乏症(Glycogen Branching Enzyme Deficiency,GBED)GBED 是一种常染色体单基因隐性遗传病,GBED 马由于GBE1基因发生无义突变(c.102C>A),导致原编码酪氨酸的密码子TAC 转变为终止密码子TAA,引起功能性糖原分支酶(GBE)失活,导致功能性糖原无法在肌肉和肝脏中储存,机体供能不足而衰竭死亡[26]。GBED 临床症状包括母马妊娠末期流产,初生马驹通常体温过低、呼吸衰竭、肢体畸形及猝死,多数在出生后8 周内施与安乐死,纯合个体无法活过18 周。在美国,1.3%~3.8% 夸特马及其相关马种的流产与GBED 相关[27]。此外,夸特马及其相关马种是GBED 的高发群体,GBED 在夸特马和花马的杂合率分别为8.3%和7.1%[28]。
2.3 I 型多糖贮积性肌病(Polysaccharide Storage Myopathy 1,PSSM1) PSSM1 是一种常染色体单基因半显性遗传病,PSSM1 马由于GYS1基因发生错义突变(c.926G>A),引起糖原合成酶(GS)高度保守区域发生精氨酸到组氨酸的替代(p.R309H),导致骨骼肌内糖原异常积累,出现横纹肌溶解症[29]。PSSM1 马的临床症状因严重程度而异,包括肌肉麻痹、疼痛、步态异常、无法站立、急性横纹肌溶解和肌红蛋白尿等,严重时可威胁生命,杂合个体出现中度症状。
最早对于PSSM 的报道可追溯至1932 年,役用马在休息后突然使役,出现横纹肌溶解症状。2008 年,McCue 等[29-30]报道GYS1突变至少存在于17 个品种,在挽马(87%)和夸特马及其相关品种(72%)中发病率较高,并推测GYS1突变可能源于1200~1500 年前,即现代品种分化之前。然而,在某些情况下,PSSM 表型与GYS1-R309H 突变无关,但发生机理尚不清楚,这类症状称为PSSM2。
2.4 恶性高热(Malignant Hyperthermia,MH) MH是一种常染色体单基因显性遗传病,MH 马由于RYR1基因发生错义突变(c.7360C>G),导致骨骼肌肌浆网ryanodine 受体(钙释放通道)出现异常,钙离子过度释放至肌浆,进而引发一系列临床症状,导致机体进入致命性高代谢亢奋状态[31]。通常,易感马匹在某些诱因作用下,如吸入挥发性麻醉剂、去极化肌肉松弛剂或应激条件下可出现MH[29]。MH 典型临床症状包括肌肉痉挛,体温快速升高(>40℃),心跳过快,心律不齐,呼吸急促,肌肉痉挛,其他症状包括高碳酸血症、乳酸中毒和高钾血症等,多数情况下致死。如果MH 马患有PSSM1 突变时,将会导致更为严重的临床症状。
2.5 马皮肤弹力过度综合征(Hereditary Equine Regional Dermal Asthenia,HERDA)HERDA 是一种常染色体单基因隐性遗传病,HERDA 马由于PPIB基因发生错义突变(c.115G>A),导致在脊椎动物严格保守区域内发生谷氨酸被甘氨酸取代(p.39G>R)。HERDA 马临床症状包括皮肤过度伸展、瘢痕形成,沿背部形成血清瘤、血肿和溃疡。患病马通常在装备鞍具训练后发现,发生概率及严重程度随年龄增长而增加,影响涉及全身组织,包括眼结膜、血管和心脏等[32]。通常HERDA 马在1.5~2 岁时出现临床症状,由于无法治疗,可迅速恶化[32]。有数据表明,3.5%已注册登记夸特马和28.3%的用于截牛的马匹是HERDA 隐性携带者[33]。
3 国外马遗传缺陷检测技术的发展现状
过去,马遗传缺陷检测方法与一般疾病诊断类似,即对病史、症状和体征进行分析,属于“由果溯因”型[34]。多数遗传缺陷具有一系列临床症状,有的由部分症状组成特有的症候群,根据特征性临床症状和症候群可初步诊断[35]。由于遗传缺陷与其他疾病的最大区别在于患病个体遗传物质发生改变,这种改变将按照遗传规律在世代间传递,因此,准确检测遗传突变是判断疾病发生的关键。一般单基因遗传缺陷遵照孟德尔遗传规律,临床上常应用系谱分析法即可判断[36]。多基因遗传缺陷的病因较复杂,遗传分析方法主要包括连锁分析、关联研究和动物模型的多基因分析等[37]。然而,遗传病通常具有发作延迟、外显不全等特点,且易于其他疾病混淆,对诊断人员的专业能力、实操经验等要求较高。因此,有的遗传病仅凭临床检测不能确诊,只能提示遗传病的可能,一般无法诊断隐性杂合个体,确诊还必须开展进一步的实验室诊断。
随着马参考基因组序列的公布和基因组学技术的迅猛发展,马遗传缺陷检测技术由传统表型诊断向现代分子诊断转变,标志着马疾病诊断逐步迈入精准医疗时代[38]。目前,马遗传缺陷检测主要方法包括核型分析、基因芯片、聚合酶链式反应(PCR)及其衍生技术和基因测序等。全球越来越多的公司或实验室提供检测服务,截止2020 年,21 种遗传缺陷可进行商业检测[39],通常由马主自行采集马毛或血液后送至检测机构进行检测。在马业发达国家,一些品种登记机构通常不强制要求检测遗传病。但近年来,随着部分遗传缺陷的发病率和死亡率呈现增高的趋势,越来越多的登记机构委托相关公司对特定品种的高发性遗传缺陷进行检测,其中包括美国夸特马协会(American Quarter Horse Association,AQHA)、美国花马协会(American Paint Horse Association,APHA)、美国比利时重挽马公 司(Belgian Draft Horse Corporation of America)、康尼麻拉马繁育者协会(Connemara Pony Breeders'Society)、费尔小型马协会(Fell Pony Society)、威斯特法伦温血马协会(Westfalen Warmblood)、德国乘用小型马协会(Germany Riding Pony)、北美皇家荷兰温血马协会(Royal Dutch Warmblood Association of North America)和新森林小型马育种与畜牧协会(New Forest Pony Breeding and Cattle Society)等[35]。其中,AQHA 规定自2015 年1 月1 日起,所有种马在登记前必须进行HYPP、GBED、PSSM1、HERDA、MH5 种遗传缺陷检测。
由于基因测试受限于专利,专利权人可以采取不同形式的专利实施许可,因此,不同检测机构提供的检测项目有所差异。马主如果想检测多种遗传缺陷,则需将样本送至具有专利许可的检测机构。尽管越来越多的检测机构提供基因检测,但目前尚无管理机构批准测试或对这些检测机构进行质量管控[40]。随着马遗传缺陷检测需求的增加,独家许可的专利将促使基因测试形成功能性垄断,导致检测成本升高[41]。此外,大多数检测机构仅提供单基因遗传缺陷检测,而由多基因引起的复杂缺陷检测机构寥寥无几,但这些复杂遗传缺陷通常具有更显著的负面影响,如骨软骨炎(Osteochondrosis)。
4 我国马遗传缺陷的研究现状
当前,发现致病基因的国际竞争非常激烈,多种遗传缺陷被发现并在多个品种中得到验证。然而,长期以来,我国马遗传缺陷研究匮乏、基础较差,且主要出生缺陷、遗传缺陷等基础数据缺乏,加之马群分布地域广、妊娠时间长及系谱记录不全,以及遗传缺陷具有延迟外显、外显不全或个体间表型存在差异等特征,致使我国发现马致病基因数量为0,马遗传缺陷检测覆盖品种为0,养马业主要遗传缺陷的基础数据匮乏。
由于相关遗传缺陷研究的缺乏,对于此类疾病研究与防治只关注个体本身,并未进行遗传机制探索,致使多数遗传缺陷被忽视。以马麻痹性肌红蛋白尿为例,该病是一种营养代谢病,在我国马群中普遍发生。1989 年,铁岭种畜场的役马、种公马常发生马麻痹性肌红蛋白尿,共计发病48 例[42]。2010 年,马德礼报告大滩地区“赛马会”中赛马麻痹性肌红蛋白尿发病率达13.33%[43]。2020 年,李秀春[44]报告马麻痹性肌红蛋白尿病22 例。患病马通常因食用精料过多,一旦停止使役而未及时减料,几天后再恢复使役时,出现后肢麻痹及血红蛋白尿等症状,与PSSM 典型症状基本符合[26]。然而,对该病因最普遍的认知是肌原性自体中毒说,尚未探讨其中遗传因素[45]。此外,我国马种登记还未全面开展疾病检测,进口检疫的重点是防止传染病和寄生虫病传入,对遗传疾病的危害还没有引起足够重视。
一些遗传突变起源古老,分布于多个品种,如PSSM、HYPP 等,部分突变基因可能在马匹杂交中传入本土品种。历史上,我国曾开展3 次马匹大规模改良工作,与境外马匹交流频繁。在汉代,为改良提高我国蒙古马身体素质,汉武帝大批引入汗血马;唐代引入20 多种不同类型的国内、外马种杂交育成“唐马”;建国后至20 世纪80 年代,我国大批引入国外种马,全面开展马匹大改良工作[46]。近期研究支持了中国家马源自于境外引进种马和本土野马进化的假说[47]。因此,不排除部分遗传缺陷已导入我国本土马种的可能。
5 小 结
随着我国经济发展,现代马产业逐渐兴起,并已成为农业农村经济和体育产业一个新的增长点[3]。遗传缺陷不仅影响马匹正常使用,而且影响诸多社会、经济和生态效益。尽管饲养患病马匹的损失随着饲养成本和疾病类型不同而有所差异,但对依靠繁育马驹获得收益的从业者损失巨大。在良种繁育、濒危品种保护中,一旦出现遗传缺陷基因携带马匹,将造成不可估量的间接损失。此外,随着马群规模的持续减小、近交系数不断上升,遗传缺陷出现的比例可能更高,如果不加以检测和淘汰,其对我国马业健康与可持续发展极为不利。
随着我国马产业的发展,提高对马遗传缺陷基础研究的重视,开展马遗传缺陷检测技术研发已迫在眉睫。尽管遗传缺陷发病率较低,但从长远来看,有效阻断有害突变的扩散是保证马匹健康和福利、提高繁殖力和提升马匹质量的必要手段。现代马业更加关注马匹的个体健康和运动性能,有害基因突变检测将是未来产业不可缺少的环节。此外,随着马基因组学研究的不断深入,如何因地制宜构建我国马群遗传缺陷检测体系,阐明孟德尔遗传病和多种复杂疾病的分子机理,降低遗传缺陷发病率,将是马遗传缺陷基础应用研究和我国马业质量效益竞争力提升的重要方向。

