四川省3 个地方品种牛成纤维细胞系的建立及细胞遗传特性分析
余敏洁,杨钰楚,陈轩宇,李 强,杨舒慧,张 燕,张 明*
(1.四川农业大学动物科技学院,四川成都 611130;2.四川省畜牧总站,四川成都 610044)
一个品种种质资源的优异基因一旦被发掘出来并加以利用,产生的效益是无法估量的[1],而某种基因一旦从地球上消失就很难进行再生创造,将直接影响到国家经济未来的发展潜力[2]。
四川省是南方养牛大省,也是牛遗传资源大省[3]。峨边花牛主要分布于四川省乐山市峨边彝族自治县和凉山彝族自治州的大小凉山地区,产肉多肉质细嫩,具有特殊芳香,抗逆性好,是四川省优良品种,于1987 年编入《四川家畜家禽品种志》,并认定为我国地方品种[4]。平武黄牛主要分布在四川省平武县,主要特征是体格较大,体态匀称,为四川省特色品种[5]。布拖牛即凉山黄牛是经过长期选育而形成的以役用为主的役肉兼用型小型黄牛品种,具有耐粗饲、耐寒、耐劳、性情温顺、抗病力强的特点[6]。这3 个品种是我国畜禽遗传资源保护名录中的地方牛种。细胞遗传资源的保存,是对个体保种方式的补充[7],但直到目前,峨边花牛、平武黄牛和凉山黄牛3 种地方牛种作为细胞遗传资源库保存的细胞系尚未建立,且我国普通牛的染色体组G 带模式图尚未建立。本研究以牛耳缘组织为材料,拟建立3 个品种的皮肤成纤维细胞系,构建遗传资源保存细胞系的核型和G 带模式图,并通过G 带和mtDNA-D-Loop 分析这3 个本地牛的进化关系,完善细胞遗传学基础数据,为地方品种牛遗传资源的保存提供了材料且积累了数据。
1 材料和方法
1.1 实验动物 选取凉山黄牛(公牛7 头,母牛43 头)、峨边花牛(公牛7 头,母牛43 头)和平武黄牛(公牛5 头,母牛40 头),采集5 mm×5 mm 的耳缘组织,采集后用含双抗的PBS 清洗,然后按照组织冷冻保存方法进行保存,实验室解冻后剪碎进行植块培养。
1.2 组织收集与冻存 牛耳缘先用50%碘酒消毒,然后用75%的酒精脱碘,用毛剪迅速取耳尖的皮肤组织块,在75%的酒精中洗30 s,然后在含1 000 IU/mL 青霉素+1 000 μg/mL 链霉素的PBS 溶液中浸洗1 min×3 次,将组织块放入盛有PBS 的EP 管4℃冷藏,3~6 h 内将组织块剪碎,用含FBS 以及10% DMSO(Sigma)的DMEM/Ham’s F12(HyClone)组织冻存液进行冷冻保存。
1.3 原代培养 组织解冻后,用含10%FBS(AusGeneX)的DMEM/Ham’s F12 培养液清洗,然后在DMEM/Ham’s F12 培养液中平衡10 min,进一步将组织剪碎成约1 mm3的小块,玻璃吸管将组织块吸至培养瓶底壁使其黏附在瓶壁上,倒置培养瓶4 h。组织块贴壁后,沿瓶壁加入4 mL DMEM/Ham’s F12 培养液,正置培养瓶,让培养液浸没组织块,在37.5℃、5% CO2、饱和湿度的培养箱中培养[7]。每隔2~3 d 更换2/3 的培养液。
1.4 传代培养和成纤维细胞差速粘附分离 当培养的细胞铺满瓶底80%~90% 时,用预热的PBS 漂洗细胞2次,加入适量0.25%胰蛋白酶(Solorbio)和0.04%的EDTA,37℃下消化1~2 min,加入含血清的培养基终止消化,1 200 r/min 离心8 min 收集细胞,然后分瓶,置于37.5℃和5% CO2、饱和湿度的培养箱中。分别在传代的第1、2、3 代接种细胞后的1 h、40 min 和30 min吸出未贴壁的细胞。传代培养每2~3 d 更换2/3 培养液。
1.5 成纤维细胞鉴定 传代到第3 代次的细胞生长到汇合前用PBS 清洗3 次,然后用4%多聚甲醛固定30 min,再用0.3%Txiton X-100 穿透处理10 min,用3% BSA在室温下封闭30 min,甩去液体,滴加BSA 1:100 稀释的小鼠单克隆波形蛋白抗体(sc-80975),4℃过夜后PBS清洗5 min×3 次,1:50稀释FITC-羊抗小鼠IgG(Boster)二抗孵育1 h,再次清洗后用DAPI 染细胞核,最后滴加抗荧光淬灭封片剂于荧光显微镜(Olympus IX-71,Japan)下观察并拍照,并计算成纤维细胞百分率。
1.6 细胞冷冻与复苏 冻存前用PBS 液洗2 遍,用0.25%胰 蛋白酶和0.04% 的EDTA,37 ℃下消化1~2 min,加入含血清的培养基终止消化,1 200 r/min 离心8 min收集细胞,加入细胞冻存液1 mL。将冻存管放在4℃下预冷1 h,然后放入盛满异丙醇的细胞冻存降温盒(Nalgene)置于-80℃的冰箱中过夜,次日将细胞投入液氮罐中保存。从液氮中取出冻存管,快速投入37℃水浴中,并在水浴中不断快速摇动冻存管,以迅速解冻;待冷冻液彻底解冻后,用新鲜培养液稀释10 倍并将溶解液转移至离心管中,再以1 200 r/min 离心8 min,去除DMSO 以缓解冷冻液毒性,用新鲜的培养液悬浮细胞沉淀,将细胞稀释至所需浓度,继续培养。
1.7 细胞生长曲线测定 取对数生长期细胞,常规方法消化细胞,将终密度为2~3×105个/mL 成纤维细胞接种到24 孔培养板上,常规条件下培养,血球计数板连续8 d 计数,每天计数3 个孔,以培养时间为横坐标、细胞个数为纵坐标,绘制培养细胞的生长曲线。
1.8 培养细胞核型、G 带分析 参照张明[7]和Sun[8]方法优化后进行染色体制备。取培养至汇合度为85% 左右并处于对数生长期的细胞为实验材料,加入3 μL 浓度为0.1 μg/μL 的秋水仙素(Coolaber),培养液终浓度0.1 μg/mL。继续培养3 h,使大部分细胞处于分裂中期。常规方法消化收集细胞,同细胞传代,转入离心管。去上清液,加入预热至37℃的低渗液2 mL 混匀后,继续加至10 mL,37℃温浴40 min。悬液中加入新鲜固定液1 mL,吹打均匀(轻吹防细胞破裂)。将悬液1 000 r/min 离心8 min。去上清,加入新鲜固定液5 mL,吹打均匀,室温静置20 min。重复2 次固定操作,离心后去上清液,视细胞数量加入固定液0.5~1 mL,吹打均匀。取出4℃预冷载玻片,45°倾斜,距玻片1 m高处用吸管迅速滴上2~3 滴细胞悬液,立即用嘴吹散悬液使细胞分散均匀,将载玻片过酒精灯2 次,助染色体分散,展开,空气干燥。用Giemsa 染色液进行染色10 min,用自来水洗掉多余染液,自然干燥后在400倍下镜检(Olympus BX51,Japan)。用Band View 4.0(Applied Spectral Immage Inc.Israel)进行中期相染色体自动排序和分析核型,然后计算相对长度和着丝粒指数[9],并利用Band View Expo 4.0 和Intensity Profile 对G 带的图案进行分析,利用Ideogram 将G 带纹分成3 个深浅(Parition、Dark band 和Light band)级别构建带纹模式图,然后带纹数值按照Parition、Dark band 和Light band 排列,用IBM SPSS v19 聚 类分析中Ward 聚类和Pearson 相关距离构建3 个品种的聚类树[10]。
1.9 细胞细菌和支原体检测 对冻存前后的第2、3 代细胞进行PI 染色,在荧光显微镜观察细菌污染情况;在相差显微镜观察有无蚀斑、空斑等病毒污染以及有无活动的细菌[11]。然后将细菌和病毒用符合NY/T 1900-2010 技术规范的细胞用支原体检测试剂盒(PCR Mycoplasma Detection Kit,ABM,Canada)进行检测。取500 μL 生长至80%汇合细胞培养上清液,2 000 r/min将上清至新离心管中,然后15 000~20 000 r/min 离心10 min,沉淀支原体,小心移除上清450 μL,重悬剩余50 μL 培养基,悬液为支原体检测样本。具体操作参见试剂盒说明书。
1.10 mtDNA.D-loop扩增和测序用天根DNA 抽提试剂盒(Tiangen,DP304)抽提培养成纤维细胞的DNA,具体步骤见天根血液/ 细胞/ 组织基因组DNA提取试剂盒(DP304)说明书。引物为F:5'-CTGCAG TCTCACCATCAACC-3';R:5'-GGGGTGTAGATGCT TGC-3',在25 μL 反应体系(12.5 μL 的2×Taq Master Mix,上下游引物各2.5 μL,1 μg/μL 的DNA 模板5.0 μL,然后加ddH2O)采用表2 引物和条件进行PCR 扩增,扩增产物用1%的琼脂糖凝胶在120 V 电压下电泳20 min,随后切取目的条带进行胶回收后送生工生物工程(上海)股份有限公司进行双向测序,序列用DNAStar 编辑、比对获得每个品种保守序列后用MEGA.7.0 构建NJ 树[12]。
2 结果与分析
2.1 牛成纤维细胞形态学观察与鉴定 冷冻组织块原代培养7 d,成纤维细胞和少量类上皮细胞从组织块周围生长(图1A),培养10 d,大量成纤维细胞从组织块周围长出并迅速增殖。通过差速贴壁连续传代3 次,获得的细胞成典型的成纤维细胞状(图1C),通过成纤维细胞标志物波形蛋白免疫荧光鉴定(图1E、F、G、H),第3 代细胞成纤维细胞的比例达到95.9%±8.3%。
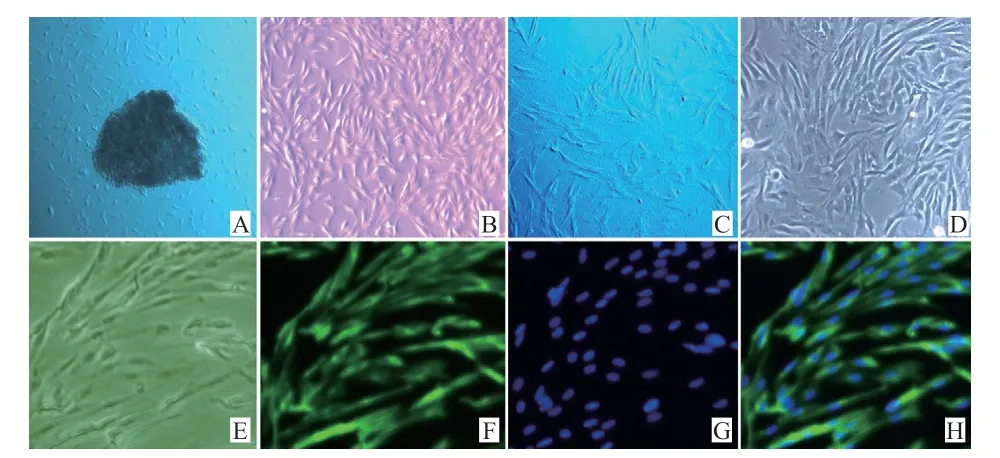
图1 牛成纤维细胞培养与鉴定
2.2 成纤维细胞生长曲线 传代成纤维细胞生长曲线见图2,其呈典型的“S”型,细胞有约3 d 的缓慢生长期,此后进入指数生长期,第7 天细胞数达最大,然后细胞生长进入平台期,细胞生长受接触抑制的影响,此时细胞密度达到最大。培养细胞在6~7 d 进行传代。
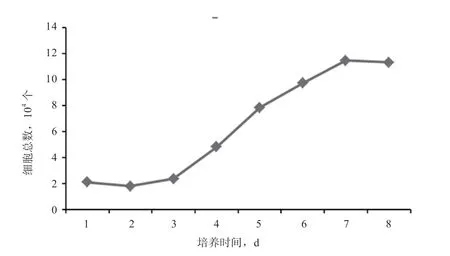
图2 牛成纤维细胞生长曲线
2.3 牛成纤维细胞核型分析 参照Levan[13]等的标准,选择第3 代细胞中期分裂相(图3)的细胞核,进行核型配对,并按照相对长度编号(图4)取100 个分裂相进行统计分析。核型分析结果显示,2n=60,XX/XY。29 对常染色体为长短不同的端着丝粒染色体,X 染色体为亚中着丝粒染色体,Y 染色体为最短的近端部着丝粒染色体(图4),与国内外报道的黄牛染色体核型一致。牛染色体中正常二倍体染色体(2n=60)所占比例为91.76%,培养的细胞为稳定的二倍体细胞系。染色体相对长度见表1,3 个牛种,以及公、母在染色体类型上均完全相同,在染色体相对长度上差异均不显著。X 染色体着丝粒指数见表2。
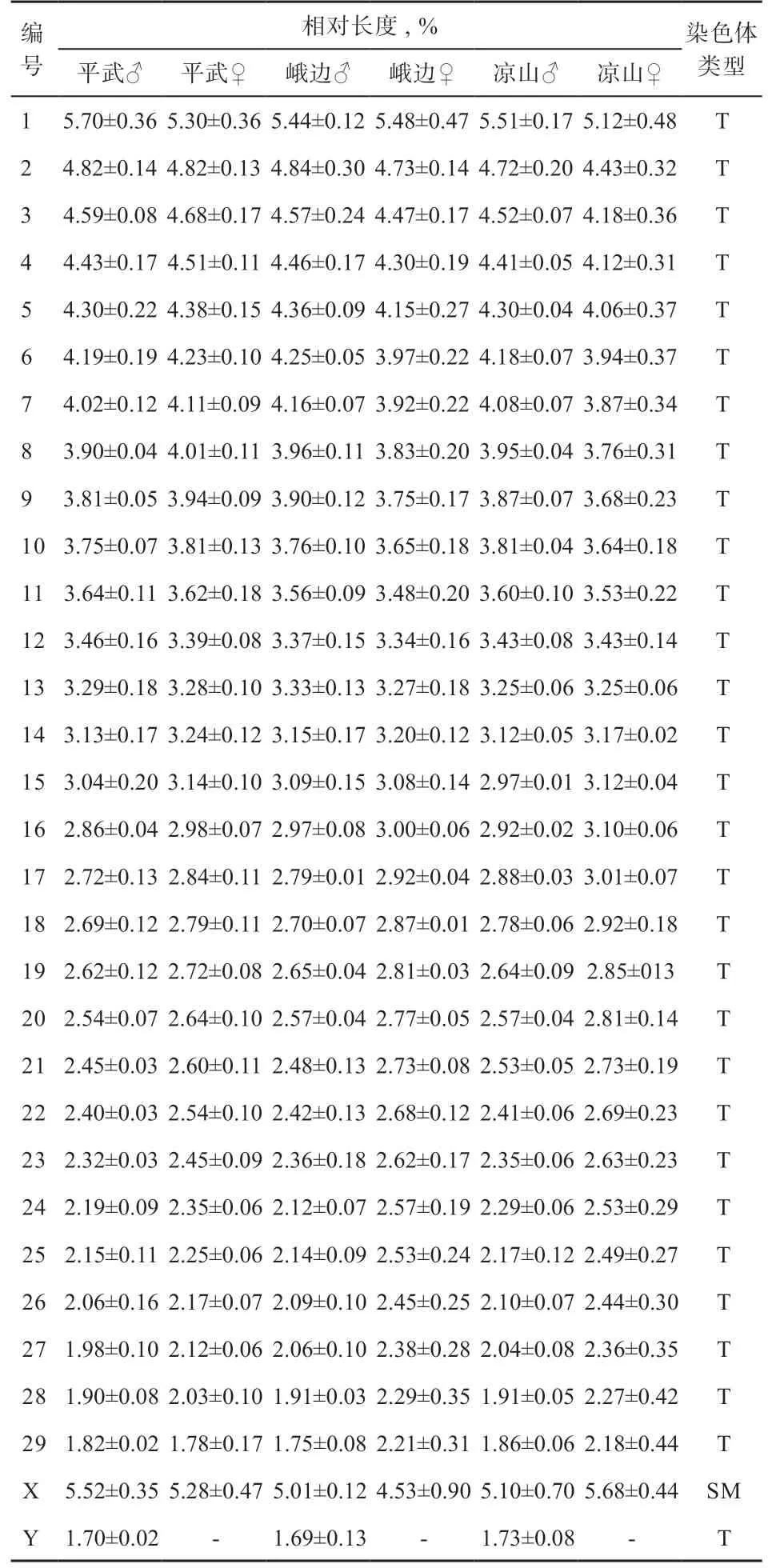
表1 平武、峨边、凉山牛染色体相对长度及形态类型

表2 3 个地方品种牛X 染色体着丝粒比较
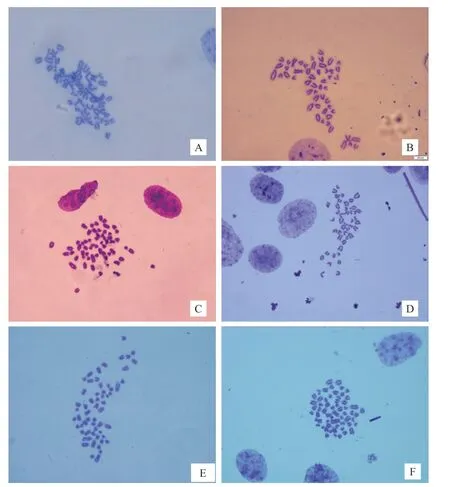
图3 细胞中期分裂相

图4 3 个地方牛种核型
2.4 牛成纤维细胞染色体G 带 将3 种地方品种牛染色体G 带进行分析,建立G 带模式图(图5)。3 个品种带纹数见表3:平武牛的染色体被分离出83 个区域,总共382 条带;峨边花牛被分离出83 个区域,总共374 条带;布拖牛被分离出82 个区域总共373 条带。3个品种的染色体G 带比较发现:3 个品种在5、6、7、10、13、14、22、23、27、28、29 号常染色体,以及性染色染(X 和Y)具有相同的G 带模式和带纹数,在1、2、3、4、8、9、11、15、16、17、18、19、20、21、24、25 和26 常染色体上,3 个品种的带纹数量存在差异。

表3 3 种牛常染色体的G 带对比

图5 3 种地方牛的染色体G 带模式图
利用带纹模式的相关性进行聚类分析(图6A),与3 个品种群体mtDNA-D-loop 保守序列构建的NJ 树(图6B)比较,结果发现:细胞遗传学G 带聚类和mtDNAD-loop 保守序列聚类获得了相同的拓扑结构树。
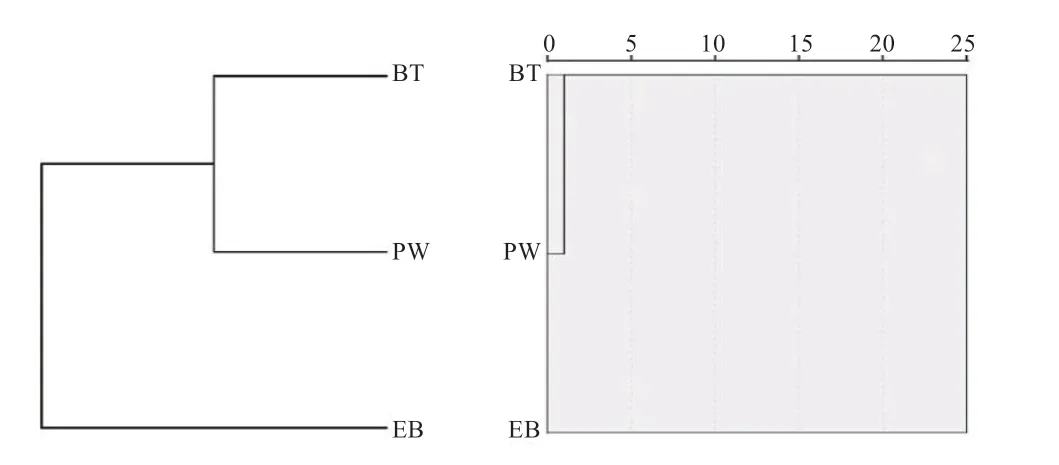
图6 mtDNA-D-loop(A)和G 带(B)聚类分析
2.5 牛耳缘成纤维细胞冻存前及复苏后细胞活率 牛耳缘组织成纤维细胞冻存前细胞活率为92.16%±5.21%,解冻后细胞复苏活率为90.57%±3.43%,细胞在冻存前、后活率无显著差异,复苏细胞生长良好。
2.6 成纤维细胞系微生物污染检测结果 在相差显微镜下观察成纤维细胞无蚀斑、空斑等明显的病毒感染情况;支原体检测结果显示平武黑牛、峨边花牛、凉山黄牛细胞系均无支原体污染(图7A);DAPI 染色后在600 倍镜下观察10 个视野,未发现细小荧光点(图7B),表明无细菌污染。
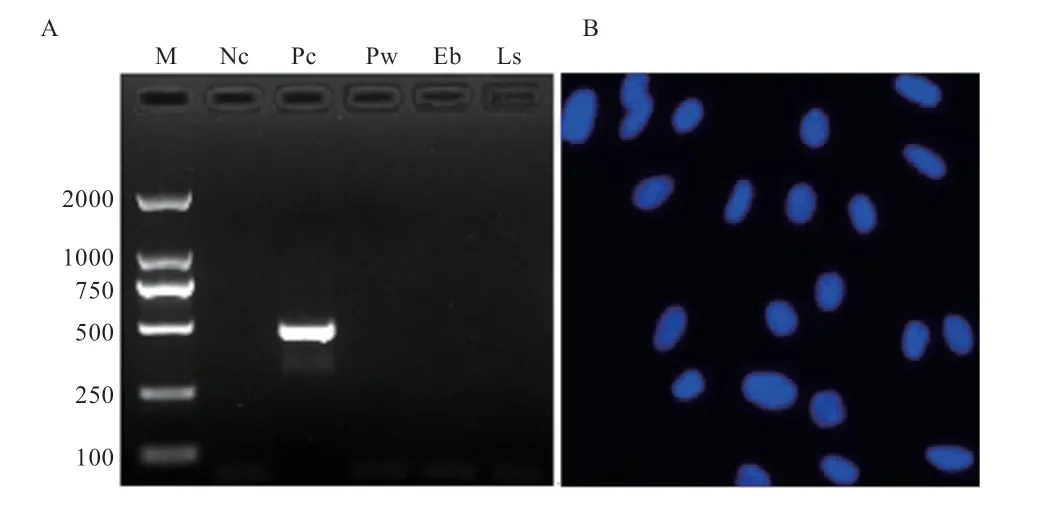
图7 支原体与细菌检测
3 讨 论
皮肤成纤维细胞是皮下组织的主要细胞,在适当的体外培养条件下能迅速增长繁殖[7]。皮肤成纤维细胞培养中,常采用DMEM/Ham'sF12 培养基,并通过差速贴壁进行皮肤成纤维细胞的纯化[14]。本研究通过2~3 次传代过程的差速贴壁,得到了高纯度的成纤维细胞。
野牦牛[15]、鲁西黄牛[16]、南阳牛[17]等染色体数目均为2n=60,四川的3 个地方牛种的染色体数目为2n=60。牛成纤维细胞体外培养过程中,随着传代次数的增加,生长速度变慢,且染色体呈二倍体的细胞比例逐渐降低,多次传代细胞的遗传稳定性降低[18],本研究冷冻保存的细胞主要为2~3 代细胞,二倍体细胞的比例为91.76%,具有较高的遗传稳定性。研究中,利用G 带带纹和mtDNA-D-loop 序列,揭示的凉山黄牛、平武黄牛和峨边花牛的遗传关系相同,研究结果表明分子遗传标记和细胞遗传标记均可用于物种进化关系分析。
冷冻保存技术能够实现细胞遗传资源的长期保存[19]。程金华等[20]等选择了10% DMSO+10% FBS+DMEM/Ham's F12 的细胞冻存液进行保存,解冻后细胞的活率超过90%。细胞保存过程中细胞冷冻过程中为降低低细胞内冰晶的形成,提高解冻后细胞活性、黏附能力及代谢活性,渗透性抗冻剂的选择和浓度非常重要[21]。本实验采用10% DMSO 细胞培养液作为冻存液,冻存细胞在冻存前和复苏后的活率无显著差异。
4 结 论
该实验成功建立了四川凉山、峨边、平武3 个地方牛种的皮肤成纤维细胞系,为后续的遗传学研究提供了宝贵的材料,对地方牛种遗传资源的保护具有重要意义。

