新生儿万古霉素谷浓度与肾毒性的相关性分析*
陈权耀,万 隽,林 闽
(厦门大学附属妇女儿童医院/厦门市妇幼保健院,福建 厦门 361003)
全球每年约有240万新生儿死亡,占5岁以下儿童死亡人数的47%,其中由感染导致的死亡人数约占三分之一[1]。万古霉素是一种糖肽类抗菌药物,可以破坏细菌细胞壁内含有的肽聚糖,从而干扰细菌细胞壁的合成,进而抑制细菌的生长与繁殖,达到杀死细菌的目的。万古霉素在临床治疗中的应用极为广泛,是针对性或经验性治疗新生儿革兰阳性菌,特别是耐甲氧西林的金黄色葡萄球菌,凝固酶阴性的葡萄球菌和耐氨苄西林的肠球菌所致严重感染的首选药物。
万古霉素治疗窗窄,使用不当易造成过低或过高的药物暴露,血药浓度过低易导致疗效欠佳、耐药性增加,血药浓度过高则增加不良反应发生率,如严重的肾毒性和耳毒性。开展万古霉素治疗药物监测(TDM)可显著提高治疗有效率,并降低肾毒性的发生风险[2]。研究表明,万古霉素谷浓度增加与急性肾损伤(AKI)发生风险呈正相关,谷浓度大于20 mg / L时,AKI发生率明显增加[3-4]。美国传染病学会在2011年发布的万古霉素TDM指南中建议将万古霉素血药浓度控制在5~20 mg/L,可在保证疗效的前提下,将AKI风险降至最低[5-6],其中15~20 mg/L适用于复杂性严重感染[7]。
尽管万古霉素已在新生儿中得到广泛使用,并根据TDM结果指导个体化给药,但当前证据多是基于成人感染的数据。新生儿因其特殊的生理情况,如较高的游离分数和迅速成熟的肾功能,药物在体内的个体差异很大,且较成人更复杂[8],至今为止在成人中观察到的药代动力学(PK)和药效动力学(PD)数据可能与新生儿存在差异[9-10]。关于新生儿万古霉素最佳药物暴露靶标的争议仍然存在[11]。
本研究回顾性收集新生儿万古霉TDM数据,通过logistic多因素回归分析,探讨万古霉素谷浓度对新生儿AKI的影响,以期为临床新生儿万古霉素个体化给药提供参考。
1 资料与方法
1.1资料来源 本研究为回顾性研究,获得厦门市妇幼保健院人体研究伦理委员会批准。研究纳入2016年6月1日至2021年1月1日在本院接受万古霉素静脉输注治疗的新生儿。
1.1.1纳入标准 入院时产后日龄小于或等于28 d;患儿使用万古霉素治疗至少2 d;至少有一个可靠的万古霉素血药浓度监测值;患儿人口统计学、血常规、血生化等临床资料完整。
1.1.2排除标准 未测定万古霉素血药浓度或血药浓度值超出检测限;用药期间进行肾脏替代治疗;免疫功能异常;或缺乏重要信息,如剂量信息和样本采集时间。
1.2方法
1.2.1万古霉素给药方案和TDM 万古霉素起始剂量为15 mg/kg,每12小时1次,输注60 min。在第4次给药前或结束输注后30 min内采集血样用于TDM。在获得样品后24 h内,应用酶放大免疫法(EMIT,西门子Viva-E全自动生化分析仪)测定血样谷浓度。此方法的变异系数小于10%,检测下限为2.0 μg/ mL,定量下限为3.0 μg/ mL。
目标谷浓度水平为5~15 mg/L,严重感染为15~20 mg/L,根据TDM结果的个人剂量调整由治疗医生自行决定。
1.2.2数据采集 从电子病历中提取的数据包括产后日龄、胎龄、矫正胎龄、出生体重、用药时体重、万古霉素用药史(剂量、给药时间、给药频次)、血药浓度,合并用药、感染部位、血清肌酐(SCr)等。如果未在用药当天测量体重,则记录最近一次测量的体重。如果无法在48 h内获得SCr,则记录最近一次的SCr。
1.2.3主要结局指标 对所有患儿进行AKI筛查,以确定药物暴露的上限。新生儿AKI定义为48 h内SCr升高26.5 μmol/L,或7 d内SCr升高至1.5倍及以上。

2 结 果
本研究共采集142例患儿的万古霉素谷浓度,所有患儿的人口学和临床资料见表1。15例(10.6%)患儿在治疗过程中发生AKI。AKI组患儿谷浓度均值高于正常组,且谷浓度大于20 mg/L的患者例数更多,差异均有统计学意义(P<0.01)。两组患儿除万古霉素用药持续时间存在差异外(P<0.01),其他变量,如性别、年龄、体重、SCr等比较差异均无统计学意义(P>0.05)。感染部位主要是血流、呼吸道和中枢。入组患儿约50.0%合并使用美罗培南。多因素回归分析显示,万古霉素谷浓度大于20 mg/L的患儿AKI风险增加4.661倍[95%可信区间(95%CI)1.416~15.339,P<0.05)],而体重、用药持续时间及合并用药等不会增加AKI发生风险(表2)。
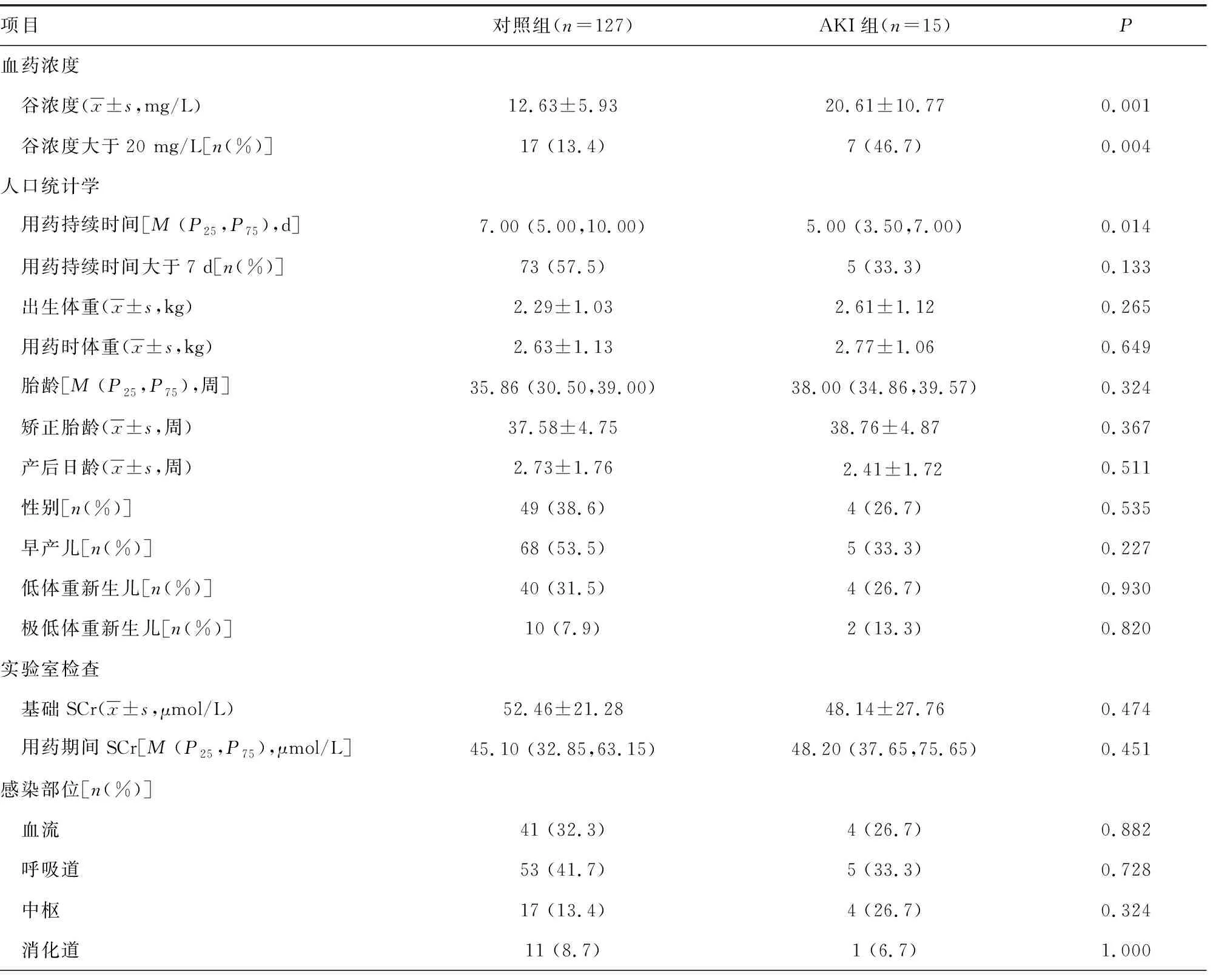
表1 研究患儿人口统计学及临床相关数据

续表1 研究患儿人口统计学及临床相关数据
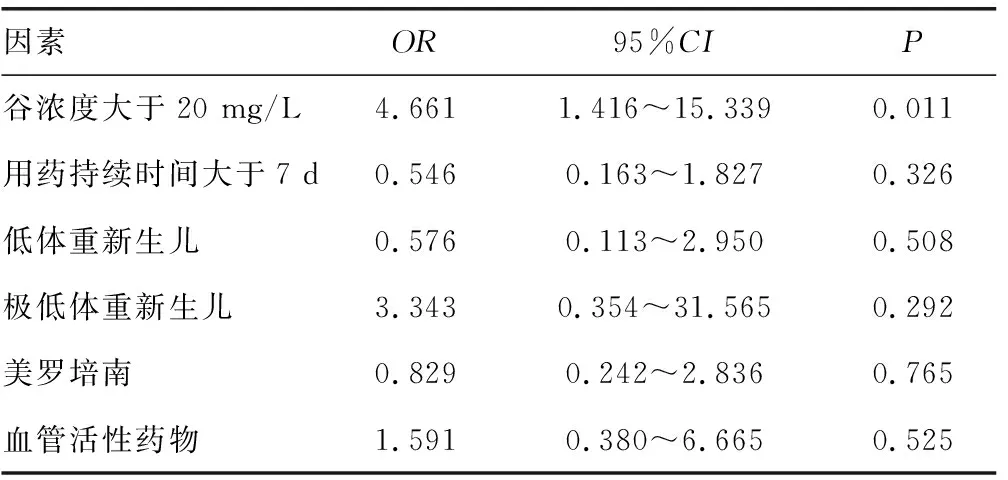
表2 多因素logistic回归分析结果
3 讨 论
万古霉素已在临床使用60余年,尽管随着制药方法的提高和医疗水平的进步,万古霉素毒不良反应发生率有所减少,但对该药相关急性肾损伤风险的探究仍旧没有停止。动物实验表明,近端小管上皮细胞的氧化应激可能是一个诱导因素[12]。近端肾小管是肾脏重吸收功能的主要部位,万古霉素能够改变其上皮细胞的线粒体功能,增加小关细胞的氧耗,影响近端小管的主动转运,从而引起肾损伤[12]。
新生儿万古霉素肾毒性的总体发生率为1%~9%[13],本研究AKI发生率为10.6%。本研究表明,万古霉素谷浓度大于20 mg/L会增加新生儿AKI发生风险(OR=4.661,95%CI1.416~15.339,P<0.05),这与既往在成人和儿童中的研究报道相符,即高谷浓度会导致AKI发生风险增加2倍以上[14]。VAN HAL等[14]报道,在成人和儿童中,治疗的持续时间是肾脏毒性的另一个预测指标。但本研究结果显示,万古霉素治疗持续时间不是新生儿AKI的独立危险因素,可能是由于新生儿的肾功能在最初的几周内逐渐成熟,在一定程度内其肾损害常常是可逆的[14],因此新生儿可能对万古霉素的高暴露相对耐受[15]。本研究所有患儿AKI在住院期间均痊愈,无其他明显不良反应。
现有数据不足以证实万古霉素谷浓度与肾损伤有直接因果关系,一些研究认为谷浓度的升高更提示肾损伤的结果,而不是发生肾损伤的原因。CONSTANCE等[16]报道,万古霉素诱导的肾毒性不是单独存在,可能在与其他肾毒性危险因素共存的情况下发生,如低出生体重、合并用药等。使用血管活性药物被证明是一种保护因素,因为使用血管活性药物可以改变肾血流量和肾小球滤过率,从而增加肾小管的分泌和清除率,增加亲水性药物的消除[17]。本研究结果尚未证实这一点,可能由于样本量有限,导致某些潜在影响因素被忽略,需要进一步的研究来证实这一发现[18]。
鉴于新生儿特殊的生理特征及各种疾病状态中万古霉素清除率的差异,万古霉素剂量和谷浓度相关性较差[19],本研究的初始谷浓度达标率仅为67.6%。SUZUKI等[20]报道,体重、SCr水平、万古霉素日剂量和ICU是高谷浓度的独立预测因素。提示在根据TDM结果调整剂量时应考虑其他相关因素。
此外,本研究还存在一定的局限性:由于没有获得微生物培养数据,本研究未能评估谷浓度与新生儿万古霉素疗效的相关性;本研究为回顾性的单中心研究,结果可能存在一定的病例偏倚和人员偏倚等,需要开展多中心的前瞻性研究来验证相关研究结果。
综上所述,谷浓度大于20 mg/L是新生儿万古霉素肾毒性的独立危险因素,临床使用高目标谷浓度万古霉素治疗方案时应谨慎,将新生儿万古霉素谷浓度控制在20 mg/L以下,可以降低肾毒性的发生风险。

