广西产罗汉松叶指纹图谱研究
陈明伟 韦锦梅 甄丹丹 丘琴 卢显兴 黄秋艳 甄汉深
摘要:【目的】以廣西产罗汉松[Podocarpus macrophyllus (Thunb.) D. Don]的叶为研究对象,建立高效液相色谱(HPLC)指纹图谱,为罗汉松叶的质量评价提供参考依据。【方法】利用HPLC对广西产罗汉松叶进行指纹图谱研究,建立共有模式,并进行方法学考察,使用相似度评价系统对10批不同产地罗汉松叶的共有峰进行确认,对其相似度进行评价;使用SPSS 21.0,以共有峰原始峰面积数据进行聚类分析。【结果】方法学考察结果中,精密度试验主要共有峰的相对保留时间和相对峰面积的相对标准偏差(RSD)均小于3%;稳定性试验相对峰面积的RSD均小于3%,表明样品提取液在24 h内较稳定;重复性试验所有色谱峰的相对保留时间的RSD均小于2%;建立罗汉松叶的指纹图谱,10批不同产地罗汉松叶初步建立其共有模式,标定了22个共有峰,样品指纹图谱与对照指纹图谱相似度都在0.900以上,相似性良好。在10批罗汉松叶药材的指纹图谱中,共有峰的相对保留时间无明显差异。10批罗汉松叶样品可分为3类:S4为第1类;S3、S2和S1为第2类;S5、S6、S7、S8、S9和S10为第3类。【结论】建立的罗汉松叶指纹图谱特征性强,准确可靠,可为罗汉松叶的质量评价提供参考依据。
关键词: 罗汉松叶;质量分析;指纹图谱;高效液相色谱(HPLC)
中图分类号: S791.46;R284.1 文献标志码: A 文章编号:2095-1191(2021)08-2078-09
Fingerprint of Podocarpus macrophyllus(Thunb.) D. Don
leaves from Guangxi
CHEN Ming-wei, WEI Jin-mei, ZHEN Dan-dan, QIU Qin*, LU Xian-xing,
HUANG Qiu-yan, ZHEN Han-shen
(Guangxi University of Chinese Medicine, Nanning 530200, China)
Abstract:【Objective】The high efficiency liquid chromatography(HPLC) fingerprint was adopted to analyze leaves of Podocarpus macrophyllus(Thunb.) D. Don. from Guangxi,so as to provide a reference for the quality evaluation of leaves of P. macrophyllus. 【Method】HPLC was used to study the fingerprint of P. macrophyllus leaves and the common fingerprint mode was established,the method validation was carried. The similarity evaluation system for chromatographic fingerprint of TCM(2012.1 edition) was used to calculate the similar degree of common peaks of 10 batches of P. macrophyllus leaves from different places of origins. The SPSS 21.0 statistical software was used to cluster the original peak area data of the common peaks. 【Result】In precision tests,relative standard deviation(RSD) of relative retention time and relative peak area of the major common peaks were less than 3%. RSD of relative peak area in stability tests are all less than 3%,the results showed that the sample extract was stable within 24 h. RSD of the relative retention time of all chromatographic peaks in the reproducibility tests were less than 2%. The fingerprints of the leaves of P. macrophyllus were established. The common fingerprint pattern of 10 batches of P. macrophyllus leaves were initially established,22 common peaks were confirmed. The similarity between the fingerprint of the sample and the control was more than 0.900,the similarity was good. There was no great difference in the relative retention time of the common peaks among 10 batches of P.macrophyllus leaves. The 10 batches of P. macrophyllus leaves could be divided into 3 categories. S4 into the first category,S3,S2 and S1 were grouped into the second category,S5,S6,S7,S8,S9 and S10 were grouped into the third category.【Conclusion】The fingerprint established is characterized,accuracy and reliability,which can provide basis for the quality evaluation of the P. macrophyllus leaves.
Key words: Podocarpus macrophyllus(Thunb.) D. Don leaves; quality analysis; fingerprint; high efficiency liquid chromatography(HPLC)
Foundation item: Guangxi First-class Discipline Construction Project(2018XK052); Zhuang and Yao Pharmaceutical Collaborative Innovation Center Project(Guijiaokeyan〔2013〕20); Guangxi Zhuang and Yao Medicine Key Laboratory Project(Guikejizi〔2014〕32); Guangxi Key Discipline Zhuang Pharmacy Project(Guijiaokeyan〔2013〕16)
0 引言
【研究意义】罗汉松[Podocarpus macrophyllus(Thunb.) D. Don]又名羅汉柏、罗汉杉、金钱松、长青罗汉杉、土杉、仙柏等,为罗汉松科罗汉松属植物,分布在热带、亚热带和南温带地区,在广西地区常见。罗汉松既可作观赏植物,又可作药用植物,其全株均可药用(吴鲁东等,2012;张东峰,2020),其中穗花杉双黄酮为罗汉松的主要活性成分(黄振青等,2014;杨雨等,2014)。穗花杉双黄酮是近年来发现的具有多种生物活性的化合物,具有抗炎(黄振青等,2014)、抗微生物(Hwang et al.,2012;Wilsky et al.,2012)、抗辐射(Lee et al.,2012)、抗肿瘤(Bochis et al.,2015;Pan et al.,2017;Lee et al.,2018;王曜晖等,2019)、护肝(黄振青等,2014)、神经保护(Ishola et al.,2012,2013)及降血糖(郑晓珂等,2013)等作用。随着植物类药物活性单体研究的不断深入,穗花杉双黄酮的作用越来越引起各国学者的广泛关注,罗汉松的药用价值也显示出更广阔的前景。因此,以穗花杉双黄酮为主成分,建立广西产罗汉松叶高效液相色谱(HPLC)指纹图谱研究的方法,可为罗汉松叶的鉴别及质量控制提供科学依据。【前人研究进展】目前,有关罗汉松的研究多集中在药理作用和化学成分提取方面。陈永钧等(2013)研究表明,罗汉松的乙醇提取物具有体外抗氧化活性。周燕等(2014)研究发现,罗汉松种子提取物对人胃癌细胞MGC-803有明显的体外抑制作用,其抑制作用与药物的质量浓度和作用时间呈正相关;之后通过药物体外试验,进一步明确了罗汉松种子对人胃癌细胞MGC-803发挥抑制作用的生物活性部位为其95%乙醇提取部位(周燕,2015)。隗磊等(2015)研究发现,不同浓度的罗汉松实醇提物具有降血脂、保肝及抗氧化作用。王彬(2016)从罗汉松枝叶的95%乙醇提取物中分离鉴定出23个化合物,并发现二萜类化合物inumakilactone A对肿瘤细胞Hela和OS-RC-2具有较强的增殖抑制活性。赵凯丽和黄增琼(2018)采用气相色谱—质谱法(GC-MS)对罗汉松种子挥发油的化学成分进行分析鉴定,结果发现罗汉松种子挥发油中含有大量的川芎嗪(四甲基吡嗪),相对百分含量高达97.27%,提示川芎嗪是罗汉松种子治疗心胃痛的物质基础。袁堂丰等(2019)采用响应面法优化得到罗汉松总二萜的最佳提取工艺参数为:甲醇浓度80.00%、提取温度63.0 ℃、液料比26∶1(mL/g),此工艺下罗汉松总二萜得率为1.13%;提取到的罗汉松总二萜对DPPH自由基、羟自由基和超氧阴离子具有不同的清除能力,最大清除率分别为81.71%、66.27%和38.60%。【本研究切入点】目前有关罗汉松的质量控制方法较少,吴鲁东等(2012)对其进行了性状、显微和薄层方面的鉴别,尚未见指纹图谱的研究报道。中药指纹图谱是一种综合的、可量化的鉴定手段,基本反映中药材或中成药的化学成分和含量分布情况,是评价药材质量较全面的方法,目前已广泛应用于多种中药的质量控制中(丘琴等,2017;黄红泓等,2019;陈林杰等,2020;崔誉文等,2020;童培珍等,2020)。液相色谱法具有简便准确、灵敏度高、重复性好、检测器种类多等特点,是构建指纹图谱的重要方法之一。本研究以广西不同产地的10批罗汉松叶为研究对象,以穗花杉双黄酮为参照峰,建立罗汉松叶HPLC指纹图谱,对罗汉松叶进行质量分析,可科学评价罗汉松叶的质量。【拟解决的关键问题】建立罗汉松叶HPLC指纹图谱共有模式,使用相似度评价系统对10批广西不同产地罗汉松叶的共有峰进行确认,并对其相似度进行评价;使用SPSS 21.0,以共有峰原始峰面积数据进行聚类分析,以期为从整体上控制罗汉松叶的质量提供参考依据。
1 材料与方法
1. 1 试验材料
10批罗汉松叶药材采自广西不同产地,经马利飞副主任中药师(广西一心药业医药有限责任公司)鉴定为罗汉松科罗汉松属罗汉松(P. macrophyllus)的叶,药材信息见表1。95%乙醇、磷酸(20120315,AR)和冰醋酸(20160108,AR)购自国药集团化学试剂有限公司,甲醇(色谱醇)购自Fisher公司,穗花杉双黄酮(批号:170109)购自上海融禾医药科技发展有限公司。主要仪器设备:Agilent-1260高效液相色谱仪(美国安捷伦公司);Millipore Simplicity-185超纯水仪(美国密里博公司);KQ5200B型超声波清洗器(昆山市超声仪器有限公司);BP211D分析天平[德国赛多利斯科学仪器(北京)有限公司];HWS26电热恒温水浴锅(上海一恒科学仪器有限公司)。
1. 2 供试品溶液制备
精密称取罗汉松叶粉末(通过3号筛)约1 g,加95%乙醇溶液30 mL置于锥形瓶中,摇匀,称定,80 ℃回流提取2 h,放冷,补足减失的重量,过滤,滤液蒸干,残渣加甲醇溶解,定容至2 mL容量瓶中,用0.22 μm微孔滤膜过滤,制备得供试品溶液。
1. 3 对照品溶液制备
取穗花杉双黄酮对照品,精密称定10.0 mg,置于5 mL容量瓶中,加甲醇溶解定容,得穗花杉双黄酮对照品溶液,浓度为2 mg/mL;精密量取穗花杉双黄酮对照品溶液2 mL至5 mL容量瓶中,加甲醇溶解并定容至刻度,得浓度为0.8 mg/mL的穗花杉双黄酮对照品溶液;再精密量取上述穗花杉双黄酮对照品溶液0.127 mL,置于2 mL容量瓶中,加甲醇稀释并定容,得浓度为0.0508 mg/mL的穗花杉双黄酮对照品溶液。
1. 4 色谱条件
色谱柱:Waters Symmetry? C18色谱柱(5 μm,250 mm×4.6 mm);流动相:甲醇—0.1%磷酸;检测波长:320 nm;流速:1 mL/min;柱温:30 ℃;进样量:10 μL;洗脱程序见表2。
1. 5 系統适用性试验
分别精密吸取供试品溶液和对照品溶液各10 μL,按1.4的色谱条件进样测定分析,检测HPLC系统对有效成分的分离效果。
1. 6 方法学考察
通过预试验可知,罗汉松叶中含芹菜素和穗花杉双黄酮,其中穗花杉双黄酮含量较高,峰面积较大,分离度较好,峰型较高,因此选择穗花杉双黄酮作为参照峰。
1. 6. 1 精密度试验 取罗汉松叶样品(那坡县)约1 g,按1.2的方法制备供试品溶液,再按1.4的色谱条件连续进样6次测定,计算HPLC图谱中各个共有峰的相对保留时间及相对峰面积的相对标准偏差(RSD),以检测仪器的精密度。
1. 6. 2 稳定性试验 精密称取同一份罗汉松叶样品1 g,按1.2的方法制备供试品溶液,分别在不同的时间点(0、2、4、8、12和24 h)按1.4的色谱条件进样分析,分别计算HPLC图谱中各共有峰的相对保留时间和相对峰面积的RSD,以测定该样品的稳定性。
1. 6. 3 重复性试验 精密称取同一批罗汉松叶样品6份,每份1 g,按1.2的方法制备供试品溶液,按1.4的色谱条件进样分析,分别计算HPLC图谱中各共有峰的相对保留时间和相对峰面积的RSD,测定分析方法重复性。
1. 7 样品指纹图谱测定
精密称取10批广西不同产地的罗汉松叶粉末各1 g,按照1.2的方法制备供试品溶液,再根据1.4的色谱条件进样分析,记录10批不同产地罗汉松叶HPLC图。将不同产地的10批罗汉松叶HPLC图谱数据录入中药色谱指纹图谱相似度评价系统(2012.130723版),设置参比峰和时间窗后进行自动化匹配及相似度计算,得到各产地样品测定的指纹图谱。
1. 8 特征图谱构建
通过中药色谱指纹图谱相似度评价系统(2012.130723版)确定各样品的共有特征峰,构建各样品的罗汉松叶高效液相特征图谱。
1. 9 相似度评价
对10批不同产地罗汉松叶的指纹图谱,使用多点校正法,以对照图谱为参照,以中药色谱指纹图谱相似度评价系统(2012.130723版)进行相似度评价,从而对10批不同产地罗汉松叶的指纹图谱进行相似度计算。
1. 10 聚类分析
以10批罗汉松叶药材的共有峰峰面积为原始数据,应用组间连接的聚类方法,利用SPSS 21.0进行聚类分析。
2 结果与分析
2. 1 系统适用性试验结果
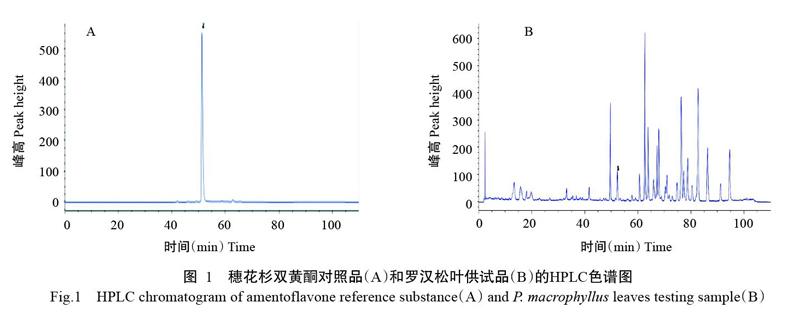
罗汉松叶供试品的色谱图显示峰形良好,基线平稳,相邻峰之间分离良好,没有溶剂峰及杂质峰的出现;穗花杉双黄酮对照品峰形良好,出峰保留时间在52 min左右(图1)。
2. 2 方法学考察结果
2. 2. 1 精密度试验结果 对罗汉松叶供试品溶液检测分析后发现,符合HPLC指纹图谱的分析要求,其主要共有峰的相对保留时间和相对峰面积的RSD均小于3%,表明仪器的精密度良好。
2. 2. 2 稳定性试验结果 对罗汉松叶供试品溶液检测分析后发现,其主要共有峰的相对峰面积RSD均小于3%,相对保留时间的RSD均小于2%,表明样品提取液在24 h内较稳定,可用于检测。
2. 2. 3 重复性试验结果 对罗汉松叶供试品溶液检测分析后发现,以穗花杉双黄酮(6号色谱峰)为参照峰,所有色谱峰相对保留时间的RSD均小于2%,相对峰面积的RSD均小于3%,均符合指纹图谱要求,表明HPLC法建立广西产罗汉松叶指纹图谱重复性良好。
2. 3 罗汉松叶指纹图谱测定结果
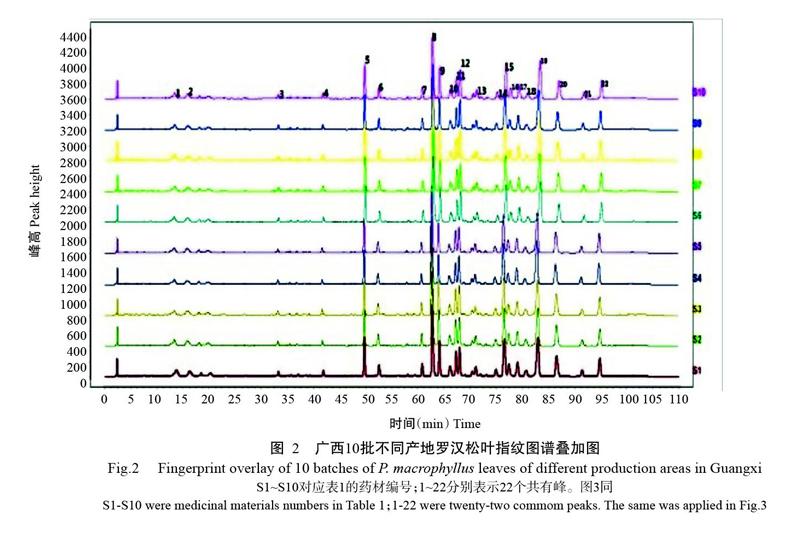
以北海市样品(S10)的指纹图谱作为参照指纹图谱,10批罗汉松叶样品的色谱图如图2所示,共有26个共有特征峰被确定,其中22个共有峰具有特征明显,稳定性好,吸收峰强的特点,选其为共有峰;穗花杉双黄酮(6号色谱峰)在各样品色谱图中的稳定性较好,可作为参照峰。通过指纹图谱可比较出10个产地中罗汉松叶含有的共有峰,以确定不同产地罗汉松叶中可能含有的相同物质。
2. 4 特征图谱的建立
利用相似度评价系统构建罗汉松叶提取物的特征图谱(图3),22个共有峰的峰面积及保留时间见表3。以穗花杉双黄酮(6号色谱峰)作为参照峰,其保留时间和峰面积设为1.0000,计算其他各共有峰的相对保留时间(表4)和相对峰面积(表5),并计算10个产地罗汉松叶提取物非共有峰面积与总峰面积百分比(表6)。由表4和表5可知,在10批罗汉松叶药材的指纹图谱中,各共有峰相对保留时间的RSD为0.05%~0.96%,表明各产地间样品共有峰出峰时间较稳定;而相对峰面积的RSD为3.17%~48.13%,表明广西不同产地罗汉松叶的成分含量有较大差异。
黄红泓,丘琴,甄丹丹,甄汉深,范秀春,庾丽峰. 2019. 不同产地龙利叶HPLC指纹图谱研究[J]. 广西师范大学学报(自然科学版),37(3):142-147. [Huang H H,Qiu Q,Zhen D D,Zhen H S,Fan X C,Yu L F. 2019. HPLC fingerprint of leaf of Sauropus rostratus Miq. from different places[J]. Journal of Guangxi Normal University(Natural Science Edition),37(3):142-147.] doi:10.16088/j.issn. 1001-6600.2019.03.016.
黄振青,韦燕飞,刘雪梅,段雪琳,赵铁建. 2014. 穗花杉双黄酮对急性肝损伤大鼠炎症相关因子的影响[J]. 中国实验方剂学杂志,20(11):147-150. [Huang Z Q,Wei Y F,Liu X M,Duan X L,Zhao T J. 2014. Effects of amentoflavone on inflammatory factors in rats with acute liver injury[J]. Chinese Journal of Experimental Traditional Medical Formulae,20(11):147-150.] doi:10.13422/j.cnki. syfjx.2014110147.
丘琴,陈明伟,甄汉深,蒋兰兰,范秀春. 2017. 壮药扁担藤HPLC指纹图谱研究[J]. 广西师范大学学报(自然科学版),35(2):73-79. [Qiu Q,Chen M W,Zhen H S,Jiang L L,Fan X C. 2017. HPLC fingerprint of stem of Tetrastigma planicaule(Hook.f.) Gagnep[J]. Journal of Guangxi normal university(Natural Science Edition),35(2):73-79.] doi:10.16088/j.issn.1001-6600.2017.02.011.
童培珍,李振雨,曹斯琼,何嘉莹,孙冬梅,陈向东,李国卫. 2020. 白茅根标准汤剂超高效液相色谱指纹图谱研究[J]. 中国中医药信息杂志,27(12):70-75. [Tong P Z,Li Z Y,Cao S Q,He J Y,Sun D M,Chen X D,Li G W. 2020. Study on UPLC fingerprints of imperatae rhizoma standard decoction[J]. Chinese Journal of Information on Traditional Chinese Medicine,27(12):70-75.] doi:10. 19879/j.cnki.1005-5304.202001225.
王彬. 2016. 罗汉松和金果榄的化学成分及生物活性研究[D]. 济南:山东大学. [Wang B. 2016. Isolation and bioactivity of natural products from Podocarpus macrophyllus and Tinospora capillipes[D]. Jinan:Shandong University.]
王曜晖,赵智权,杜运松,袁冰舒,王刚. 2019. 穗花杉双黄酮对3T3-L1细胞增殖、凋亡及生物钟的影响[J]. 中国现代医学杂志,29(16):1-9. [Wang Y H,Zhao Z Q,Du Y S,Yuan B S,Wang G. 2019. Effects of amentoflavone on proliferation,apoptosisandcircadian clock of 3T3-L1 cells[J]. China Journal of Modern Medicine,29(16):1-9.] doi:10.3969/j.issn.1005-8982.2019.16.001.
隗磊,周艷,谢云. 2015. 不同浓度罗汉松实醇提物调血脂及抗氧化的作用研究[J]. 湖北中医药大学学报,17(1):57-59. [Wei L,Zhou Y,Xie Y. 2015. Effects of ethanol extract from podocarp fruit on hypolipidemic and antioxidation action[J]. Journal of Hubei University of Chinese Medicine,17(1):57-59.] doi:10.3969/j.issn.1008-987x. 2015.01.18.
吴鲁东,梁小洪,李书渊. 2012. 罗汉松的生药学研究[J]. 临床医学工程,19(8):1350-1352. [Wu L D, Liang X H,Li S Y. 2012. Pharmacognostic study on Podocarpus macrophyllus[J]. Clinical Medical & Engineering,19(8):1350-1352.] doi:10.3969/j.issn.1674-4659.2012.08.1350.
杨雨,徐文娟,彭康,孙学刚. 2014. 穗花杉双黄酮通过影响caspase-3和β-catenin表达诱导结肠癌细胞SW480凋亡[J]. 南方医科大学学报,34(7):1035-1038. [Yang Y,Xu W J,Peng K,Sun X G. 2014. Amentoflavone induces apoptosis in SW480 human colorectal cancer cells via regulating β-catenin and caspase-3 expressions[J]. Journal of Southern Medical University,34(7):1035-1038.] doi:10.3969/j.issn.1673-4254.2014.07.24.
袁堂丰,瞿利民,郭婕. 2019. 响应面法优化罗汉松总二萜提取及抗氧化研究[J]. 中南林业科技大学学报,39(6):114-120. [Yuan T F,Qu L M,Guo J. 2019. Response surface methodology for optimization of extracting total diterpenoids from Podocarpus macrophyllus and their antioxidant activity[J]. Journal of Central South University of Forestry & Technology,39(6):114-120.] doi:10.14067/ j.cnki.1673-923x.2019.06.017.
张东峰. 2020. 响应面优化罗汉松总黄酮提取工艺及其抗氧化性研究[J]. 粮食与油脂,33(7):63-67. [Zhang D F. 2020. Study on optimization of extraction technology of flavonoids from Podocarpus macrophyllus by response surface methodology and its antioxidant activity[J]. Ce-reals & Oils,33(7):63-67.]
赵凯丽,黄增琼. 2018. 罗汉松种子挥发油及石油醚提取物GC-MS分析[J]. 西北药学杂志,33(2):153-157. [Zhao K L,Huang Z Q. 2018. Analysis of essential oil and petroleum ether extract compositions of the seed of Podocarpus macrophyllus by GC-MS[J]. Northwest Pharmaceutical Journal,33(2):153-157.] doi:10.3969/j.issn.1004- 2407.2018.02.003.
鄭晓珂,苏成福,张莉,高爱社,克迎迎,袁培培,王小兰,张鑫,冯卫生. 2013. 卷柏中穗花杉双黄酮降血糖作用[J]. 中国实验方剂学杂志,19(17):198-202. [Zheng X K,Su C F,Zhang L,Gao A S,Ke Y Y,Yuan P P,Wang X L,Zhang X,Feng W S. 2013. Anti-diabetic activity of amentoflavone in Selaginella tamariscina in diabetic mice[J]. Chinese Journal of Experimental Traditional Medical Formulae, 19(17):198-202.] doi:10.11653/syfj2013170198.
郑玉蓉,吴慧仪,潘素静,陶曙红,龙晓英. 2017. 罗汉松叶中总黄酮的提取与纯化富集工艺研究[J]. 广东药科大学学报,33(1):23-27. [Zheng Y R,Wu H Y,Pan S J,Tao S H,Long X Y. 2017. Extraction and purification of total flavonoids from the leaves of Podocarpus macrophyllus by D101 macroporous resin[J]. Journal of Guangdong Pharmaceutical University,33(1):23-27.] doi:10.16809/j.cnki.2096-3653.2016101403.
周燕,隗磊,谭志明,余尚工,方念伯,刘合刚. 2014. 罗汉松种子提取物对人胃癌细胞的体外抑制作用[J]. 中国药业,23(13):13-15. [Zhou Y,Wei L,Tan Z M,Yu S G,Fang N B,Liu H G. 2014. Inhibition effect in vitro of Podocarpus seed extract on human gastric cancer cells[J]. China Pharmaceutical,23(13):13-15.]
周燕. 2015. 罗汉松实醇提物对人胃癌细胞的抑制作用研究[D]. 武汉:湖北中医药大学. [Zhou Y. 2015. The inhibitory effects of Podocarpus seeds and its tray extract on human castric cancer cells[D]. Wuhan:Hubei University of Traditional Chinese Medicine.]
Bochis O V,Irimie A,Pichler M,Berindan-Neagoe I. 2015. The role of Skp2 and its substrate CDKN1B(p27) in colorectal cancer[J]. Journal of Gastrointestinal and Liver Diseases,24(2):225-234. doi:10.15403/jgld.2014.1121. 242.skp2.
Hwang I S,Lee J,Jin H G,Woo E R,Lee D G. 2012. Amentoflavone stimulates mitochondrial dysfunction and induces apoptotic cell death in Candida albicans[J]. Mycopathologia,173(4):207-218. doi:10.1007/s11046-011-9503-x.
Ishola I O,Chatterjee M,Tota S,Tadigopulla N,Adeyemi O O,Palit G,Shukla R. 2012. Antidepressant and anxiolytic effects of amentoflavone isolated from Cnestisferruginea in mice[J]. Pharmacology Biochemistry and Behavior,103(2):322-331. doi:10.1016/j.pbb.2012.08.017.
Ishola I O,Chaturvedi J P,Rai S,Rajasekar N,Adeyemi R O O,Shukla R,Narender S T. 2013. Evaluation of amentoflavone isolated from Cnestis ferruginea Vahl ex DC(Connaraceae)on production of inflammatory mediators in LPS stimulated rat astrocytoma cell line(C6) and THP-1 cells[J].Journal of Ethnopharmacology,146(2):440-448. doi:10.1016/j.jep.2012.12.015.
Lee C W,Na Y,Park N H,Kim H S,Ahn S M,Kim J W,Kim H K,Jang Y P. 2012. Amentoflavone inhibits UVB-inducedmatrix metalloproteinase-1 expression through the modulation of AP-1 components in normal human fibroblasts[J]. Applied Biochemistry & Biotechnology,166(5):1137-1147. doi:10.1007/s12010-011-9500-z.
Lee K C,Tsai J J,Tseng C W,Kuo Y C,Huang Y C,Lin S S,Hsu F T. 2018. Amentoflavone inhibits ERK-modula-ted tumor progression in hepatocellular carcinoma in vitro[J]. In Vivo,32(3):549-554. doi:10.21873/invivo.112 274.
Pan P J,Tsai J J,Liu Y C. 2017. Amentoflavone inhibits metastatic potential through suppression of ERK/NF-κB activation in osteosarcoma U2OS cells[J]. Anticancer Research,37(9):4911-4918. doi:10.21873/anticanres.11900.
Wilsky S,Sobotta K,Wiesene N,Pilas J,Althof N,Munder T,Wutzler P,Henke A. 2012. Inhibition of fatty acid synthase by amentoflavone reduces coxsackievirus B3 replication[J]. Archives of Virology,157(2):259-269. doi:10. 1007/s00705-011-1164-z.
(責任编辑 罗 丽)
收稿日期:2020-04-28
基金项目:广西一流学科建设项目(2018XK052);壮瑶药协同创新中心项目(桂教科研〔2013〕20号);广西壮瑶药重点实验室项目(桂科基字〔2014〕32号);广西重点学科壮药学项目(桂教科研〔2013〕16号)
通讯作者:丘琴(1983-),https://orcid.org/0000-0002-3908-9685,博士,教授,主要从事药学和中药学的教学及科研工作,E-mail:12031983@163.com
第一作者:陈明伟(1977-),https://orcid.org/0000-0001-6952-6930,副教授,主要从事中药活性成分及质量控制研究工作,E-mail:262584687@ qq.com

