血清Adropin、PTX-3、hs-CRP、TGF-β1水平在乳腺癌放化疗相关心脏毒性早期预测中的应用价值
郑国红,杨海芳,曹钢,王晓红,肖磊
(唐山市人民医院肿瘤内科,河北 唐山 063000)
乳腺癌是具有较高发病率和致死率的妇科恶性肿瘤,通常由乳腺上皮细胞癌变所致,对患者的生命安全造成了严重影响[1]。放化疗是临床治疗乳腺癌的重要手段,能有效控制病情进展,改善预后。但患者接受放疗时,心脏进入放射野,产生大量的氧自由基易引起心肌细胞损伤[2]。恶性肿瘤患者在化疗药物的作用下心脏脂肪酸分泌出现异常,大量化疗药物积累可能引起心脏毒性,严重者还可能出现心力衰竭[3]。因此,早期及时诊断放化疗相关心脏毒性具有重要的临床价值。现阶段临床常通过心脏磁共振及超声心动图等方式诊断放化疗相关心脏毒性,但费用较昂贵,且需要较高的检测技术。因此,寻找早期诊断及评估乳腺癌放化疗相关心脏毒性的血清标志物对降低相关心脏毒性发生风险、改善预后具有特殊的意义。Adropin是一种分泌性蛋白,与心脏疾病的发生密切相关,在冠心病等多种心脏疾病患者血清中异常表达[4]。正五聚蛋白-3(pentraxin-3,PTX-3)与超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)均属于C反应蛋白家族,在心血管系统局部炎症反应有着重要作用,与心脏疾病的发生及发展相关[5-6]。转化生长因子-β1(transforming growth factor-β1,TGF-β1)异常表达可能引起心力衰竭、房颤等心脏疾病[7]。本研究拟探讨血清Adropin、PTX-3、hs-CRP、TGF-β1水平在乳腺癌放化疗相关心脏毒性早期预测中的应用价值。
1 资料与方法
1.1 一般资料
选取2018年5月至2020年4月唐山市人民医院诊治的120例左侧乳腺癌患者作为研究组。纳入标准:(1)符合《中国抗癌协会乳腺癌诊治指南与规范》[8]中相关标准,并经病理学检查确诊均为浸润性导管癌;(2)均为女性;(3)年龄不低于18岁;(4)首次发病,无放化疗史;(5)患者签署知情同意书;(6)放化疗前无心脏疾病。排除标准:(1)存在放化疗禁忌证者;(2)合并感染性疾病、自身免疫性疾病、其他类型恶性肿瘤者;(3)精神、认知功能严重损伤者;(4)先天性心脏病者;(5)预计生存期不足6个月者;(6)临床资料不完整者。另取同期40例乳腺良性疾病作为对照组。两组一般资料比较,差异均无统计学意义(P>0.05)。见表1。
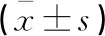
表1 两组一般资料比较
1.2 方法
1.2.1 临床资料 收集研究组患者的临床资料,包括年龄、卡氏评分、身体质量指数(body mass index,BMI)、饮酒史、吸烟史、高血脂、高血压、糖尿病、肌酐、尿素氮、谷丙转氨酶、谷草转氨酶、肌酸激酶(creatine kinase,CK)、肌酸激酶同工酶(creatine kinase isoenzymes,CK-MB)及肿瘤分期等资料。
1.2.2 治疗方法 所有患者均接受行环磷酰胺、表柔比星、氟尿嘧啶及多西他赛化疗。环磷酰胺(江苏盛迪医药有限公司)500 mg/m2、表柔比星[辉瑞制药(无锡)有限公司]100 mg/m2、氟尿嘧啶(上海旭东海普药业有限公司)500 mg/m2均为第1 天静脉滴注,21 d为1个周期,连续化疗3个周期,随后采用多西他赛(上海中西三维药业有限公司)100 mg/m2,第1 天静脉滴注,21 d为1个周期,连续化疗3个周期。在多西他赛化疗期间同步进行化疗,胸壁野采用6MVX线照射,调强放射治疗:50 Gy/25 f,5周完成,锁骨上下区采用6 MVX线照射,50 Gy/25 f,5周完成。
1.2.3 血清Adropin、PTX-3、hs-CRP、TGF-β1检测 在首次化疗当日清晨采集研究组患者空腹静脉血约3 mL,经离心后取上清液,贮存于不含抗凝剂的试管,于-80 ℃冰箱保存,并于当天完成检验。采用酶联免疫吸附法,检测两组血清Adropin、PTX-3、hs-CRP、TGF-β1水平,Adropin及PTX-3试剂盒均购自上海西唐生物科技有限公司,hs-CRP及TGF-β1试剂盒均购自上海邦景实业有限公司。酶联免疫吸附法:取出酶标板,在空白微孔中依次加入100 μL标准品,分别标记样品编号,加入100 μL样品于空白微孔中,在样品孔及标准品中加入酶标记溶液50 μL,孵育1 h,洗板机清洗5次,每次静置20 s,每孔加入底物各90μL,避光孵育反应15 min,每孔加入终止液50 μL,终止反应,3 min内测量450 nm波长下各孔内吸光度,并计算出实际浓度。
1.3 试验分组
根据是否发生心血管事件将研究组患者分为心脏毒性事件组(n=24)和非心脏毒性事件组(n=96)。分别于化疗前、每次化疗周期结束后第2周使用飞利浦公司生产的IU Elite型超声仪对患者进行检查,观察患者心脏有无异常变化,并记录左室射血分数(left ventricular ejection fractions,LVEF)。心脏毒性判定参考中国临床肿瘤学会制定的标准[9]:(1)相比于化疗前,LVEF降低超过10%且存在充血性心衰症状或无症状的LVEF降低超过15%;(2)心肌酶CK、CK-MB异常升高;(3)心电图异常指标:窦性心动过缓或过速、T波低平、R波低电压、ST段抬高或下降。
1.4 统计学分析
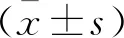
2 结果
2.1 研究组和对照组血清Adropin、PTX-3、hs-CRP、TGF-β1水平比较
研究组血清Adropin水平低于对照组,而PTX-3、hs-CRP、TGF-β1水平均高于对照组(P<0.05)。见表2。
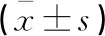
表2 研究组和对照组血清Adropin、PTX-3、hs-CRP、TGF-β1水平比较
2.2 心脏毒性事件组和非心脏毒性事件组血清Adropin、PTX-3、hs-CRP、TGF-β1水平比较
心脏毒性事件组血清Adropin水平低于非心脏毒性事件组,而PTX-3、hs-CRP、TGF-β1水平均高于非心脏毒性事件组(P<0.05)。见表3。
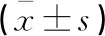
表3 心脏毒性事件组和非心脏毒性事件组血清Adropin、PTX-3、hs-CRP、TGF-β1水平比较
2.3 影响乳腺癌放化疗患者发生相关心脏毒性事件的单因素分析
心脏毒性事件的发生与年龄、高血脂、高血压、糖尿病、CK及CK-MB等因素有关(P<0.05),与卡氏评分、BMI、饮酒、吸烟、肿瘤分期等因素无关(P>0.05)。见表4。
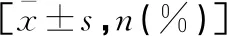
表4 影响乳腺癌放化疗患者发生相关心脏毒性事件的单因素分析
2.4 影响乳腺癌放化疗患者发生相关心脏毒性事件的多因素分析
建立Logistic回归模型,以是否发生相关心脏毒性事件为因变量,发生相关心脏毒性事件赋值为1,未发生相关心脏毒性事件赋值为0。以年龄、高血脂、高血压、血清Adropin、PTX-3、hs-CRP及TGF-β1水平作为自变量,连续变量按照两组总均值分段,转化为两分类变量,回归过程使用“进入法”选择和剔除自变量,设定入选α=0.05,剔除α=0.10。Logistic回归分析显示,年龄(OR=1.919,P<0.001)、高血脂(OR=1.706,P<0.001)、高血压(OR=1.799,P=0.002)、糖尿病(OR=1.752,P=0.004)、Adropin(OR=2.239,P<0.001)、PTX-3(OR=2.085,P<0.001)、hs-CRP(OR=0.773,P=0.003)、TGF-β1(OR=2.361,P=0.007)、CK(OR=2.527,P=0.004)、CK-MB(OR=2.438,P=0.002)是影响乳腺癌放化疗患者发生相关心脏毒性事件的独立危险因素。见表5。
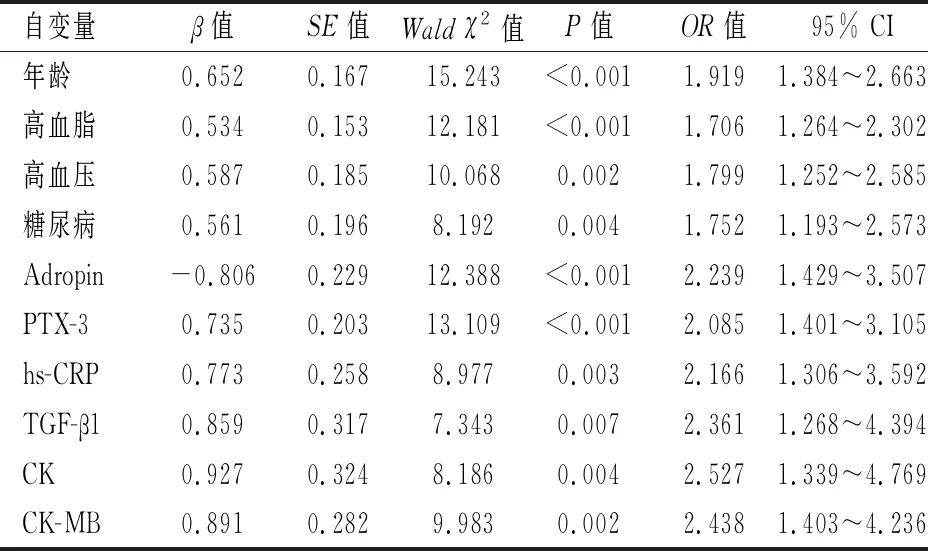
表5 影响乳腺癌放化疗患者发生相关心脏毒性事件的多因素分析
2.5 血清Adropin、PTX-3、hs-CRP、TGF-β1对乳腺癌放化疗相关心脏毒性的早期预测价值
由ROC曲线可知,血清Adropin、PTX-3、hs-CRP及TGF-β1联合预测乳腺癌放化疗患者发生相关心脏毒性事件的ROC曲线下面积(AUC)为0.866高于四者单独检测的0.724、0.691、0.712、0.733(P<0.05)。见图1及表6。
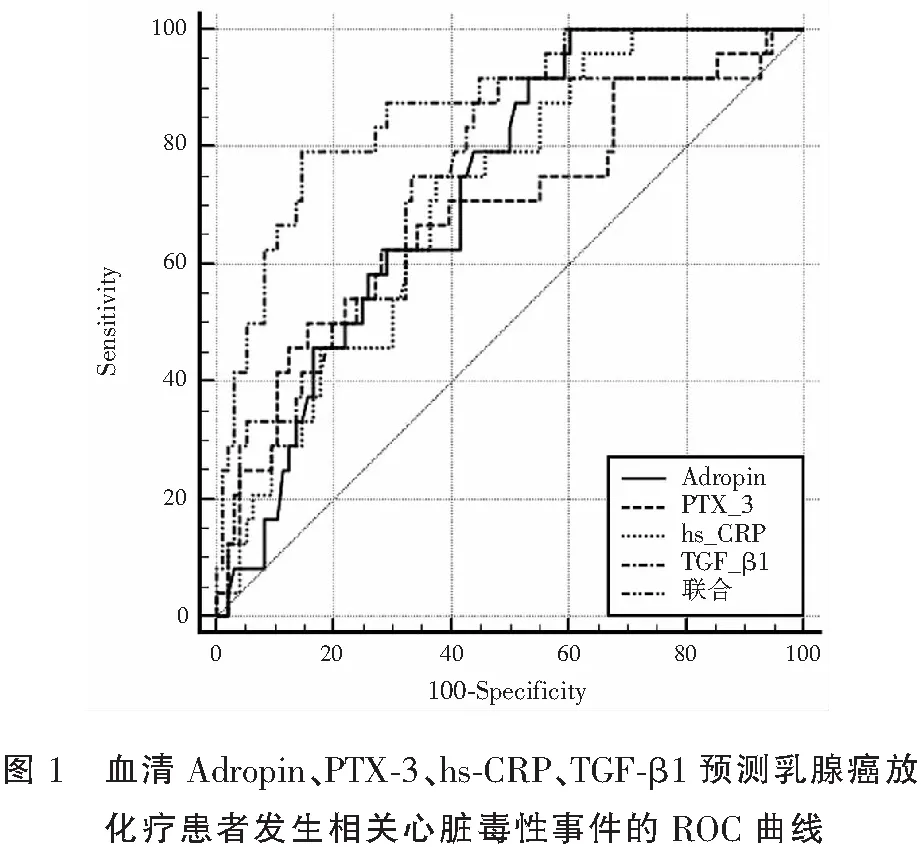
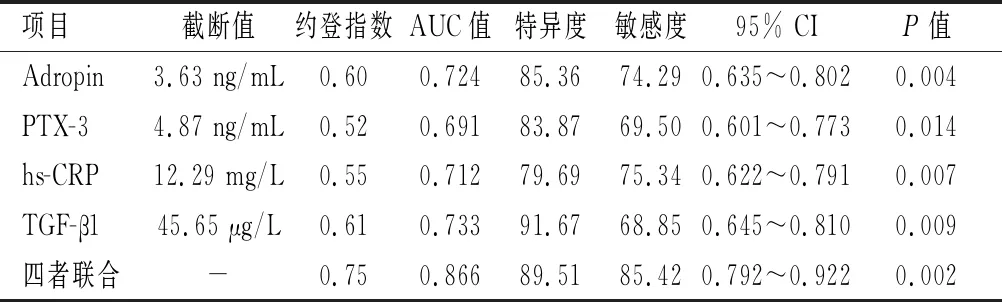
表6 血清Adropin、PTX-3、hs-CRP、TGF-β1对乳腺癌放化疗相关心脏毒性的早期预测价值
3 讨论
现阶段对于乳腺癌的治疗多采用放化疗,可降低肿瘤转移的发生风险、控制病情进展,是提高患者生存率的重要手段[10]。但放化疗均会对患者心脏造成损伤,且损伤具有不可逆性及进展性,故早期及时诊断放化疗相关心脏毒性对指导后续治疗、改善预后具有重要价值[11]。现阶段临床常采用心脏超声诊断放化疗相关心脏毒性事件,但不同操作者超声检查结果存在差异。因此,寻找可以预测乳腺癌放化疗患者发生相关心脏毒性事件的血清学指标是临床研究的热点。Adropin是与机体能量代谢相关的分泌蛋白,能促进血管内皮细胞生长修复。PTX-3由平滑肌细胞、血管内皮细胞等释放,能影响心血管系统局部炎症反应。hs-CRP是急性期反应蛋白,是临床评估机体炎症反应的常用指标,在乳腺癌患者血清中呈高表达。TGF-β1与乳腺癌的发生相关,在乳腺癌组织中呈高表达[12]。
本研究结果显示,研究组血清Adropin水平低于对照组,PTX-3、hs-CRP、TGF-β1水平均高于对照组,提示乳腺癌放化疗相关心脏毒性患者血清Adropin水平呈降低趋势,PTX-3、hs-CRP、TGF-β1水平呈升高趋势。这可能是因为:机体脂类代谢紊乱及高胰岛素血症是引起恶性肿瘤的重要因素,Adropin是具有血管保护作用及改善胰岛素抵抗的蛋白,其可通过改善脂类代谢及胰岛素抵抗降低恶性肿瘤发生风险[13]。放化疗会影响乳腺癌患者的免疫功能,导致巨噬细胞分泌白介素-6(IL-6)、肿瘤坏死因子(TNF-α)等促炎因子,加重机体炎症反应,使急性期反应蛋白分泌量增加,导致血清PTX-3、hs-CRP水平升高。在恶性肿瘤的发生及发展中,TGF-β1能促进上皮间质形成及血管再生,进而影响机体免疫功能和肿瘤微环境,导致肿瘤侵袭性升高。
本研究发现,心脏毒性事件组血清Adropin水平低于非心脏毒性事件组,PTX-3、hs-CRP、TGF-β1水平均高于非心脏毒性事件组,表明Adropin、PTX-3、hs-CRP、TGF-β1与乳腺癌放化疗患者相关心脏毒性事件的发生有关。分析其原因可能为:Adropin激活PI3K-Akt通路,加快Akt磷酸化进程,提高NO合酶含量,促进NO合成,进而保护心血管。此外,Adropin减少肿瘤坏死因子诱导的内皮细胞坏死,有利于心血管内皮细胞的增殖及迁移,从而发挥血管保护作用[14]。PTX-3能抑制成纤维细胞生长因子分泌,阻止修复进程,使心肌组织发生不可逆重塑,加快粥样斑块的形成,从而影响心肌功能,加重心脏功能损伤[15]。PTX-3还可以通过LPs诱导内皮细胞表达组织因子,增加动脉粥样硬化斑块凝血活性,促进动脉粥样硬化,进而损伤心肌功能。hs-CRP能通过与脂蛋白结合激活补体系统,使机体产生大量炎性介质,并释放氧自由基,加重心血管痉挛及内膜损伤,最终加重心脏损伤程度。TGF-β1与心肌纤维化存在密切联系,TGF-β1水平升高会促进炎症因子聚集及中性粒细胞浸润,导致单核细胞损伤心肌细胞,加速心脏功能损伤[16]。本研究对分析影响乳腺癌放化疗患者发生相关心脏毒性事件的因素发现,Adropin、PTX-3、hs-CRP及TGF-β1是放化疗患者发生相关心脏毒性事件的独立危险因素,进一步证明了Adropin、PTX-3、hs-CRP及TGF-β1与放化疗患者发生相关心脏毒性事件存在紧密联系。本研究还发现,血清Adropin、PTX-3、hs-CRP及TGF-β1联合预测乳腺癌放化疗患者发生相关心脏毒性事件的AUC高于四者单独检测,提示血清Adropin、PTX-3、hs-CRP及TGF-β1水平对乳腺癌放化疗相关心脏毒性具有一定的早期预测价值,四者联合预测的价值更高。
综上所述,乳腺癌放化疗相关心脏毒性患者血清Adropin水平呈降低趋势,PTX-3、hs-CRP、TGF-β1水平呈升高趋势,四者对乳腺癌放化疗相关心脏毒性具有一定的早期预测价值。但本研究仍存在一定不足,样本量较小且均来自同一中心,仍需进行多中心、大样本量的科学研究以证实血清Adropin、PTX-3、hs-CRP、TGF-β1对乳腺癌放化疗相关心脏毒性的预测价值。

