胱氨酸/谷氨酸反向转运体的研究进展
唐珍,王含彦,郭冬梅
(川北医学院生物化学教研室,四川 南充 637000)
胱氨酸/谷氨酸反向转运体(cystine/glutamate antiporter,System Xc-)是不依赖Na+的跨细胞膜胱氨酸/谷氨酸反向转运蛋白体,反向指其摄取胞外胱氨酸进入细胞内,交换细胞内谷氨酸到细胞外,摄入细胞的胱氨酸被还原为半胱氨酸后,一部分参与胞内谷胱甘肽(glutathione,GSH)合成,另一部分则出细胞转化为胱氨酸,重新参与System Xc-循环。GSH是一种重要抗氧化剂,所以System Xc-可调控细胞氧化应激;System Xc-释放谷氨酸调节胞外谷氨酸浓度,当细胞外谷氨酸过多时,可抑制System Xc-的功能,使胱氨酸进入细胞减少,同时谷氨酸是兴奋性神经递质,具神经毒性和兴奋性双重作用。因此System Xc-参与谷氨酸释放、胱氨酸转运及GSH的合成,这些物质与神经信号转导,细胞的抗氧化性,肿瘤的发生发展及抗药性密切相关[1]。本文就System Xc-的结构、功能及与疾病的关系做一综述,为进一步探讨通过System Xc-开发药物治疗疾病提供指导。
1 System Xc-概述
1.1 结构特征
System Xc-是异二聚体蛋白,由1条轻链和1条重链组成,二硫键连接两条链。轻链为SLC7A11(SLC7A11基因),又称转运亚基,负责氨基酸转运,对胱氨酸和谷氨酸具有高度特异性,System Xc-活性主要由SLC7A11决定;重链4F2hc又称CD98 (SLC3A2基因),又称调节亚基,负责SLC7A11的胞内运输和胞膜表达。轻链SLC7A11由501个氨基酸残基组成,是一种12通道跨膜蛋白,N端和C端均位于细胞内(图1)。人的SLC7A11基因位于4号染色体,含14个外显子,SLC7A11在脊椎动物中保守。重链4F2hc为单跨膜蛋白,N端位于细胞内,C端位于细胞外,结构域高度糖基化。当4F2hc缺乏时,SLC7A11蛋白水平显著下降,表明4F2hc在维持SLC7A11蛋白稳定性中的重要作用,另外4F2hc也是其他一些大中性氨基酸转运体和葡萄糖转运体的伴侣蛋白。
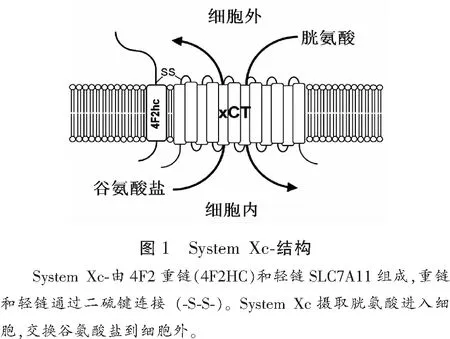
1.2 表达的组织特异性及转运特点
SLC7A11仅在特定的脑区和免疫组织如胸腺和脾脏中表达。SLC7A11mRNA在小鼠脑组织中有显著表达,在属于免疫系统的胸腺和脾脏中,SLC7A11的表达水平更高。在肺、心脏、肝、肾中未见SLC7A11表达或极低水平。System Xc-在人的大脑和脊髓中高表达,在胰腺也有表达,但在外周白细胞,脾脏、胸腺及淋巴中SLC7A11表达极低或几乎不表达。另外,System Xc-在多种肿瘤如乳腺癌、淋巴瘤,胶质瘤中表达增加,提示System Xc-与肿瘤发生密切相关。细胞膜两侧谷氨酸和胱氨酸浓度影响其氨基酸转运方向,细胞外谷氨酸是通过System Xc-摄取胱氨酸的竞争性抑制剂。
2 System Xc-的功能特征
2.1 抗氧化应激作用
System Xc-摄取的胱氨酸被还原为半胱氨酸后,参与GSH合成,GSH是哺乳类动物体内重要的抗氧化剂,可降低氧化应激。System Xc-缺乏的小鼠氧化还原平衡破坏。体外抑制 System Xc-活性导致氧化应激,引起GSH耗竭和细胞死亡。SLC7A11敲除小鼠血浆内半胱氨酸/胱氨酸组合处于氧化状态,说明System Xc-在维持胞外半胱氨酸浓度中发挥重要作用。细菌脂多糖刺激SLC7A11缺陷型和野生型小鼠腹腔巨噬细胞,可引起两种细胞的氧化应激增加,但SLC7A11缺陷型小鼠巨噬细胞活性氧含量高于野生型巨噬细胞,说明SLC7A11参与了巨噬细胞氧化应激的降低,SLC7A11在应激下的保护作用被认为是由于它导入胱氨酸,促进GSH合成。
2.2 活性调控
System Xc-是高度可诱导氨基酸转运体。体外System Xc-活性诱导物包括氧和多种亲电剂,在某些细胞类型中,细菌内毒素和炎症细胞因子肿瘤坏死因子α也可诱导System Xc-表达。常规细胞培养条件下,环境O2为21%时,也能诱导不同类型细胞的System Xc-活性。氨基酸缺乏(包括胱氨酸缺乏)、氧化损伤及葡萄糖饥饿均可诱导SLC7A11基因表达,SLC7A11亚基活性增强。氧化应激诱导剂百草枯可引起肺组织System Xc-表达增强。System Xc-活性受其特异性亚基SLC7A11转录水平的调控,核因子红细胞2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)和激活转录因子4(artificial transcription factor,ATF 4)调控SLC7A11表达,小鼠SLC7A11基因的启动子区有多种抗氧化剂应答元件(Antioxidant Response Element,ARE)基序, Nrf2与ARE结合并调控ARE介导的SLC7A11基因表达,一些致氧化损伤药物就是通过Nrf2-ARE信号通路激活System Xc-表达。
3 System Xc-相关疾病
3.1 System Xc-与中枢神经系统疾病
System Xc-是脑内谷氨酸的重要来源,谷氨酸是兴奋性神经递质,影响兴奋性神经传递、兴奋阈,具兴奋性毒性,因此System Xc-参与神经细胞的抗氧化作用及神经传递行为,中枢神经系统疾病与细胞外谷氨酸增多和细胞内GSH减少的System Xc-功能紊乱密切相关。活性氧和炎性细胞因子增强SLC7A11的转录,因此System Xc-可能参与了与氧化应激和神经炎症相关的神经系统疾病。
System Xc-是中枢神经小胶质细胞和星形胶质细胞中的一种转运体,在神经退行性疾病(包括多发性硬化症、阿尔茨海默病、帕金森,癫痫和脑缺血)中表达增加。谷氨酸兴奋性毒性在多发性硬化症(multiple sclerosis ,MS)病理过程中可引起少突胶质和轴突损伤,胞外谷氨酸在大脑中的浓度由System Xc-控制。MS模型小鼠中System Xc-活性增加[2]。在胶质瘤中System Xc-的表达普遍上调,谷氨酸转运蛋白的表达下调[3],导致细胞外谷氨酸的积累和周围非肿瘤组织细胞兴奋性毒性的死亡;另外激活的小胶质细胞中System Xc-的上调参与了谷氨酸过量介导的多种神经退行性疾病的发病机制。 因此,System Xc-是治疗胶质瘤和神经炎症疾病的新药物靶点,System Xc-抑制剂可用于治疗以神经炎症和谷氨酸兴奋性毒性为特征的疾病[4],另外研究发现System Xc-可抑制自身免疫性炎性脱髓鞘T细胞浸润,System Xc-介导T细胞浸润和促进髓鞘破坏,疾病过程伴随中枢神经系统谷氨酸调节异常。System Xc-抑制剂可减轻慢性和复发性自身免疫性脑脊髓炎,抑制疾病发展[5]。有观点指出抑制System Xc-虽有助于降低谷氨酸兴奋性毒性,但同时降低了System Xc-的抗氧化应激能力,所以最佳方案是同时上调System Xc-和谷氨酸转运体表达[6]。
3.2 System Xc-与肿瘤
3.2.1 癌细胞SLC7A11表达上调 胶质瘤研究发现System Xc-摄入半胱氨酸,合成GSH,癌细胞抗氧化应激能力增强;System Xc-释放谷氨酸可引起兴奋性毒性导致神经元死亡,为肿瘤扩张提供空间,同时谷氨酸还可激活胶质瘤受体增强肿瘤迁徙能力。研究发现淋巴瘤、胶质瘤,胰腺癌,乳腺癌,口腔鳞状细胞癌内SLC7A11表达上调[7-10]。与癌旁组织和正常口腔细胞系相比,MIR-375在口腔鳞状细胞癌细胞中表达明显下调,而SLC7A11表达上调;miR-375能有效抑制口腔鳞癌细胞中SLC7A11的表达而达到抑癌作用[8]。吸烟可诱导口腔癌细胞中SLC7A11的表达,提示SLC7A11的过度表达可能支持肺癌的进展。SLC7A11在非小细胞肺癌(non-small cell lung cancer ,NSCLC)细胞膜上高表达, SLC7A11表达与癌晚期相关,并预示5年生存率下降[11];多形性胶质母细胞瘤(glioblaummultiforme,GBM)是成人最具侵袭性的原发性恶性脑肿瘤。GBM细胞上调了SLC7A11 的表达,System Xc-调节GSH的产生和胶质瘤的生长[7]。
3.2.2 System Xc-与肿瘤多重耐药 多重耐药性(multidrug resistance,MDR)是癌细胞对不同药物同时产生耐药性,MDR是癌症化疗效果不佳的主要原因,SLC7A11表达上调与肿瘤细胞的耐药有关。癌症治疗时癌细胞处于氧化应激状态,SLC7A11表达的增加可增加癌细胞内GSH,导致癌细胞抵抗放化疗的能力增强[12]。SLC7A11的表达与1400种候选抗癌药物中的296种呈负相关性,如格尔德霉素,南蛇藤醇等。System Xc-抑制剂可降低细胞内GSH,增强格尔德霉素抗癌作用,逆转细胞对抗癌药物[13-15]的多药耐药性,且System Xc-特异性地介导对产生大量ROS的抗癌药物的耐药性,如格尔德那霉素和南蛇藤醇。肺腺癌对顺铂的敏感性直接关系到癌患者的预后,System Xc-的高表达水平,促进了肺腺癌细胞对顺铂的耐药性[16]。
3.2.3 System Xc-受潜在致癌途径的调控 System Xc-受多条潜在致癌途径的调控, System Xc-不仅可以在基因水平,mRNA或蛋白水平被抑制或激活,还可以通过Nrf 2途径及ATF 4途径被调控。Nrf2/ARE/SLC7A11通路及eIF2α/ATF4/SLC7A11通路调控 System Xc-活性。在淋巴瘤[7]、胶质瘤[8]和胰腺癌[9]SLC7A11在mRNA或蛋白水平上调,人乳腺癌中microRNA miR-26b可沉默SLC7A11 mRNA,抑制SLC7A11表达[17];Nrf2与ARE结合并调控ARE介导的靶基因表达,在小鼠SLC7A11基因的启动子区域已鉴定出至少有4种ARE基序,在多种癌细胞系[18]中发现,Nrf 2的激活可导致SLC7A11上调;在多种癌症中ATF4被激活,培养基内氨基酸缺乏可激活磷酸化真核翻译起始因子2α(eukaryotic initiation factor 2α,eIF2α,)/转录激活因子4(activating transcription factor-4,ATF4)/ SLC7A11通路。eIF2α磷酸化后激活ATF4生成,生成的ATF4与一些辅助蛋白结合成活性蛋白体,然后与SLC7A11基因启动子上的氨基酸反应元件结合,激活SLC7A11转录[19]。
3.2.4 System Xc-与癌症治疗 System Xc-可做为肿瘤治疗的潜在靶点,抑制 System Xc-可减少癌细胞增殖、侵袭及转移。在体外谷氨酸抑制System Xc-介导的胱氨酸摄取导致的恶性细胞体外增殖[20];System Xc-抑制剂磺胺嘧啶可抑制胶质瘤,淋巴瘤,乳腺癌、前列腺癌、非小细胞性肺癌和胰腺癌细胞的生长[21-22],磺胺嘧啶可通过抑制NF-κB激活,进而抑制 System Xc-(导致半胱氨酸和GSH缺乏)。
食道癌的体外实验发现,特异的siRNA沉默SLC7A11基因可抑制癌细胞的侵袭,磺胺嘧啶抑制癌向体内转移[15]。磺胺嘧啶协同增强X射线对黑色素瘤细胞的杀伤作用,提高放射治疗的敏感性,表明使用磺胺嘧啶治疗抗射线癌症的可能性[23]。化疗药物替莫唑胺与磺胺嘧啶联合使用对癌细胞杀伤有协同作用,SLC7A11在多形性胶质母细胞瘤(GBM)中介导GBM对替莫唑胺的耐药性。U251胶质瘤细胞SLC7A11基因敲除则癌细胞GSH生成减少,ROS增加,细胞的死亡增加。SLC7A11过表达增强癌细胞抗氧化应激能力,降低对替莫唑胺的敏感性[24]。
对小鼠和人乳腺癌细胞的研究发现, TrkA抑制剂AG 879可摄取胱氨酸,释放谷氨酸,引起其下游System Xc-功能亚基SLC7A11的抑制,降低System Xc-活性,减轻小鼠癌痛及降低癌细胞抗氧化应激能力。因此,System Xc-介导的TrkA抑制为癌症疼痛治疗提供潜在干预靶点[25]。
System Xc-抑制剂可优先杀死Tp 53突变癌细胞[26];可通过抑制Nrf 2/SLC7A11/GSH和APR-246协同诱导突变型p53肿瘤的凋亡。SLC7A11在乳腺癌中高表达,其下调则改变体外乳腺癌干细胞功能,抑制癌细胞的体内肺转移[9], SLC7A11受NRF 2的调控。增加Nrf 2的核内转运或Nrf 2表达上调,则SLC7A11 mRNA和蛋白表达增加; Keap 1过表达则抑制SLC7A11表达, keap 1的siRNA敲除则上调了SLC7A11蛋白水平和转运蛋白活性。说明Keap1/Nrf2/SLC7A11通路在System Xc-平衡乳腺癌细胞氧化应激中的重要性[27],同时此通路也可作为抑制肿瘤的靶点。在体外异丙酚通过抑制System Xc-活性,进而抑制C6胶质瘤细胞的活性、增殖,侵袭性和迁移。人胰腺癌细胞组织培养物中添加半胱氨酸酶,则癌细胞死亡。SLC7a11亚基的缺失抑制PDAC的生长[28]。苯并吡喃衍生物2-imino-6-methoxy-2H-chromene-3-carbothioamide(IMCA)显著抑制结直肠癌细胞的活力[29]。
4 展望
System Xc-可摄取胱氨酸,在细胞内合成GSH,调控细胞抗氧化性;同时释放谷氨酸,激活谷氨酸受体,介导神经信号传递,因此在中枢神经系统System Xc-具有抗氧化和兴奋性毒性双重作用,而其在不同神经系统疾病中的具体作用还需深入研究。
System Xc-特异性亚单位SLC7A11在体内正常条件下表现出限制性的表达模式,如SLC7A11在正常脑组织中主要表达于脑内,虽然SLC7A11基因在人类癌症中的突变频率普遍较低,但它在人类各种癌症中都有高表达;但同时在氧化应激状态可被诱导,如炎性刺激诱导System Xc-表达,引起GSH合成增加,从而增强抗氧化防御。所以System Xc-保护正常细胞免受致癌物导致的氧化损伤,参与癌肿瘤的发生,恶性发展及抗肿瘤药物的耐药性,是癌症治疗和预防的潜在靶点。如SLC7A11可能是治疗高表达SLC7A11的理想靶点,磺胺吡啶或麦角黄素治疗可抑制肿瘤的发展[18],表明这些药物对癌症的治疗作用,开发高特异性的SLC7A11抑制剂将对靶向治疗癌症至关重要。未来开发更多System Xc-抑制剂和发现诱导System Xc-的方法可为进一步研究其生理功能和相关疾病治疗铺平道路。System Xc-受多条潜在致癌途径的调控,Nrf2/ARE / SLC7A11通路及eIF2α/ATF4/SLC7A11通路调控System Xc-活性,NGF/ TrkA/ SLC7A11通路则与癌性骨痛有关,突变型p53蛋白/Nrf 2/SLC7A11/GSH,调控Tp 53 相关癌症的发生发展,Keap 1/Nrf2/SLC7A11通路在乳腺癌细胞氧化应激中具重要作用,未来还需进一步详细研究各通路,发现新的通路,并可研发针对不同通路的药物以治疗疾病或作为研究System Xc-的工具药物。
研究发现除SLC7A11外还有SLC1A5、SLC7A5和SLC6A14这3种氨基酸转运蛋白在癌症中高表达,且这些转运体在功能上是耦合的,从而极大提高其促进癌症生长和抗药性,因此未来研究中也需考虑不同转运体的这种协同作用[30]。

