中心静脉压联合下腔静脉呼吸变异度在脓毒性休克患者液体复苏中的预测价值
刘冬辉,刘超,文海燕,贾松,候丽彦,蔡德阳,赵影
(保定市第二中心医院,1.重症医学科;2.泌尿外科,河北 保定 072750)
脓毒性休克是脓毒症合并出现严重的循环障碍和细胞代谢紊乱,发病率呈逐年升高趋势,且病情发展极为迅速[1]。液体复苏是脓毒性休克复苏治疗的基石之一[2]。然而,液体复苏过度可导致一系列并发症,如心力衰竭、肺水肿、肠壁水肿、腹腔高压、腹腔间隔室综合征等[3-4],故必须评估其容量反应性,避免液体复苏过度。然而,目前评估脓毒性休克容量反应性尚无理想的方法和手段。传统的评估指标如中心静脉压(central venous pressure,CVP),因获得容易而被广泛用作评价有效循环血容量,指导补液治疗[5]。最近有研究[6]发现,下腔静脉呼吸变异度(variability of inferior vena cava,VIVC)也可作为评估脓毒性休克患者容量复苏的潜在指标,且测量方法简便、无创,便于临床推广应用。因此,本研究旨在探讨CVP联合VIVC在脓毒性休克患者液体复苏中的预测价值,为脓毒性休克的液体管理提供理论依据。
1 资料与方法
1.1 一般资料
选取2018年3月至2021年3月保定市第二中心医院重症医学科的92例脓毒性休克患者为研究对象,其中男性53例,女性39例;年龄47~84岁,平均(61.28±7.36)岁。依据患者治疗后28 d不同结局分为存活组(n=70)和死亡组(n=22);依据患者中心静脉压高低分为高CVP组(>8 mmHg,n=44)和低CVP组(<8 mmHg,n=48);依据VIVC高低分为高VIVC组(>19.25%,n=21)和低VIVC组(<19.25%,n=71)。本研究获得我院伦理委员会审查批准,患者家属知情同意。纳入标准:符合《第三次脓毒症和脓毒性休克定义国际共识》诊断标准[7],即有明确感染表现,且持续性低血压,需血管收缩药以维持平均动脉压(MAP)≥65 mmHg,血乳酸浓度>2 mmol/L。排除标准:(1)合并低血容量性休克、心源性休克或梗阻性休克者;(2)年龄<18岁、妊娠;(3)颅内高压、深静脉血栓形成、下肢或骨盆骨折以及使用弹力袜者;(4)严重主动脉瓣反流或行主动脉内球囊反搏者。
1.2 方法
以患者入重症监护室时或入重症监护室后诊断为脓毒性休克为起点,以治疗后28 d为终点,所有患者均进行早期液体复苏,记录患者复苏前及复苏6、12、24 h后的心率(HR)、MAP、CVP、VIVC水平。CVP测定:患者取平卧位,行右颈内或锁骨下静脉穿刺,置入双腔中心静脉导管,以右侧腋中线与第四肋间的交点作为零点,通过整个呼吸周期呼吸末读取CVP的数值。VIVC测定:患者取平卧位,二维超声剑下下腔静脉纵切面,采用M型超声对患者进行测量,在下腔静脉距离右心房入口2 cm取样,测量呼气末下腔静脉直径(Dexp)及吸气末下腔静脉直径 (Dinsp),每个指标测量3次,取平均值。VIVC=(Dinsp-Dexp)/Dexp×100%。
1.3 观察指标
(1)患者复苏前及复苏6、12、24 h后,HR、MAP、CVP、VIVC水平、急性生理学及慢性健康状况评分系统(acute physiology and chronic health evaluation scoring system,APACHEⅡ)评分、序贯器官衰竭评分(sequential organ failure assessment,SOFA)评分:APACHCE-Ⅱ评分包括直肠温度、呼吸频率、心率、平均动脉压、氧合指数、血肌酐、血清钠、血清钾等12项生理学变量评分,分值0~60分,年龄分值0~6分,慢性健康状况(CPS)分值2~5分,总分0~71分,分值越高病死率越高[8]。SOFA评分包括呼吸、凝血系统、肝脏、循环系统、神经系统、肾脏6项,每项4分,总分0~24分,得分越高预后越差[9]。(2)治疗后28 d存活组和死亡组患者CVP、VIVC、APACHEⅡ评分、SOFA评分。(3)高CVP组和低CVP组[10]复苏6 h VIVC、APACHEⅡ评分、SOFA评分、死亡率。(4)高VIVC组和低VIVC组[11]患者复苏6 h CVP、APACHEⅡ评分、SOFA评分、死亡率。
1.4 统计学分析
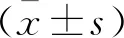
2 结果
2.1 脓毒性休克患者复苏前后各临床指标水平比较
复苏6、12、24 h 后,脓毒性休克患者的MAP、CVP、VIVC相较复苏前改善,差异有统计学意义(P<0.05)。见表1。
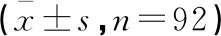
表1 脓毒性休克患者复苏前后各临床指标水平变化
2.2 治疗后28 d存活组和死亡组各临床指标水平比较
治疗28 d后,存活组患者复苏24 h后CVP相较死亡组升高(P<0.05),VIVC、APACHEⅡ评分、SOFA评分相较死亡组降低(P<0.05)。见表2。
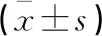
表2 治疗后28 d存活组和死亡组各临床指标比较
2.3 不同CVP水平的脓毒性休克患者治疗后各指标比较
复苏6 h后,高CVP组患者VIVC、APACHEⅡ评分、SOFA评分及死亡率相较低CVP组降低,差异有统计学意义(P<0.05)。见表3。
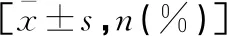
表3 不同CVP水平的脓毒性休克患者治疗后各指标比较
2.4 不同VIVC水平的脓毒性休克患者治疗后各指标比较
复苏6 h后,高VIVC组患者CVP相较低VIVC组降低,差异有统计学意义(P<0.05),APACHEⅡ评分、SOFA评分及死亡率相较高VIVC组升高,差异有统计学意义(P<0.05)。见表4。
表4 不同VIVC水平的脓毒性休克患者治疗后各指标比较
2.5 CVP联合VIVC对脓毒性休克液体复苏容量反应性的预测价值
ROC曲线分析显示,CVP联合VIVC预测脓毒性休克液体复苏容量反应性的曲线下面积(AUC)为0.877,约登指数为1.637,敏感性为81.24%,特异性为82.52%。见表5。
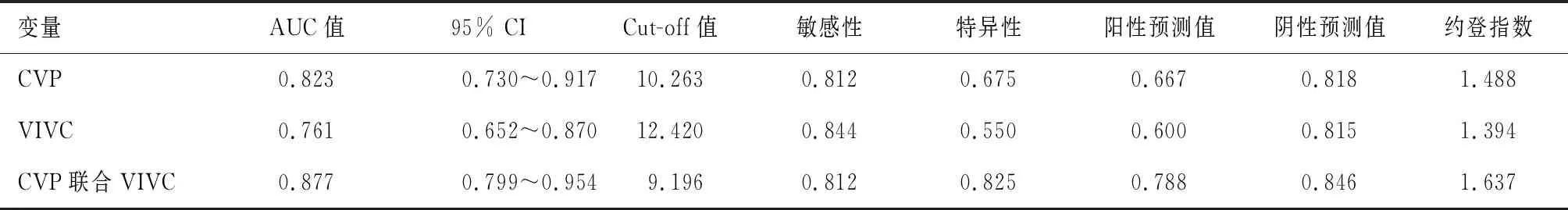
表5 CVP联合VIVC对脓毒性休克液体复苏容量反应性的预测价值
3 讨论
脓毒性休克的发病率高达 240.4/10万人,病死率>40%,是重症监护病房最为常见的死亡原因[12]。脓毒性休克期间,急性循环衰竭导致细胞内氧供需失衡,液体复苏是脓毒性休克患者治疗期间增加氧输送的主要措施,是复苏治疗基石之一[13]。然而,超量的液体进入机体组织间隙可导致多脏器的损害,主要包括心脏、肺脏、胃肠道系统,从而导致心力衰竭、肺水肿、肠壁水肿、腹腔高压、腹腔间隔室综合征等,使死亡率增加[14]。因此,医生需要遵循通过容量反应性来确定脓毒性休克患者治疗利弊关系的液体管理原则,减少不必要的液体复苏。
容量反应性是指快速输入液体后CO或SV随之明显增加的现象,反映了心脏处于心功能曲线的上升段[15]。目前,评估容量反应性方法较多,常用且比较热门的方法有一般评估、被动抬腿试验、超声心动图(彩色多普勒技术)、脉搏指示连续心输出量监测等[16-18],既有有创的手段,也有无创方法,但尚无更为理想的方法和手段,实施有效的液体复苏在脓毒性休克患者中仍较为困难。传统的评估指标如CVP,因获得容易而被广泛用作评价有效循环血容量,指导补液治疗[19]。有学者[20-21]认为,VIVC也可作为评估脓毒性休克患者容量复苏的潜在指标,且VIVC测量方法简便、无创,便于临床推广应用。
本研究结果显示,复苏6 h后,高CVP组患者VIVC、APACHEⅡ评分、SOFA评分及死亡率相较于低CVP组降低(P<0.05);CVP相较于低VIVC组降低(P<0.05),APACHEⅡ评分、SOFA评分及死亡率相较于高VIVC组升高(P<0.05)。可能是由于脓毒性休克患者液体复苏过度更易引起CVP和VIVC增高,从而引起一系列病理生理改变,如心排量下降、静脉回流受阻、血压下降、肺动脉压上升;内脏血管受压而血供不足,导致器官功能障碍;膈肌上抬,潮气量下降,PO2下降,PCO2增加[22-23]。
本研究进一步分析了CVP联合VIVC对脓毒性休克患者液体复苏容量反应性的预测价值,结果显示,CVP联合VIVC预测脓毒性休克液体复苏容量反应性的曲线下面积为0.877,约登指数为1.637,敏感性为81.24%,特异性为82.52%,表明CVP联合VIVC可用于预测脓毒性休克患者液体复苏容量反应性,且测定较为简便、安全,便于临床常规开展,有助于节省患者的诊疗成本。由于CVP和VIVC与APACHEⅡ评分和SOFA评分有相关性(P<0.05),且存活组与死亡组的APACHE II 评分和SOFA 评分也存在差异(P<0.05),进一步提示CVP联合VIVC在预测脓毒性休克患者预后质量时具有较高的临床应用价值。实时监测脓毒性休克患者CVP和VIVC水平,并进行及时干预及纠正,可有效改善患者预后质量。
综上,CVP联合VIVC可用于预测脓毒性休克患者液体复苏容量反应性,对于指导临床液体复苏治疗具有重要意义,有助于避免脓毒性休克液体复苏过度,从而降低病死率,改善患者的预后。

