以西达本胺联合地西他滨为主的诱导化疗方案治疗伴感染儿童急性髓系白血病3 例并文献复习
梁 妍,柴丽娜,王国旗,王林莉,冯 晨
解放军总医院第一医学中心 儿科,北京 100853
急性髓系白血病(acute myeloid leukemia,AML)占儿童期白血病的20%。随着近年来治疗手段的发展,AML 的总体生存率达到60%~70%,较前得到很大提升[1]。其治疗多依赖于异基因造血干细胞移植(hematopoietic cell transplantation,HCT),部分患儿也可从非清髓的化疗中获益。AML 的化疗方案通常先给予强化诱导治疗,待骨髓缓解后采用高剂量化疗或HCT 进行巩固治疗。AML 高复发率、多重耐药等问题亟待解决。数据显示,超过50% 达完全缓解(complete remission,CR)的AML 患儿最终复发,且传统化疗方案的不良反应程度较重,其用药后中性粒细胞缺乏率为29%~45%,中性粒细胞减少的中位持续时间为27 d,因此常造成严重感染,甚至死亡[2-4]。研究表 明DNA 甲基转移酶(DNA methyl-transferase,DNMT)抑制剂地西他滨可增加白血病细胞及实体肿瘤细胞的化疗敏感性,诱导肿瘤细胞的凋亡[5-6]。随着表观遗传学研究的进展,表观遗传调控药物组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACi) 西达本胺近年来成为研究热点。西达本胺是我国自主研发的选择性HDACi,可调控肿瘤细胞中周期蛋白的表达,并抑制DNA 损伤修复活性,进而抑制肿瘤细胞周期及分化,诱导肿瘤细胞凋亡,且不良反应程度相对较轻,对骨髓的抑制相对较轻[7]。西达本胺可抑制肿瘤细胞上皮间充质表型转化并调节肿瘤干细胞活性,促进肿瘤细胞分化,增强其他化疗药物对白血病细胞的化疗敏感性和细胞毒性作用[8]。现国内外有少量文献报道应用CDCAG 方案(西达本胺、地西他滨、阿糖胞苷、阿克拉霉素及粒细胞刺激因子)治疗成人AML 收获了较好的疗效,且并发症发生率较低,但目前尚无该方案在儿童中大规模应用的报道。本研究总结3 例2020 年10 月-2021 年3 月就诊于我中心的AML 儿童病例,并回顾既往文献,分析总结改良版CDCG 方案(西达本胺、地西他滨、阿糖胞苷及聚乙二醇化重组人粒细胞刺激因子PEG-rhG-CSF)对伴感染儿童AML 的诱导缓解效果。
病例资料
病例1:女,10 岁,2020 年10 月中旬以颈部淋巴结肿大起病,无发热,伴触痛,于2020 年10 月23 日入住解放军总医院第一医学中心儿科,骨髓细胞学、免疫学、细胞遗传学和分子生物学
(morphology、immunology、cytogenetic、molecular biology,MICM)结果提示AML,全身浅表淋巴结肿大,颅脑MRI 提示诸骨信号增强,考虑红骨髓化明显(表1)。化疗前患儿无感染,第1 疗程给予患儿DAE 方案化疗:盐酸柔红霉素40 mg/m2,d2、d4、d6;阿糖胞苷100 mg/m2,d1~d7;依托泊苷100 mg/m2,d2~d6。第11 天患儿出现肺部感染,且骨髓抑制严重,抑制期较长,为减轻患儿用药不良反应,避免感染加重,第2 疗程给予患儿改良CDCG 方案(患儿体质量52 kg,体表面积1.44 m2):西达本胺30 mg/次,每周2 次,d1~d14;地西他滨20 mg/m2,d1~d5;阿糖胞苷100 mg/m2,d1~d5 ;PEG-rhG-CSF 0.1 mg/kg,d1。第3 疗程继续给予患儿CDCG 方案化疗,剂量同第2 疗程。第1 疗程DAE 方案化疗第21 天评估骨髓缓解程度为部分缓解(partial remission,PR);第28 天评估骨髓缓解程度为CR。第2 疗程CDCG 方案化疗第21 天评估骨髓缓解程度为细胞学完全缓解,分子生物学未缓解(CRi)。第3 疗程第28 天评估骨髓缓解程度为CR(表2、图1、图2)。第1 疗程DAE 方案化疗第3 天出现Ⅳ度骨髓抑制,胃肠道反应Ⅲ度,第4 天出现凝血功能异常,第11 天出现发热,查肺部CT 提示双下肺炎症,予氟氧头孢、替考拉宁联合伏立康唑抗感染治疗4 d后体温降至正常,1 d 后再度出现发热,将抗生素更换为利奈唑胺、亚胺培南联合卡泊芬净治疗6 d后体温正常。患儿Ⅳ度骨髓抑制期长达23 d。第2 疗程CDCG 方案化疗前复查肺部CT,提示双肺下叶感染性病变较前吸收,化疗同时继续予伏立康唑抗感染治疗,Ⅲ度骨髓抑制期持续9 d,胃肠道反应0 度。第3 疗程Ⅲ度骨髓抑制期持续3 d,复查肺部CT 提示感染灶消失,于2021 年1 月10 日出院(表3)。
病例2:女,12 岁,2020 年10 月中旬以反复发热伴咳嗽起病,于2020 年10 月21 日入住解放军总医院第一医学中心儿科,MICM 结果提示AML,入院时患儿肺CT 提示右肺上叶感染性病变(表1)。应用头孢哌酮、替考拉宁联合伏立康唑抗感染的同时,给予患儿DAE 方案化疗,患儿第17 天出现腹部感染。因患儿第1 疗程化疗前存在肺部感染,化疗后继发腹部感染,故第2 疗程给予患儿CDCG 方案(患儿体质量33 kg,体表面积1.12 m2):西达本胺20 mg/次,每周2 次,d1~d14;地西他滨20 mg/m2,d1~d5;阿糖胞苷100 mg/m2,d1~d5;PEG-rhG-CSF 0.1 mg/kg,d1。同时予头孢克洛联合伏立康唑抗感染。第1 疗程DAE 方案化疗第21 天评估骨髓缓解程度为未缓解(non-remission,NR);第28 天评估骨髓缓解程度为CRi。第2 疗程CDCG 方案化疗第28 天评估骨髓缓解程度为CR(表2、图1、图2)。第1 疗程DAE 方案化疗过程中因原发病,第1 天出现Ⅳ度骨髓抑制,持续24 d,第5 天患儿体温再次升高,复查肺部CT 较前加重,第17 天患儿诉腹痛,右下腹压痛、反跳痛明显,可触及包块,查腹部超声提示肠套叠待除外,腹部CT 提示炎症?肠梗阻?予利奈唑胺、亚胺培南联合伏立康唑抗感染治疗18 d 后右下腹包块消失。复查肺部CT 提示双肺炎症部分较前吸收,部分新发,腹部超声未见明显异常。第2 疗程CDCG 方案化疗过程中第10 天出现发热,骨髓抑制Ⅳ度,第16 天复查腹部超声提示右下腹炎性病灶可能性大,予调整抗生素为利奈唑胺、亚胺培南联合卡泊芬净,抗感染治疗9 d 后体温降至正常。复查腹部超声提示右下腹不均质回声包块较前缩小。肺CT 提示右肺上叶炎症范围较前吸收,于2021 年1 月8 日出院(表3)。

表1 3 例AML 患儿基本信息Tab.1 Characteristics of 3 cases with AML

表2 3 例AML 患儿化疗后转归(%)Tab.2 Outcome of 3 cases with AML (%)

表3 3 例AML 患儿的治疗情况及相关不良反应Tab.3 Treatment and adverse effect of 3 cases with AML
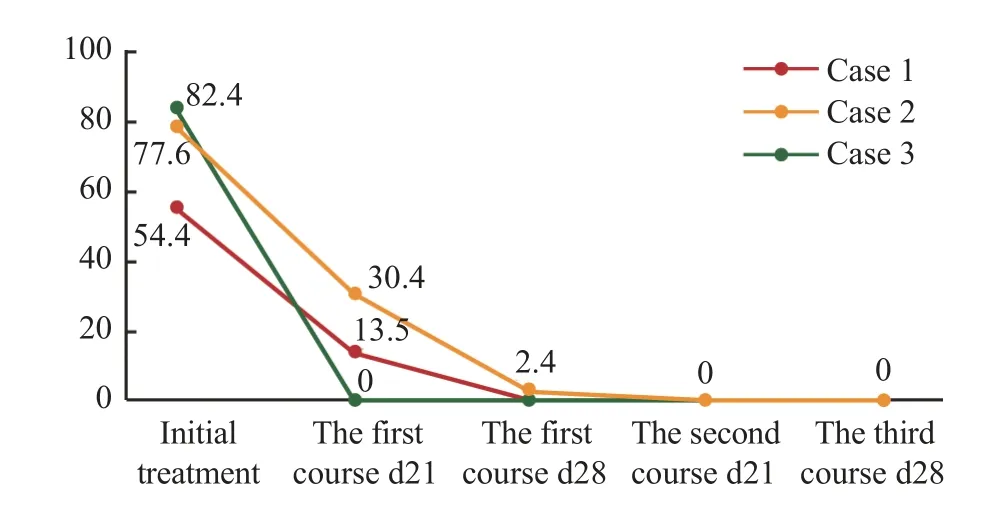
图1 3 例AML 患儿骨髓恶性细胞数(%)随时间变化图Fig.1 Changes of proportion of bone marrow blasts (%) over time
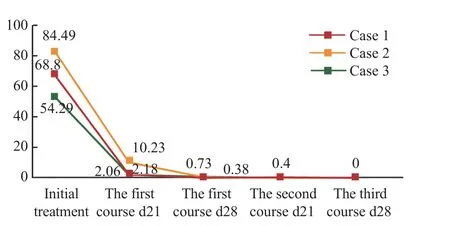
图2 3 例 AML 患儿骨髓微小残留数(%)随时间变化图Fig.2 Changes of minimal residual number (%) in bone marrow over time
病例3:女,12 岁,2021 年1 月下旬以鼻窦炎、左侧乳突炎起病,于2021 年2 月18 日入住解放军总医院第一医学中心儿科,MICM 结果提示AML,伴中枢神经系统白血病(脑脊液免疫分型提示10.35%为恶性幼稚髓系细胞)(表1)。入院时患儿影像学检查提示鼻窦炎、左侧乳突炎,血常规提示白细胞计数增高、中度贫血、重度血小板减低,患儿持续发热伴双侧上颌窦压痛,左侧为著。考虑患儿存在严重骨髓抑制及感染,应用氟氧头孢、替考拉宁联合伏立康唑抗感染的同时,给予患儿改良CDCG 方案化疗(患儿体质量45.2 kg,体表面积1.4 m2)同病例1。第1 疗程CDCG 方案化疗第21 天评估骨髓缓解程度为CRi,复查脑脊液未见恶性幼稚细胞。第28 天评估骨髓缓解程度为CRi。脑脊液未见恶性幼稚细胞(表2、图1、图2)。第1 疗程CDCG 方案化疗第3 天出现Ⅳ度骨髓抑制(血小板计数18×109/L),第11 天出现中性粒细胞缺乏,抗生素调整为利奈唑胺、亚胺培南联合伏立康唑治疗,Ⅳ度骨髓抑制期持续21 d,患儿骨髓状态恢复后体温随即恢复正常,双侧上颌窦无压痛。复查颅脑MRI 提示右额窦化脓性感染,范围较前缩小,于2021 年3 月22 日出院(表3)。
讨论
以“地西他滨”“西达本胺”“CAG”“急性髓系白血病”为关键词检索万方和CNKI 数据库(建库至2021 年4 月),检索到1 篇中文文献[9];以“Chidamide”“Decitabine”“CAG”“AML”为关键词检索Pubmed 数据库(建库至2021 年4 月),检索到1 篇英文文献[10]。整合并筛选所检索到文献中的病例资料。所查文献共2 篇,其中接受CDCAG 方案化疗的病例共108 例,18 岁以下儿童共5 例(4.6%)。所有患者接受1~2 个疗程CDCAG 方案化疗后评估治疗效果(表3),其中近半数的病例可获得CR/CRi。儿童病例中,获得CRi 的病例3 例(60%),无病存活病例3 例(60%),可见儿童病例应用CDCAG 后也可获得较好预后(表4)。

表4 既往文献中CDCAG 治疗1~ 2 周期后效果评估Tab.4 Effect evaluation of previously reported cases after 1-2 cycles of CDCAG treatment
急性髓系白血病预后较差,临床上常规的治疗方案多为化疗联合造血干细胞移植,其选择的化疗方案多含有细胞毒性药物,如DA 方案(柔红霉素联合阿糖胞苷)、DAE 方案(柔红霉素、阿糖胞苷联合依托泊苷) 等,治疗效果并不理想,CR 率不足15%,1 年OS 率不足10%[11-12],且不良反应较多,常造成严重的骨髓抑制,增加患儿感染风险。近年来,随着表观遗传学的兴起,地西他滨和西达本胺等药物纷纷研制上市。地西他滨是一种胞嘧啶核苷类似物,其代谢物能够在S 期与DNA 结合,抑制DNA 甲基转移酶,从而干扰DNA 的合成,抑制细胞增殖,诱导肿瘤向正常细胞分化,并可促进细胞凋亡[13-14]。西达本胺属于组蛋白去乙酰化物酶抑制剂(histone deacetylase inhibitors,HDACi),其通过靶向抑制相关HDAC 亚型来阻断HDAC 的去乙酰化作用,而后作用于RAS-RAF-MAPK、JAK2/STAT3 等信号通路,进而抑制肿瘤细胞周期、诱导肿瘤细胞凋亡[15]。西达本胺还可通过增加Caspase-8 的表达来提高细胞对化疗药物的敏感性,或通过诱导、增强自然杀伤细胞和抗原特异性细胞毒T 细胞介导的肿瘤杀伤作用来调节机体的细胞免疫[16-17]。研究发现地西他滨及西达本胺与细胞毒性药物(如阿糖胞苷等) 联合应用于AML 患者,可有效减少患者的肿瘤负荷[18-19]。聚乙二醇化重组人粒细胞集落刺激因子 (pegylated recombinant human granulocyte colony stimulating factor,PEG-rhGCSF)是一种长效粒细胞刺激因子,PEG-rhGCSF 在肿瘤患者血浆中的半衰期较长,可达47 h,单次给药后即可升高中性粒细胞绝对值,且维持时间较多次应用rhG-CSF 更长,升高白细胞作用平稳[20],其作用机制为通过动员肿瘤细胞进入增殖期,从而增强化疗药物对肿瘤细胞的杀伤作用[21]。PEG-rhG-CSF 在中性粒细胞缺乏伴发热发生率、Ⅲ/Ⅳ度粒细胞缺乏发生率、Ⅳ度粒细胞缺乏持续时间、感染发生情况及住院时间方面与rhGCSF 相比,差异均无统计学意义[22]。鉴于PEGrhG-CSF 每个化疗周期一般只需用药1 次,可减少患者痛苦,提高患者依从性,因此更适用于儿童患者。
本研究报道了3 例AML 患儿,均伴有不同程度的感染,2 例患儿入院时已有感染,另1 例患儿在应用DAE 方案后出现感染,且2 例应用DAE 方案的患儿骨髓抑制期较长,出现了严重的中性粒细胞缺乏伴发热。鉴于患儿出现了感染且有严重的骨髓抑制等不良反应,第2 疗程调整治疗方案为地西他滨、西达本胺、阿糖胞苷,并在用药第1 天给予患儿长效粒细胞刺激因子升白治疗,用药后患儿骨髓抑制程度、时间以及胃肠道不良反应均较应用DAE 方案时减轻,2 例患儿肺部感染均已治愈。另1 例患儿第1 疗程即给予CDCG 方案,在应用抗感染药物的同时,感染得到了有效的控制。本研究所报道的3 例病例均为新发病例,应用CDCG 方案后的CR/CRi 率达到了100%。且患儿应用CDCG 方案时的粒细胞缺乏时间、发热时长及输血量均明显小于DAE 方案(表5)。

表5 既往文献中5 例儿童采用CDCAG 方案化疗的预后及转归Tab.5 Prognosis and outcome of previously reported 5 children treated with CDCAG regimen
综合国内外文献,应用CDCAG 方案治疗AML 的患儿病例仅5 例,因应用该方案的病例均为复发或耐药AML,故接受该方案治疗的患儿及成人病例约半数获得了CR/CRi。该方案的严重不良事件为肺炎、脑出血及脓毒症,3/4 级不良反应中发生率较高的仍为感染和胃肠道反应,其次为电解质紊乱及中性粒细胞缺乏伴发热。柴丽娜等[21]既往报道过1 例应用地西他滨+改良CAG 方案(阿柔比星+阿糖胞苷+聚乙二醇化重组人粒细胞集落刺激因子)的儿童病例,患儿入院时无感染,应用该方案后出现Ⅳ度骨髓抑制的持续时间为20 d,无感染、出血,无胃肠道、心脏、肝脏、肾脏等脏器损害,骨髓达到CR。阿柔比星不良反应为骨髓抑制,本报道中3 例病例应用CDCG 方案前均合并严重感染,故调整既往用药方案,将阿柔比星替换为西达本胺,3 例患儿感染均得到有效控制,评估骨髓状态均为CR/CRi,因未应用阿霉素类细胞毒性药物,其胃肠道不良事件发生率为0。
鉴于该研究报道的3 例病例,应用以西达本胺联合地西他滨为主的诱导化疗方案(CDCG 方案)治疗伴感染儿童AML 后均达到形态学CR,不良事件主要为骨髓抑制或感染,无其他不良事件,考虑该方案或许可成为伴感染儿童AML 治疗方案的一种选择,但仍需多中心大样本的研究。

