基于TCGA分析ABRACL在食管癌组织中的表达及机制
曹莎莎,段丽娟,周福有
(安阳市肿瘤医院/河南科技大学第四附属医院 a.中心实验室;b.胸外科,河南 安阳 455000)
食管癌是消化道常见的恶性肿瘤之一,其发病率和病死率分别居全世界恶性肿瘤的第8位和第6位[1]。由于早期诊断率低,确诊时多数患者已经发生了癌细胞转移,食管癌患者的5 a生存率低于20%[2-3]。因此,寻找与食管癌临床特征和预后相关的生物标志物,探究食管癌的发病机制,对食管癌的早期诊断、开发新的治疗靶点、延长患者生存期具有重要意义。ABRACL蛋白,又称HSPC280蛋白,位于人类染色体6p24.1上,长14 kb,编码81个氨基酸,其保守的疏水槽可以与其他蛋白相互作用来增加肌动蛋白动力和细胞活动性[4-5]。研究表明,ABRACL在乳腺癌[6]、子宫内膜癌[7]、胃癌[8]中的表达水平均升高。目前还未有报道研究ABRACL在食管癌中的表达情况及意义。本研究通过下载TCGA数据库信息,分析ABRACL在食管癌中的表达及其与预后的关系,同时采用实时荧光定量PCR(real-time quantitative polymerase chain reaction,RT-qPCR)检测并比较22对食管鳞癌组织和对应癌旁组织中ABRACL的表达水平,以期为食管癌的早期诊断和治疗提供新的分子标志物。
1 资料与方法
1.1 TCGA和GEO原始数据下载及分析通过TCGA和GEO官方数据库网站下载食管癌的基因表达数据及相应临床信息。包括食管癌组织样本164例和正常食管组织样本1 032例。对原始数据进行标准化处理,然后通过基因作图进行注释和筛选。TCGA和GEO数据分析方法分别基于R软件的edgeR包和limma包进行表达差异分析。TCGA数据库中依据ABRACL基因的中位表达水平(84)将食管癌患者分为低表达组(≤84)和高表达组(>84),其中低表达组81例,高表达组80例。
1.2 组织样本选取2016年6月至2017年6月于安阳市肿瘤医院/河南科技大学第四附属医院胸外科接受食管癌根治术的22例患者作为研究对象,其中男13例,女9例,年龄56~80岁,中位年龄67岁。患者通过病理检查确诊且术前均未接受放化疗或其他免疫治疗。手术中切取癌组织和距癌组织肿块边缘大于5 cm的癌旁组织标本分别作为实验组和对照组。组织离体后立即置于液氮中保存备用。
1.3 RT-qPCR验证对提取的总RNA进行反转录获得cDNA,采用SYBR Green法进行RT-qPCR验证,以actin为内参基因。RT-qPCR反应体系为20 μL,包括:20×SYBR Green 0.3 μL、10×PCR Buffer 2 μL、10 μmol·L-1正向引物和反向引物各0.5 μL、10 mmol·L-1dNTPs 0.5 μL、1 μL反转录产物、5 U·μL-1的DNA聚合酶0.2 μL 。反应条件为:预变性95 ℃ 60 s,95 ℃ 5 s,60 ℃ 40 s,共40个循环,通过扩增曲线判断PCR的扩增效率,通过溶解曲线检测PCR产物的特异性。RT-qPCR检测中每孔均设3个复孔,取平均Ct值作为该样本的最终Ct值。actin作为内参基因,以2-ΔΔCt值作为ABRACL的相对表达水平。
1.4 基因集富集分析采用GSEA软件进行分析,利用GSEA网站MsigDB数据库获得gmt数据集,按缺省加权富集统计的方法进行富集分析,设置随机组合次数为1 000次。以ABRACL的表达水平作为表型标记。利用P值和标准化富集评分对每个表型的富集途径进行排序。
1.5 调控ABRACL表达的上游miRNA预测采用Targetscan、miRDB、miRMap和miTarBase 4种线上工具分析ABRACL的上游miRNA。为了提高预测的准确性,把以上4种工具分析出来的miRNA绘制韦恩图以便清晰观察交叉miRNA。
1.6 统计学方法运用R软件分析数据。利用survival工具包进行生存分析,采用Kaplan-Meier法分析ABRACL表达水平与生存期的关系。运用Cox比例风险回归模型分析影响患者预后的危险因素,计算风险比及其95%置信区间。使用SPSS 23.0统计软件分析数据,使用Student双尾t检验进行两组组织RT-qPCR之间的差异比较。P<0.05为差异有统计学意义。
2 结果
2.1 ABRACL在食管癌中的表达TCGA数据显示ABRACLmRNA在164例食管癌组织中的表达水平高于1 032例正常食管组织(P<0.05),见图1A。GEO数据显示GSE100942_GPL570中ABRACLmRNA在食管癌组织中的表达水平高于正常食管组织(P<0.05),而GSE75241_GPL5175和GSE92396_GPL6244中食管癌组织和正常食管组织中的ABRACLmRNA表达差异无统计学意义(P>0.05)。见图1B。

A为TCGA数据集;B为GEO数据集。
2.2 ABRACL在食管癌组织中表达水平升高对22例患者组织样本进行RT-qPCR验证,结果显示癌组织中ABRACL表达水平高于癌旁组织(P<0.05),与数据库分析结果一致。见图2。
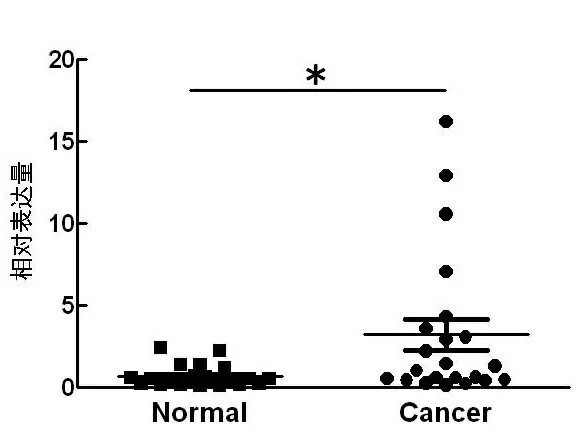
图2 RT-qPCR检测组织ABRACL的表达水平
2.3 单因素回归分析结果TCGA数据库临床信息单因素Cox回归分析结果显示N分期、M分期、淋巴结数目和ABRACL均可以作为食管癌潜在的预后因素(P<0.05)。见图3。

图3 食管癌患者单因素Cox回归分析结果
2.4 Kaplan-Meier生存分析生存分析结果显示,ABRACL表达水平与食管癌患者的总生存期相关(P<0.05),其表达水平越高,总生存期越短,预后越差。见图4。

图4 ABRACL低表达和高表达食管癌患者总生存分析
2.5 ABRACL的功能基因集富集分析ABRACL高表达样本主要富集在三羧酸循环和呼吸电子传送通路、剪接体通路、呼吸电子传送、mRNA剪切、PCP蛋白不对称定位、前复制混合物组装通路。见图5。
2.6 ABRACL的上游miRNA调控和基因拷贝数变异情况采用Targetscan、miRDB、miRMap和miTarBase在线分析工具分析上游调控miRNA,得出的miRNA交集有3个,分别为hsa-miR-1200、hsa-miR-145-5p和hsa-miR-4324,见图5A。对ABRACL基因拷贝数与基因表达情况进行分析,结果显示ABRACL基因杂合状态下表达量最低,见图5B。
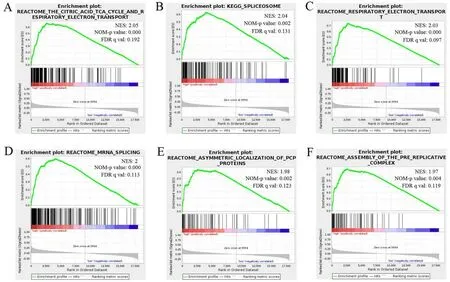
A为三羧酸循环和呼吸电子传送通路;B为剪接体通路;C为呼吸电子传送通路;D为mRNA剪切通路;E为PCP蛋白不对称定位通路;F为前复制混合物组装通路。标准化富集评分为标准化的富集分数;NOM-p value为标准化的P值;FDR q val为错误发现率q值。

A.Targetscan、miRDB、miRMap和miTarBase 4种软件分析调控ABRACL的miRNA检索情况韦恩图;B.ABRACL基因拷贝数变异与其表达情况图。
3 讨论
食管癌是恶性程度较高的消化道肿瘤之一。由于早期症状隐匿,不易被发现,且缺乏特异性分子诊断标志物,绝大多数患者确诊时已处于中晚期,错过了最佳的手术治疗时机,预后较差。HSPC280蛋白是从胎儿肝和CD34+干细胞中克隆的C6ORF115基因编码的一个蛋白[9]。Wang等[8]对GEO和TCGA数据平台上下载的临床样本数据进行分析,发现ABRACL在胃癌组织中的表达明显增高,且高表达患者的预后差,总生存期短,且发生远处转移。本研究通过TCGA和GEO数据挖掘,发现ABRACLmRNA表达水平在食管癌中明显上升,22例食管癌组织和对应癌旁组织RT-qPCR结果显示癌组织中的ABRACL表达水平高于癌旁组织,与数据库分析结果一致。同时对TCGA数据进行Kaplan-Meier生存分析,发现ABRACL表达和食管癌患者预后生存之间存在明显相关性,ABRACL高表达患者总生存期短且预后差,表明ABRACL可能为潜在的食管癌预后标志物。对下载的临床样本数据进行单因素回归分析,结果显示N分期、M分期、淋巴结数目和ABRACL均为食管癌潜在的预后因素。
进一步通过GSEA探究ABRACL表达增高时参与食管癌发生发展的机制。结果表明,ABRACL高表达的食管癌样本主要富集在三羧酸循环呼吸电子传送通路、剪接体通路、呼吸电子传送、mRNA剪切、PCP蛋白不对称定位、前复制混合物组装通路等相关基因集上。
肿瘤发生经常伴随着RNA剪接异常。越来越多证据表明,异常剪接参与了肿瘤细胞的增殖[10]、凋亡[11]、上皮间质转化[12]及侵袭转移[13-14]。本研究GSEA分析结果显示,ABRACL表达增高的癌组织中富集通路有剪接体通路和mRNA剪切通路与患者预后差密切相关,与TCGA临床数据分析结果一致。
人类基因组上广泛存在着多种遗传变异形式与DNA多态性[15]。目前有很多文章报道了基因拷贝数变异与食管癌发生的相关性[16-17]。本研究通过ABRACL基因拷贝数变异分析,发现ABRACL基因杂合状态下表达量最低。
本研究分析和检测了ABRACL在食管癌中的表达情况,其高表达预示患者总生存期短,预后差,且单因素回归分析显示N分期、M分期、淋巴结数目和ABRACL均可以作为食管癌潜在的预后因素。ABRACL可作为评估食管癌患者预后的生物标志物。

