格列美脲联合门冬胰岛素对妊娠期糖尿病患者胰岛素抵抗及胰岛细胞分泌功能的影响
张晓娜,王煜,苏青
西安市第四医院妇产科,陕西 西安 710021
妊娠期糖尿病(gestational diabetes mellitus,GDM)是女性妊娠前无糖尿病或糖耐量异常而妊娠期首次出现糖代谢异常的妊娠期常见并发症,在妊娠女性中发病率约4%,若未得到及时有效的治疗则可增加母婴不良结局风险[1-2]。目前GDM确诊后主要通过饮食控制、运动疗法控制血糖水平,针对上述方法无法控制理想血糖水平的患者再考虑进行药物治疗。药物治疗中,门冬胰岛素不会对胎儿造成不良影响,是我国食药监局批准的妊娠期唯一可应用的胰岛素类似物[3],但近年研究指出该药治疗过程中患者会因胰岛素抵抗、胰岛素敏感性降低、胰岛细胞分泌功能降低的改善效果不佳而使疗效变差[4]。而磺酰脲类药物降糖药格列美脲能够刺激胰岛β细胞释放胰岛素,增加细胞膜上胰岛素受体数量和胰岛素敏感性与利用率,改善胰岛素抵抗和胰岛细胞分泌功能[5-6]。基于此,本研究分析了格列美脲联合门冬胰岛素对GDM患者胰岛素抵抗及胰岛细胞分泌功能的影响,现报道如下:
1 资料与方法
1.1 一般资料 回顾性分析西安市第四医院2016 年12 月至2019 年12 收治 的110 例GDM 患者的临床资料。纳入标准:符合《妊娠合并糖尿病诊治指南(2014)》[7]中的GDM 诊断标准;年龄20~40 岁;单胎妊娠;于我院妇产科建档进行定期产检;单纯饮食控制、运动疗法控制血糖效果不佳,需用药治疗;于我院分娩,临床资料完整,获得妊娠结局。排除标准:孕前存在糖尿病;合并妊娠期高血压;合并重要器官严重疾病;合并急慢性感染性疾病;对研究用药过敏;有精神疾病史。根据患者治疗方案的不同分组,其中62例选择门冬胰岛素治疗者纳入对照组,48例选择格列美脲联合门冬胰岛素治疗者纳入研究组。两组患者的一般资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。本研究经医院伦理委员会批准。
表1 两组患者的一般资料比较()
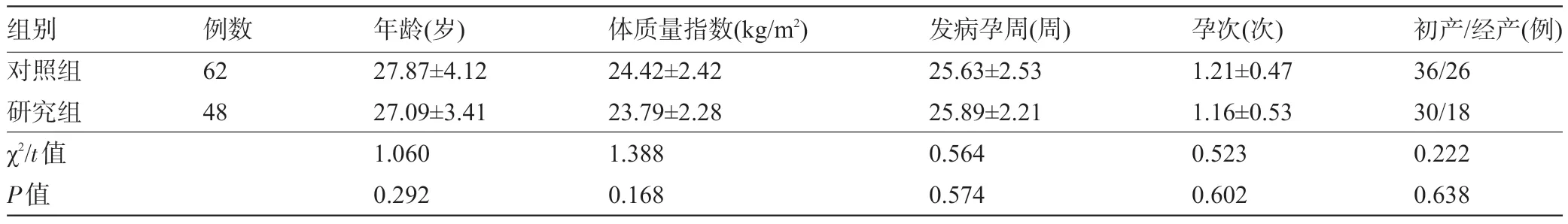
表1 两组患者的一般资料比较()
1.2 治疗方法 两组患者均给予常规健康教育,并保持饮食控制和运动疗法。在此基础上,对照组患者给予门冬胰岛素注射液(丹麦诺和诺德公司,国药准字J20150073,3 mL:300 U)皮下注射,初始剂量0.2~0.3 U/(kg·d),每日晚餐前注射1次,根据患者血糖水平每3 d 调整1 次用量,每次调整2~4 U。研究组患者在对照组基础上加服格列美脲(Sanofi-Aventis Deutschland GmbH,注册证号H20160505,2 mg),每日早餐前30 min口服2 mg/次,根据血糖水平调整用量,单日用药量<8 mg。患者持续治疗至分娩前。
1.3 观察指标与评价(检测)方法 (1)血糖水平:治疗前及分娩前均采集患者3 mL 血液标本,应用全自动生化分析仪检测患者空腹血糖、餐后2 h 血糖、糖化血红蛋白水平;(2)血糖达标时间和胰岛素用量:统计患者用药治疗后血糖达标的时间及分娩前平均胰岛素每天用量;(3)胰岛素抵抗和胰岛细胞分泌功能:治疗前及分娩前采用稳态模型评估法计算胰岛素抵抗指数(homeostasis modelassessmentinsulin resistance,HOMA-IR),胰岛素分泌指数(homeostasis model assessment insulin resistanceβ,HOMA-β)、胰岛素敏感指数(insulin sensitivity index,ISI);HOMA-IR=空腹血糖×空腹胰岛素/22.5,HOMA-β=空腹胰岛素×20/(空腹血糖-3.5),ISI=Ln[1/(空腹血糖×空腹胰岛素)];(4)不良母婴结局:统计母婴不良结局情况。
1.4 统计学方法 应用SPSS22.0统计软件分析数据。计量资料符合正态分布,以均数±标准差(x-±s)表示,组内比较采用配对样本t检验,组间比较采用独立样本t检验;计数资料比较采用χ2检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 两组患者治疗前与分娩前的血糖水平比较 治疗前,两组患者的空腹血糖、餐后2 h 血糖、糖化血红蛋白水平比较差异均无统计学意义(P>0.05);分娩前,两组患者的空腹血糖、餐后2 h 血糖及糖化血红蛋白水平较治疗前均降低,且研究组明显低于对照组,差异均有统计学意义(P<0.05),见表2。
表2 两组患者治疗前与分娩前的血糖水平比较()
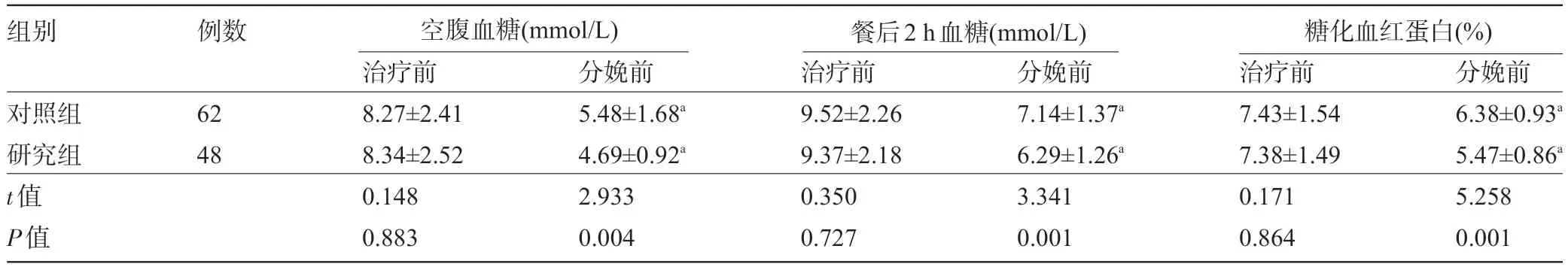
表2 两组患者治疗前与分娩前的血糖水平比较()
注:与本组治疗前比较,aP<0.05。
2.2 两组患者的血糖达标时间和胰岛素用量比较 研究组患者的血糖达标时间明显较对照组短,胰岛素用量明显少于对照组,差异均有统计学意义(P<0.05),见表3。
表3 两组患者的血糖达标时间和胰岛素用量比较()
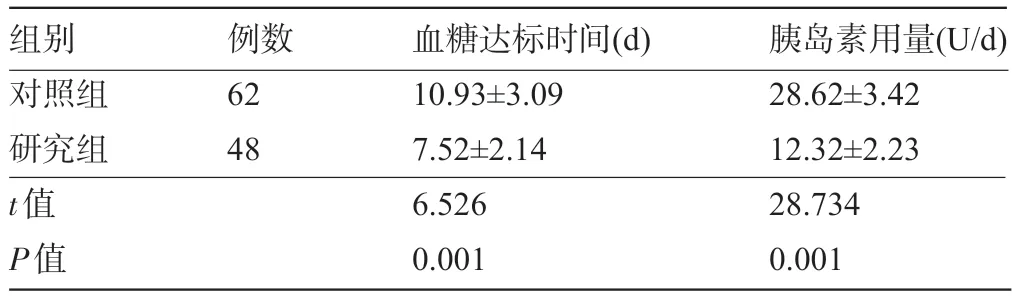
表3 两组患者的血糖达标时间和胰岛素用量比较()
2.3 两组患者治疗前与分娩前的胰岛素抵抗和胰岛细胞分泌功能指标比较 治疗前,两组患者的HOMA-IR、ISI、HOMA-β水平比较差异均无统计学意义(P>0.05);分娩前,两组患者的HOMA-IR 水平较治疗前均降低,ISI、HOMA-β水平较治疗前均升高,且研究组分娩前的HOMA-IR 水平明显低于对照组,ISI、HOMA-β水平明显高于对照组,差异均有统计学意义(P<0.05),见表4。
表4 两组患者治疗前与分娩前的胰岛素抵抗和胰岛细胞分泌功能指标比较()
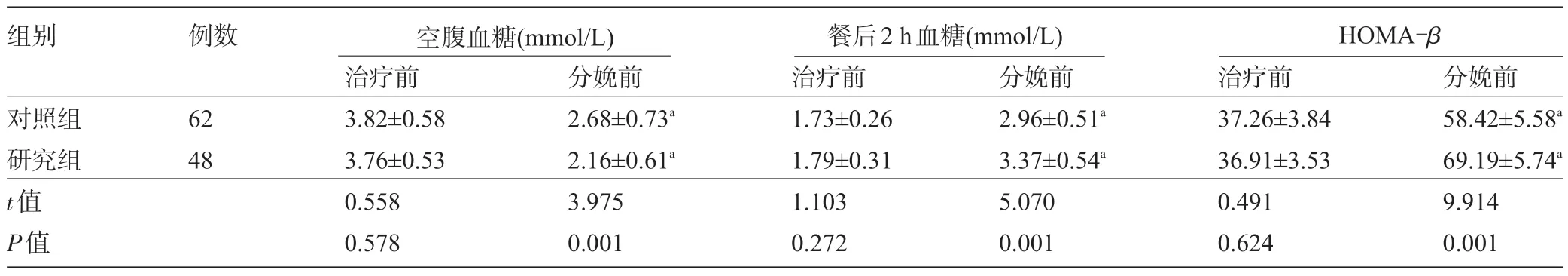
表4 两组患者治疗前与分娩前的胰岛素抵抗和胰岛细胞分泌功能指标比较()
注:与本组治疗前比较,aP<0.05。
2.4 两组患者的母婴不良结局比较 研究组和对照组患者的产科并发症及新生儿不良结局发生率比较差异均无统计学意义(P>0.05),见表5。
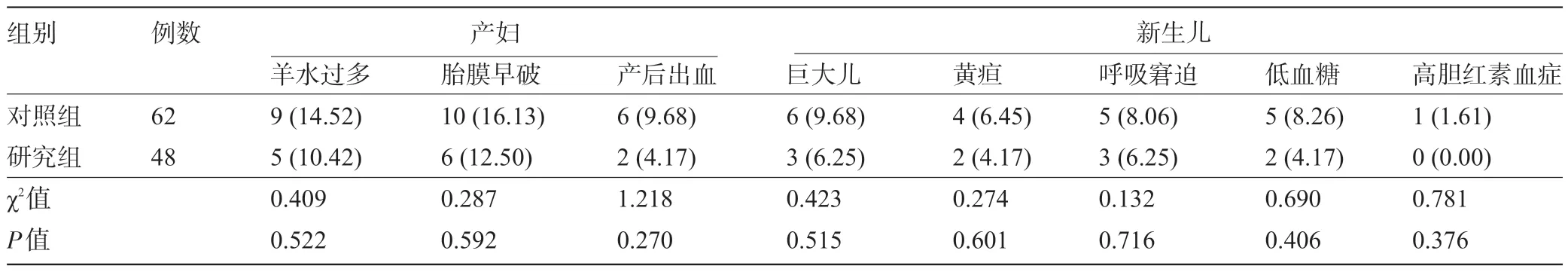
表5 两组患者的母婴不良结局比较[例(%)]
3 讨论
GDM 病因复杂,尚无定论,GDM 患者中35%~60%远期会发展为2 型糖尿病,多数学者认为其发病机制与2型糖尿病相似,可能与胰岛素抵抗、胰岛细胞功能缺陷、遗传等因素有关,主要病理机制是胰岛素抵抗导致高胰岛素和(或)胰岛β细胞功能障碍[8-9]。GDM 治疗首选饮食、运动干预,而饮食、运动干预效果不佳的患者则需要接受药物治疗,药物治疗首选门冬胰岛素治疗,但仍有部分患者单纯应用胰岛素治疗血糖控制效果不佳[10]。在2型糖尿病单纯胰岛素降糖效果不佳时可联合应用口服降糖药治疗,但孕妇作为特殊群体,其联合应用胰岛素和口服降糖药治疗仍存在争议,目前美国母胎医学学会基于现有证据指出,基于营养运动干预仍无法控制血糖水平的GDM患者应用部分口服降糖药治疗是合理、安全的,但近一半患者仍需胰岛素协助降糖,且口服降糖药的远期安全性仍需进一步证据证实[11-12]。口服降糖药联合胰岛素治疗GDM 的有效性及安全性是目前GDM 临床研究的热点之一。
GDM 治疗常用口服降糖药主要为双胍类和磺脲类药物,其中格列美脲是第3代口服磺脲类药物,能够与胰岛β细胞表面的磺酰脲受体结合,引起钾离子通道关闭、电压依赖性钙通道开放,使钙离子内流,刺激胰岛β细胞分泌胰岛素,降低血糖[13],同时通过减慢肝脏对于胰岛素的清除、增加周围组织对胰岛素的敏感性也可发挥降糖作用,还可通过非胰岛素依赖的途径增加心脏葡萄糖的摄取[14],其降糖效果优于长效胰岛素,且相较于2 代口服磺脲类药物格列本脲降糖效果更好、安全性更高[15]。目前已有研究证实格列本脲联合胰岛素治疗GDM 可增强降糖效果,且用药安全[16],但关于格列美脲联合胰岛素治疗的糖尿病主要为2型糖尿病而尚无GDM 治疗研究。基于此,本研究分析格列美脲联合门冬胰岛素治疗GDM 的疗效,结果显示,研究组患者加用格列美脲后,其各项血糖指标水平较应用门冬胰岛素的对照组患者降低更为明显,血糖达标时间更短、胰岛素用量更少,说明GDM患者以格列美脲联合门冬胰岛素治疗降糖效果显著,可加快血糖控制效率并减少胰岛素用量。此外,胰岛素抵抗、胰岛β细胞功能的失代偿导致血糖代谢紊乱是糖尿病发生、发展的根本原因,分析GDM患者胰岛素抵抗和胰岛细胞分泌功能有助于评估降糖效果,目前临床主要应用稳态模型公式计算HOMA-IR、ISI 及HOMA-β评估胰岛素抵抗和胰岛细胞功能[17],而本研究显示,研究组患者患者HOMA-IR、ISI 及HOMA-β水平改善均优于对照组,说明格列美脲联合门冬胰岛素治疗有利于进一步改善GDM患者胰岛素抵抗和胰岛细胞分泌功能,改善胰岛素抵抗和胰岛细胞分泌功能是格列美脲的降糖的主要作用机制,可与门冬胰岛素发挥协同增效作用增强降糖效果。目前口服降糖药的用药安全性及对母婴结局的影响是其用于GDM治疗中的研究的热点,且尚存在争议[18],而本研究分析两组患者母婴不良结局显示,研究组患者产科并发症及新生儿不良结局发生率与对照组并无显著差异,说明GDM患者应用格列美脲联合门冬胰岛素治疗并未增加母婴不良结局风险。
综上所述,格列美脲联合门冬胰岛素治疗GDM降糖效果显著,有助于减轻患者胰岛素抵抗、提高胰岛细胞分泌功能,用药安全。

