2型糖尿病患者EGR1、UACR及CMI指数与非酒精性脂肪性肝病的关系
金婷,曹含弘,张斌,朱薇珊
复旦大学附属中山医院青浦分院感染科1、内分泌科2,上海 201700
2 型糖尿病(type 2 diabetes mellitus,T2DM)作为一种代谢相关性疾病,引起的体内高血糖环境会导致微血管、神经、大血管等发生病变,从而对全身多处器官产生危害[1]。肝脏是机体各个代谢活动的场所,与T2DM的发生、发展关系密切。既往报道显示,T2DM患者非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)发生率明显高于普通若人群,并且T2DM、NAFLD 共存易形成恶性循环,不仅加重肝脏和外周胰岛素抵抗,而且可增加T2DM并发症发生风险[2]。因此,临床需尽早对T2DM患者发生NAFLD进行预测、筛查,以便及时采取针对性措施预防或减少T2DM合并NAFLD的发生。报道显示,早期生长反应因子1 (early growth response factor 1,EGR1)、微量白蛋白与尿肌酐比值(urinary albumin to creatinine ratio,UACR)、心脏代谢指数(cardiometabolic index,CMI)与T2DM 患者NAFLD 的发生关系密切[3-5],但目前关于这三者与NAFLD 不同程度关系的报道较少,对NAFLD 预测价值的报道更少。基于此,本研究对单纯T2DM 和T2DM 合并NAFLD 患者EGR1、UACR、CMI 水平进行分析,旨在探究其与NAFLD 严重程度的关系及对NAFLD的诊断价值,现报道如下:
1 资料与方法
1.1 一般资料 回顾性分析2019年1月至2021年1月复旦大学附属中山医院青浦分院收治的106例T2DM 患者的临床资料,根据是否发生NAFLD 分为NAFLD 组(72 例)和无NAFLD 组(34 例)。NAFLD 组患者根据病情严重程度分为轻度组(28 例)、中度组(23例)和重度组(21例)。纳入标准:(1)符合《中国2型糖尿病防治指南(2017 年版)》[6]中T2DM 诊断标准,经实验室检查确诊;(2)NAFLD符合《非酒精性脂肪性肝病诊疗指南(2018 年1 月修订版)》[7]中NAFLD 诊断标准,并经肝脏超声检查确诊;(3)自愿参与研究,签署《知情同意书》;(4)均进行EGR1、UACR 及CMI 检查;(5)病历资料完整。排除标准:(1)1型糖尿病或妊娠糖尿病者;(2)合并酒精性肝病或病毒性肝炎、药物性肝炎等其他肝病者;(3)哺乳或妊娠期妇女;(4)合并恶性肿瘤或严重肝肾功能障碍者;(5)自身免疫性疾病者;(6)酮酸中毒或神经病变者;(7)合并冠心病者。本研究经医院伦理委员会批准。
1.2 观察指标 (1)一般资料:收集患者的性别、年龄、糖尿病病程、体质量指数(BMI)、血红蛋白、空腹血糖(FPG)、三酰甘油(TG)、总胆固醇(TC)、胰岛素抵抗指数(HOMA-IR)等资料。(2)EGR1:检测方法为采集入院次日清晨,抽取患者禁食8~10 h 空腹静脉血,不抗凝加速离心后取血清标本,应用酶联免疫分析法(enzyme-linked immunosorbent assay,ELISA)进行检测。(3)UACR:检测方法为采集当日6 时至次日6 时尿,取当日10时、15时、19时、23时及次日晨尿2 mL作为随机尿标本,采用免疫比浊法检测尿微量白蛋白水平,采用苦味酸法检测尿肌酐水平,检测仪器为日立7600全自动生化仪及配套试剂,计算尿微量白蛋白与尿肌酐比值。(4)CMI:计算公式为TG(mmol/L)/高密度脂蛋白胆固醇(mmol/L)×腰高比,腰高比=腰围/身高。
1.3 诊断标准 NAFLD 影像学诊断包括5 项,符合第1项和2~4项中的任意1项为轻度,符合第1项和2~4项中的任意2项为中度,符合第1、5项和2~4项中的任意一项为重度,5项内容如下:(1)肝区远场回声逐渐衰减,光点稀疏,近场则为回声弥漫性点状增强;(2)肝内彩色血流信号不易显示,但肝内管道走向未见异常;(3)肝脏边缘圆钝,伴轻~中度肿大;(4)肝内管道结构显示不清;(5)肝右叶包膜或横膈回声模糊或不完整。
1.4 统计学方法 采用SPSS22.0统计软件处理数据,符合正态分布的计量资料用(x-±s)表示,两组间比较采用独立样本t检验,两组以上比较采用单因素方差分析,两两比较采用SNK 检验;非正态计量资料用中位数(四分位间距)表示,采用非参数检验,两组间比较采用Mann-WhineyU检验,两组以上比较采用Kruskal-WallisH检验;计数资料采用χ2检验;EGR1、UACR及CMI与NAFLD程度的关系采用Spearman相关性分析;预测价值分析采用受试者工作特征(receiver operator characteristic curve,ROC)曲线评估,曲线下面积(area under curve,AUC)>0.9为预测价值较高,0.7~0.9为有一定预测价值。以P<0.05为差异有统计学意义。
2 结果
2.1 无NAFLD组和NAFLD组患者的一般资料比较 无NAFLD组和NAFLD组患者的性别、年龄比较差异均无统计学意义(P>0.05),但病程、BMI、FPG、TG、TC、HOMA-IR比较差异均有统计学意义(P<0.05),见表1。
表1 无NAFLD组和NAFLD组患者的一般资料比较()

表1 无NAFLD组和NAFLD组患者的一般资料比较()
2.2 无NAFLD 组和NAFLD 组患者的EGR1、UACR 及CMI 水平比较 NAFLD 组患者的EGR1、UACR 及CMI 水平明显高于无NAFLD 组,差异均有统计学意义(P<0.05),见表2。

表2 无NAFLD组和NAFLD组患者的EGR1、UACR及CMI水平比较
2.3 不同NAFLD 程度患者的EGR1、UACR 及CMI 水平比较 不同NAFLD 程度T2DM 患者的EGR1、UACR及CMI比较差异有统计学意义(P<0.05),且重度组高于中度组,中度组高于轻度组,差异均有统计学意义(P<0.05),见表3。

表3 不同NAFLD程度患者的EGR1、UACR及CMI水平比较
2.4 EGR1、UACR 及CMI 与NAFLD 程度的关系 经Spearman相关性分析结果显示,EGR1、UACR及CMI与NAFLD程度呈正相关(r>0,P<0.05),见表4和图1。

表4 EGR1、UACR及CMI与NAFLD程度的关系

图1 EGR1、UACR及CMI与NAFLD程度的关系
2.5 EGR1、UACR 及CMI 对NAFLD的预测价值 ROC 曲线分析结果显示,EGR1、UACR、CMI早期预测NAFLD 的AUC分别为0.972、0.831、0.815,Z检验AUC 差异显示,EGR1 的AUC 显著高于UACR、CMI (Z=3.482、3.7058,P<0.05),而UACR与CMI 的AUC 比较,差异无统计学意义(Z=0.290,P=0.772>0.05)。且以EGR1>1.83 ng/mL 为临界值,预测NAFLD 的敏感度为95.8%,特异度为91.2%;以UACR>32.02 mg/g 为临界值,预测NAFLD 的敏感度为62.5%,特异度为97.1%;以CMI>1.58 为临界值,预测NAFLD 的敏感度为63.9%,特异度为97.1%。见表5 和图2。

图2 EGR1、UACR及CMI预测NAFLD的ROC曲线图
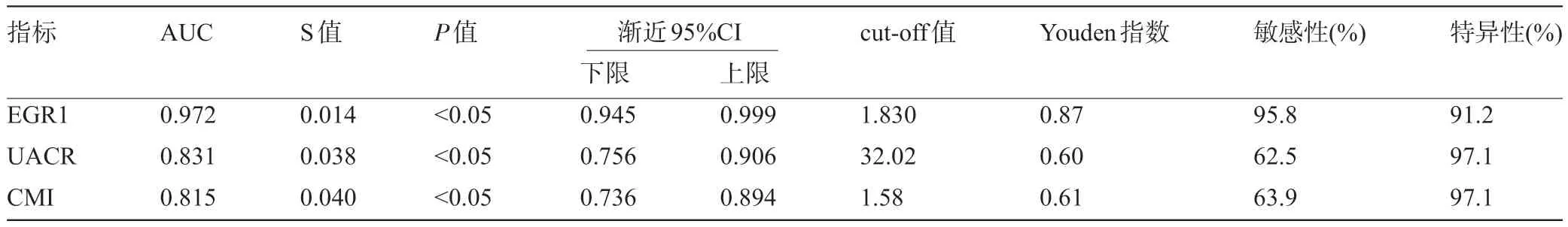
表5 EGR1、UACR及CMI对NAFLD的预测价值
3 讨论
NAFLD是一种与胰岛素抵抗(insulin resistant,IR)关系密切的代谢应激性肝损伤,T2DM 为其发生的主要危险因素之一。NAFLD 危害较大,可导致肝细胞变性、坏死,造成脂肪性肝炎,甚至是肝硬化、肝癌,同时肝细胞脂肪堆积还会削弱糖脂代谢、解毒能力,加重T2DM 疾病进展。刘林杰等[8]分析1 259 例T2DM资料显示,T2DM 患者NAFLD 患病率达61.48%,且随着糖尿病病程、年龄的增加,患病率呈升高趋势。本研究中对106 例T2DM 患者资料进行分析显示,有72 例并发NAFLD,患病率为67.92%,与上述研究结果差别不大。提示在T2DM 患者中NAFLD 发生率较高,危害较大,临床应尽早预防,采取相应措施降低NAFLD 的发生风险。有研究显示,T2DM 并发NAFLD 与IR、血脂异常、腹型肥胖、微血管病变等有关,其中IR 为NAFLD 发生的始动因素,贯穿NAFLD的全程[9]。本研究结果显示,NAFLD 组病程、BMI、FPG、TG、TC、HOMA-IR 明显高于无NAFLD 组,说明这些因素都与NAFLD的发生关系密切,与张玉彩等[3]报道结果一致。肥胖、血脂异常、血糖异常等均与代谢紊乱有关,而代谢紊乱导致NAFLD 的发病机制仍不明确。多数学者认为,IR 是代谢紊乱引起NAFLD发生的重要因素,IR 可促进脂肪分解,血液中游离脂肪酸增加,从而导致肝内TG合成增多,脂质堆积。
EGR1为即刻早期基因家族的成员,与细胞增殖、分化和凋亡关系密切,以往关于EGR1 的研究多围绕癌症展开[10],但其在肝癌中的作用仍存在一定争议,有研究认为其在肝癌中表达下调,发挥抑癌基因作用[11],但也有研究认为其在肝癌中表达上调,发挥致癌基因作用[12]。李晓玲等[13]通过建立急性肝内胆汁淤积症大鼠模型分析显示,EGR1 在急性肝内胆汁淤积症大鼠中高表达,且通过服用复方茵丹汤可下调EGR1表达,达到治疗目的。本研究结果显示EGR1 在NAFLD 患者中水平升高,与NAFLD 程度呈正相关。进一步ROC 曲线分析显示,EGR1 早期预测NAFLD 的AUC为0.972,且以EGR1>1.83 ng/mL为临界值,预测NAFLD 的敏感度为95.8%,特异度为91.2%。说明EGR1 与T2DM 患者NAFLD 程度呈正相关,且对NAFLD 预测价值较高。可能原因为:高糖环境可抑制沉默信息调节因子1(silent information regulator 1,SIRT1)表达,促进EGRl 活化,诱导炎症反应加重,使肝细胞变性,从而增加非酒精性脂肪肝病发生风险。既往报道显示,T2DM 合并NAFLD 患者,往往也伴随一定程度的肾脏功能损害[14]。UACR 易收集,可准确预测24 h 尿蛋白排泄情况,对诊断、治疗与预后评估T2DM 早期肾损伤方面价值较高。本研究结果显示UACR 在NAFLD 患者中水平升高,与NAFLD 程度呈正相关,进一步ROC 曲线分析显示,UACR 早期预测NAFLD的AUC为0.831,且以UACR>32.02 mg/g为临界值,预测NAFLD 的敏感度为62.5%,特异度为97.1%。说明UACR 与T2DM 患者NAFLD 程度呈正相关,且对NAFLD 预测价值较高。IR、炎性介质、氧化应激反应可能是T2DM患者发生NAFLD和肾损伤的相关机制,IR 状态下,脂肪细胞可释放大量炎性介质,参与慢性内皮损伤和血管反应性改变,导致肾损伤[15];而NAFLD从单纯脂肪肝进展到脂肪性肝炎的过程中会导致活性氧、氧化应激反应等致病介质释放,损伤肾小球基底膜,增加通透性,从而导致UACR 水平升高;并且EGR1可激活NADPH氧化酶-4转录,促进氧化应激反应损伤肾脏。此外,本研究分析的CMI是由2015年被WAKABAYASHI等提出的一种新型指数,可同时兼顾腹型肥胖和血脂指标[16]。本研究结果显示CMI 在NAFLD 患者中水平升高,与CMI 程度呈正相关。进一步ROC 曲线分析显示,CMI 早期预测NAFLD的AUC为0.815,且以CMI>1.58 为临界值,预测NAFLD 的敏感度为63.9%,特异度为97.1%。说明CMI 与T2DM 患者NAFLD 程度呈正相关,且对CMI预测价值较高,与李彦彦等[5]报道结果一致。分析原因可能为IR可介导两者的联系,腹型肥胖患者往往糖脂氧化水平较高,游离脂肪酸释放过多会蓄积于肝脏;而IR 可诱导脂肪组织TG 的分解和肝内TG 合成,从而促进NAFLD的发生。
综上所述,EGR1、UACR、CMI 与NAFLD 程度呈正相关,且对T2DM 患者发生NAFLD 的预测价值较高,EGR1 相对而言预测价值最高。本研究仍有一定缺陷性,例如研究样本量较小可能会对结果造成一定影响,EGR1、UACR、CMI 在T2DM 合并NAFLD 中的作用机制未进行验证分析,仍有待后续研究。

