水系多价金属离子电池研究进展及挑战
卢锡洪,汪 晋,石 鑫
(中山大学 化学学院,生物无机与合成化学教育部重点实验室, 广州 510315)
伴随着煤炭、石油、天然气等化石能源的过度消耗,使用可再生新能源代替传统不可再生化石能源迫在眉睫。然而,可再生新能源,如风能、太阳能和潮汐能等,存在时间和空间上的分散性,难以直接汇入电网供电,导致大量的电能无法得到合理利用。为解决新能源的时空分散性,需要设计高性能的电化学储能器件来储存和汇集分散的电能,进行集中供电。
近年来,从小型电子设备到电动汽车[1]等,锂离子电池(LIB)被广泛用作电源器件。但是锂离子电池存在制造和使用成本高,金属锂储量低,使用有机溶液污染环境等问题。尤其是近年频发的锂离子电池爆炸事件,使人们对锂离子电池的安全性产生忧虑[2]。因此,有必要寻找成本低廉、环境友好、安全稳定的电化学储能器件来代替锂离子电池。基于水系电解液的多价金属离子电池,如水系锌离子电池和铝离子电池,就是潜在的选择之一。与锂电池相比,水系多价金属离子电池具有许多优势。水系电解液导电能力强,成本低,对环境污染小,并且安全稳定,因此水系多价金属离子电池是理想的储能器件。在电池反应过程中,一个多价金属离子可以传输多个电子的电量,有利于储存和释放更多能量[3-4],如图1所示,锌和铝储量大、使用成本低且具有较高的比容量。此外,锌和铝金属可以直接用作电池负极,相比于以碳材料为负极的锂离子电池,制备方法更简单,成本更低,有利于提高电池能量密度。因此多价金属离子电池更适合作为广泛使用的储能器件。
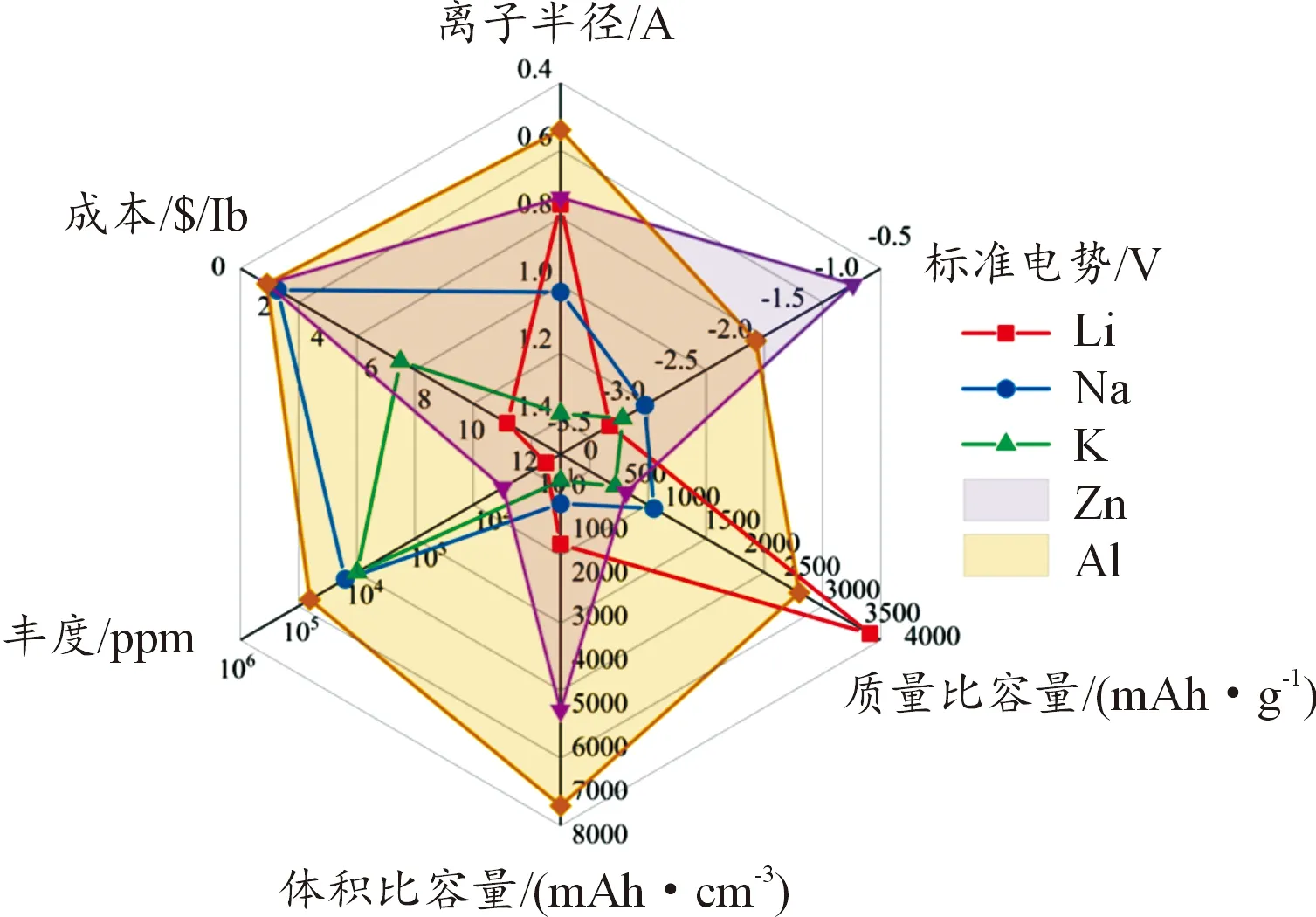
图1 多价金属与一价金属性能对比示意图
虽然多价金属离子电池具有很多优势,但由于研究起步晚,还存在许多待解决的问题。首先,由于多价金属离子带电量高,嵌入正极材料后易与宿主发生静电相互作用,破坏结构稳定性,因此,目前报道的多价金属离子嵌入型正极材料的倍率性能以及循环稳定性都不能令人满意。其次,金属负极会产生枝晶,枝晶的生长会刺穿隔膜,使电池短路报废,所以抑制枝晶的生长也是重点研究方向。
本文介绍了水系多价金属离子电池的研究进展,主要包括水系锌离子电池和铝离子电池电极材料的储能机制和电化学性能,分析了目前水系多价离子电池电极材料存在的问题,讨论了可能的解决策略。
1 水系锌离子电池概述
近年来,大量研究工作致力于发展高性能的锌金属电池,尤其是水系锌离子电池,归因于锌金属具有较高理论容量(820 mAh/g)与合适的还原电位(-0.76 V vs标准氢电极)[5]。与锂、钠、镁等碱金属和碱土金属相比,金属锌在水系溶液中相对稳定,且具有高导电性,因此是理想的水系二次电池负极。并且金属锌储量比锂大、易于制备、价格便宜、毒性小、性质稳定、不易燃烧[6]。
通常来说,水系锌离子电池由锌金属负极,能储存锌离子的正极材料以及中性到弱酸性的水系电解液组成。水系锌离子电池的正极材料通常为隧道结构或层状结构,锌离子能可逆地在正极材料中嵌入和脱出,也能在金属锌负极表面可逆地沉积和溶解[7]。充电时,锌离子从正极材料中脱出,在金属负极表面沉积;放电时,金属锌氧化溶解产生锌离子,嵌入正极材料中[5]。其储能机理见图2。

图2 水系锌离子电池储能机理示意图
1.1 水系锌离子电池负极材料
虽然金属锌负极具有很多优势,但是在实际使用中依然存在许多问题,如图3(a)所示。首先是枝晶的产生,由于导体的“尖端效应”,不平整的金属锌表面电荷分布不均匀,进而导致枝晶的生长。枝晶的持续生长最终会导致隔膜被刺穿,电池短路失效[4,8]。金属锌虽然相对稳定,但是不均一的锌表面区域之间存在电势差,进而形成许多微电池,加速了金属锌的腐蚀,这会降低库伦效率和比容量[9]。此外,锌的析氢腐蚀会产生氢气,使密封的电池鼓包,破坏封装结构;于此同时还会产生OH-,它与锌反应生成氧化锌或锌酸盐副产物,使金属锌表面钝化,减小电极的活性面积,增大极化,影响循环稳定性[10]。
因此,近年来许多研究工作致力于解决金属锌负极的枝晶、腐蚀和钝化问题,一些合成策略,包括对金属锌负极进行表面改性或优化锌电极结构,能一定程度上抑制枝晶的产生,减少腐蚀和副产物的生成[11-15]。
1.1.1金属锌负极的表面改性
对锌电极进行表面改性的目的是为了使锌离子更均匀地沉积在锌电极表面,抑制枝晶的生成,得到均匀的电沉积层。枝晶的生成是由于不平整的锌金属表面与电解液的不均匀接触造成的,因此,如果在锌金属表面构建一层多孔保护层,使电解液均匀渗透,则能抑制枝晶的生成[8]。同时锌负极不与电解液直接接触,减少了腐蚀和副反应的发生[9]。
导电碳材料被广泛应用于锌电极改性,石墨、乙炔黑、活性炭等添加剂都能一定程度上改善锌离子电池的循环稳定性[19]。Li等[20]混合锌粉和活性炭制备复合锌电极,当加入质量含量12%的活性炭时,锌离子电池的循环稳定性与未加入活性炭的电池相比有显著提升。Li等[21]在锌片上涂覆一层多孔碳材料,得到碳包覆的金属锌负极(Zn@C)。由于多孔碳薄层促进了电荷的均匀分布和锌的均匀沉积,金属锌负极(Zn@C)在2 A/g的电流密度下循环1 000次后,能保持65.2%的初始容量。
在锌片表面涂覆纳米多孔材料也是一种控制枝晶生长的有效策略,用纳米CaCO3涂覆锌片表面,得到纳米CaCO3薄膜,电解液均匀地渗透穿过薄膜与锌片接触,进而提高锌沉积的均匀性,抑制枝晶生长。这种表面包覆薄膜能提高锌负极的循环稳定性,纳米CaCO3涂覆的锌负极在0.25 mA/cm2下可稳定循环836 h[16]。
金属有机框架(MOFs)也可以用于锌负极的表面改性。 Liu等[22]通过简单水热法在锌负极原位合成了ZIF-8(zeolitic imidazolate framework-8)改性薄层。ZIF-8的绝缘特性及其纳米尺度的孔道,能使Zn2+均匀地沉积在电极电解液界面,并减少副反应的发生。由Zn@ZIF组装的对称电池循环稳定性良好,在2 mA/cm2下能稳定循环1 200 h,且无明显枝晶产生。此外,Liu等[23]用UIO-66(Universitetet i Oslo-66)和聚偏氟乙烯(PVDF)在锌片表面构建了亲水保护层,提高了锌片在水系电解液中的浸润性和稳定性,降低了锌离子沉积过电势。表面改性的锌电极能稳定充放循环500次。
聚酰胺(PA)是镀锌工艺中常用的光亮剂,可以改善锌镀层的均匀性。因此,PA有可能可以作为锌负极的表面保护层,抑制枝晶的产生。Zhao等[24]报道了聚酰胺-6包覆的锌负极。PA保护层与Zn2+配位,限制了Zn2+的扩散,有利于Zn的均匀沉积,且保护层将锌片与溶液及溶解氧隔开,进而抑制副反应的发生。利用Zn@PA负极组装的水系锌对称电池能在0.5 mA/cm2的电流密度下稳定循环超8 000 h。
1.1.2金属锌负极的结构设计
抑制枝晶和减少副产物的另一种有效策略是设计立体结构的金属锌负极,3D立体结构具有更高的比表面积,更多的离子嵌入活性位点[8,25]。
Zeng等[26]通过在碳布(CC)上电镀锌纳米薄片,得到了具有良好循环稳定性的金属锌负极。在此基础上,他们进一步设计了一种柔性三维碳纳米管(CNT)网络结构,使用化学气相沉积法,在柔性碳布表面沉积碳纳米管网络,再通过电沉积锌,构建CC-CNT-Zn三维结构,如图3(c)所示。这种三维结构能有效降低锌的成核过电势,使电场均匀分布,促进锌沉积/剥离过程的可逆性。Zn/CNT电极的库伦效率达到97.9%,能在2 mA/cm2的电流密度下稳定循环200 h,表明副反应和枝晶的生长得到显著抑制。以Zn/CNT为负极组装的Zn/MnO2电池进行1 000次充放电循环后还能保持88.7%的初始容量[17]。
除了碳纳米管,由于高电导率、高表面积等特性,石墨烯也常被用于Zn负极的三维结构设计。Chao等[27]通过在三维多孔的石墨烯泡沫上电镀锌纳米片,得到三维结构的锌负极,并与钒酸锌负极组成准固态电池,在4 A/g下循环2 000次后保持89%的初始容量。Zheng等[28]提出了外延(epitaxial)电沉积的概念,在石墨烯覆盖的不锈钢基底上,沉积形成平行于基底的锌薄片。石墨烯与锌的错配率低,因此在石墨烯的配位作用下,锌会沿着晶格应变最小的方向生长,形成平行的薄片而不是杂乱的枝晶。这种策略从根源上抑制了枝晶的产生,得到的锌负极能稳定循环超过10 000次,且能保持99.9%的库伦效率。
此外,Wang等[18]还设计了一种纳米薄片结构Zn-Al共熔合金负极,由于铝薄片表面钝化产生的Al2O3薄膜的保护作用,Al不发生溶解,而只有Zn选择性地在负极溶解和沉积。因此Zn薄片充当Zn2+电荷载体的来源而Al薄片充当Zn沉积的二维结构框架。由于Al2O3绝缘层的存在,Al的电荷无法向Zn2+传递,因此在Al/ Al2O3界面形成正电荷层,因而通过静电作用引导Zn2+均匀地沉积在Zn薄片上,如图3(d)所示。Zn-Al合金能在0.5 mA/cm2的电流密度下稳定循环超过2 000 h。表1汇总了文中提到的一些水系锌离子电池负极的制备方法、使用的电解液以及电化学性能。
1.2 水系锌离子电池正极材料(图4)
由于多价金属离子较大的极化作用,寻找和设计合适的正极材料十分具有挑战性[8]。近年来,许多类型的材料在水系锌离子电池中表现出优异的性能,主要包括以二氧化锰为代表的锰基材料,以五氧化二钒为代表的钒基材料以及普鲁士蓝类似物材料。

图4 锌离子电池正极材料晶体结构示意图
1.2.1二氧化锰
二氧化锰具有高理论容量(308 mAh/g),储量丰富、毒性低的特点,因此被广泛作为锌离子电池正极材料使用。早在1988年,Huang等[10]就发展了Zn/ZnSO4/MnO2二次电池体系。
二氧化锰晶胞由Mn4+和6个配位的O2-构成,晶胞间不同的连接方式会形成各种隧道或层状结构,如图4(a)所示,锌离子能嵌入其中并引起晶相转变。以α-MnO2的储锌机理为例,在放电过程中,锌离子嵌入α-MnO2结构中并引起部分+4价的锰还原为+3价,+3价锰不稳定而进一步发生歧化反应生成+2价和+4价锰,+2价锰溶解而导致相变,形成Zn-水钠锰矿(birnessite)或ZnMn2O4尖晶石层状结构;在充电过程中,溶解的Mn2+会重新嵌入形成原α-MnO2结构[4]。MnO2的相变储锌机理提高了其放电容量,但由于Mn2+的溶解和重复相变后导致的结构改变,MnO2材料的容量随循环次数增加而快速衰减。并且MnO2材料电导率低,限制了多价金属离子的扩散[5]。
此外,使用poly(3,4-ethylenedioxythiophene) (PEDOT)导电高分子材料包覆MnO2,能避免电极材料与电解液直接接触,起到保护层的作用,抑制MnO2的溶解,同时也能贡献部分容量[38],显著提升MnO2正极材料的电化学性能。Zeng等[39]通过电沉积法在MnO2正极表面包覆了一层PEDOT,得到MnO2@PEDOT正极,与Zn纳米片负极组成电池,达到366.6 mAh/g(0.74 A/g)的比容量,并在循环充放300次后保持83.7%的初始容量。此外,若使用ZnCl2/MnSO4/poly(vinyl alcohol)(PVA)凝胶电解质,组装成的准固态电池在0.37 A/g下的比容量达到282.4 mAh/g,且能进行弯折而不影响性能,可应用于柔性可穿戴设备。Zhang等[40]进一步设计了三维结构的MnO2@PEDOT正极。首先,碳纳米管阵列附着在碳布上形成均匀的三维网状导电基底,通过电沉积法分别将MnO2和PEDOT均匀地沉积在基底上,得到CC-CNT-MnO2-PEDOT(CMOP)三维结构正极,其比容量达到306.1 mAh/g(1.1 A/g下)。组成的Zn-CMOP准固态电池表现出379.4 Wh/kg的能量密度,且柔性可弯折。Zhang等[38]还报道了一种具有氧缺陷的ZnMnO2@PEDOT正极。首先通过电沉积法制备ZnMnO2电极材料,然后在H2/N2气氛下煅烧引入氧缺陷,最后再通过电沉积包覆PEDOT。实验和理论计算都表明氧空位能显著影响电极的导电能力和Zn2+扩散速度。ZnMnO2@PEDOT正极还可进一步组装柔性全固态电池。
1.2.2五氧化二钒
由于理论容量高(>300 mAh/g)而价格低廉,钒氧化物材料也受到了研究者的广泛关注[10,41]。五氧化二钒具有大孔道的层状晶体结构,如图4(b)所示,有利于锌离子的储存[8]。不同于二氧化锰复杂的储锌机理,氧化钒的储锌机理则较为简单。在充电过程中,锌离子和水分子共同嵌入五氧化二钒层状结构中,可逆地转化为ZnxV2O5·nH2O层状结构,在放电过程中,锌离子脱出,晶体层状结构恢复[4]。在锌离子不断嵌入脱出,氧化钒结构重复转变后,其晶体结构会发生改变,而导致储锌能力下降,容量衰减,这可以通过引入金属柱撑离子(如Li+、Na+、K+、Mg2+、Ca2+等),提高氧化钒层状结构的稳定性,减缓容量衰减[8]。如Yang等[42]报道的LixV2O5·nH2O材料,在5 A/g电流密度下达到304 mAh/g的容量,充放循环500次后能保持232 mAh/g的容量。Li+嵌入氧化钒层间,起到“支柱”的作用,稳定层状结构,并且能扩大层间空间,有利于锌离子的扩散和储存。He等[43]则以La3+作为柱撑离子,通过水热法制备了LaVO4正极材料,在0.38 A/g下比容量达到472.5 mAh/g且充放循环2 000次后无容量衰减。这表明离子半径大的La3+能优化V2O5的结构,显著扩大层间距,提升Zn2+的扩散速率。
除了嵌入各种金属离子,Zeng等[44]还报道了一种聚苯胺嵌入的V2O5正极材料,作为导电聚合物,聚苯胺能促进电极中的电子传递,提高导电性,因此Zn/V2O5电池具有良好的倍率性能,电流度从0.5 A/g增加到20 A/g时,仍能保持68.7%的比容量(420.4 mAh/g/288.9 mAh/g)。
一系列报道表明[45-48],水合氧化钒的结构更加稳定,结构水分子处于相邻的层状结构之间[4],能扩大氧化钒层间空隙,降低电极电极界面电荷传输的活化能,还能部分屏蔽锌离子的电荷,因此降低锌离子之间以及嵌入的锌离子与氧化钒结构框架之间的静电作用,进而加快锌离子的扩散速度,减少对氧化钒结构的破坏。得益于嵌入水分子的作用,Zn0.25V2O5·nH2O材料在0.4 A/g电流密度下循环1 000次后能保持81%的容量(226 mAh/g)[45],V2O5·nH2O/石墨烯电极材料组装的锌离子电池在30 A/g下的比电容达到248 mAh/g,且在6 A/g下循环900次后仍保持71%的比容量[46]。
除此之外,非晶态的氧化钒也被用作锌离子电池正极材料,并在0.1 A/g下表现出489 mAh/g的比电容,甚至高于晶态的氧化钒。这可能是由于无规则的开放孔道结构更有利于锌离子的扩散且能提供更多的活性位点,因此表现出更好的倍率性能和更大的比容量。另一方面,相比于晶态结构,锌离子嵌入脱出过程对无定形氧化钒结构影响较小,因此具有更好的循环稳定性[49]。
一位江南老友,平素读里尔克的诗,临摹老树的画,豪情饮酒,热会宾朋。他说,每天他都起得很早,吟诗作画之余,还要侍弄一屋子花草,把每一株植物都料理到妥当。因为有这样一个早上,他觉得一天都过得神清气爽。这才叫生活,这才是会生活。
1.2.3普鲁士蓝类似物
普鲁士蓝,Fe4[Fe(CN)6]3·xH2O具有面心立方晶胞结构,Fe(Ⅲ)和Fe(Ⅱ)处于立方体的顶点,氰基处于立方体棱,碳端与Fe(Ⅱ)配位,氮端与Fe(Ⅲ)配位。若普鲁士蓝结构中的铁离子被其他过渡金属离子代替,则称为普鲁士蓝类似物(PBAs),如图4(c)所示。普鲁士蓝及其类似物具有开放的三维孔道和较大的晶格间隙,有利于多价金属离子的嵌入和脱出[4,32]。Yang等[50]报道了一种长循环寿命的普鲁士蓝(FeHCF)锌离子电池,对电池进行高压(2.3 V)扫描后,电池比容量达到76 mAh/g(1 A/g),在3 A/g下循环10 000次后能保持73%比容量。X射线光电子能谱(XPS)分析表明,与氰基C端与Fe之间的配位键在高压扫描后被削弱,与C端配位的低自旋Fe被激活。被激活的Fe(Ⅲ)在放电时更易还原为Fe(Ⅱ),进而提升电池比容量。同时激活后的Fe(Ⅲ)/Fe(Ⅱ)氧化还原反应可逆性高,且循环过程中晶格结构变化小,因此电池循环稳定性良好。Lu等[51]通过原位共沉淀法得到了MnO2纳米片包覆ZnHCF正极材料(ZnHCF@MnO2),该电极表现出电容性质,离子嵌入以及氧化还原反应的储能行为,在0.1 A/g下具有118 mAh/g的比电容。此外,还有文章报道了CoFe(CN)6普鲁士蓝类似物电极材料[52],XPS分析表明,其电极反应过程包括Zn2+的嵌入/脱出,以及Co(Ⅲ)/Co(Ⅱ)和Fe(Ⅲ)/Fe(Ⅱ)2个氧化还原反应,因此该CoHCF材料能在0.3A/g电流密度下能达到173.4 mAh/g的比容量。非原位XRD分析显示,在Zn2+嵌入/脱出的过程中,CoHCF将可逆地由立方晶系转变为单斜晶系,表现为XRD谱峰的周期性变化。由于电极反应可逆性高,组装的Zn/CoFe(CN)6电池器件在3 A/g电流密度下循环2 200次后几乎没有发生容量衰减,比容量保持在150 mAh/g。此外,Zhang等[53]组装的六氰铁酸锌(ZnHCF)锌离子电池能输出高达1.7 V的工作电压,六氰铁酸铜(CuHCF)[54-55]也有报道,但普鲁士蓝类似物的容量通常较低(<100 mAh/g),限制了其应用[56]。
2 水系铝离子电池概述
铝具有极高的体积比容量和质量比容量,并且价格低廉、储量丰富,如图1所示,因此水系铝离子电池是十分理想的储能器件,其储能机理与水系锌离子电池类似,如图5所示。充电时,铝离子从正极材料中脱出,在金属负极表面沉积;放电时,金属铝从负极材料表面剥离进入电解液,再迁移嵌入正极材料的空隙中[57]。
2.1 水系铝离子电池负极材料

使用高浓度的“盐包水”电解液能扩展水系电解液的稳定电势窗口[62],进而使金属铝可以在水系电解液中稳定存在。Pan等[63]使用高浓度的AlCl3作为水系电解液,能将稳定电压窗口扩大到约4 V,组装的Al-石墨电池在0.5 A/g电流密度下循环1 000次后保持95%的初始比容量;此外Hu等[64]则以Al(OTF)3+LiTFSI+HCl为混合电解液,首次组装了Al-S电池,稳定电压窗口约为3 V。
表2按文中顺序总结了文献中报道的水系铝离子电池负极及其解决铝负极腐蚀和钝化问题的策略。
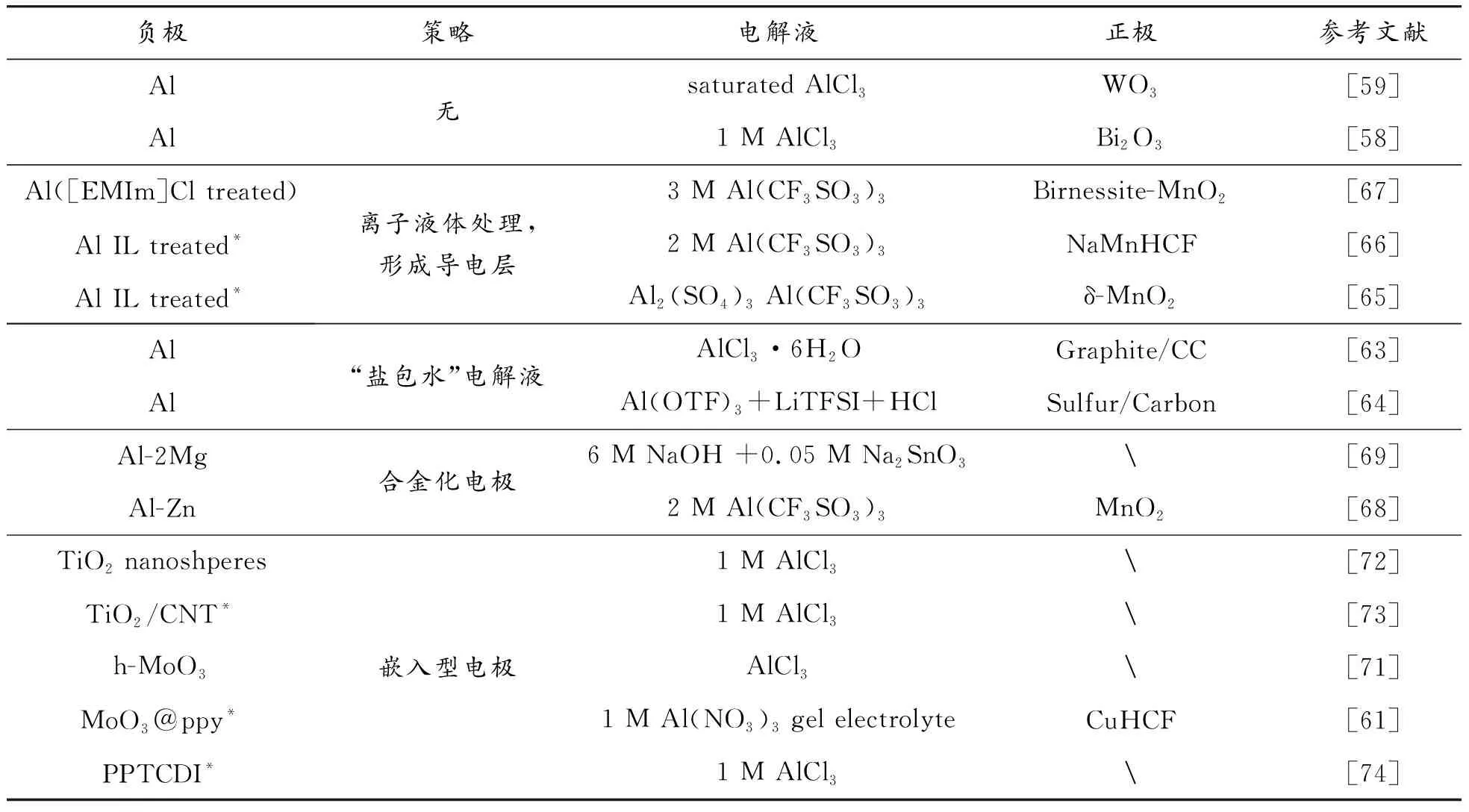
表2 水系铝离子电池负极材料汇总
为了解决金属铝负极的钝化问题,Zhao等[65]提出在惰性气氛中使用AlCl3和离子液体[EMIm]Cl的混合物处理金属铝电极,这样可以在表面上形成导电层,改变表面化学性质,防止氧化物薄膜的生成,从而显著降低Al溶解/沉积的过电势。这种方法得到广泛使用,如Kumar等[66-67]分别以NaMnHCF和水钠锰矿MnO2作为正极材料与AlCl3-离子液体混合预处理后的Al负极组装电池。
电极合金化也能抑制金属铝的腐蚀和钝化。Yan等[68]在Zn基底上沉积铝得到Zn-Al合金负极。形成的锌合金能减缓铝的钝化和自放电行为,抑制析氢副反应提高库伦效率。同时Al3+的电荷屏蔽效应抑制了Zn2+的沉积,进而抑制枝晶的产生。同时,Zn-Al合金负极的电化学电势更低。组装的对称电池能循环1 500 h以上而不发生短路,且极化电势小于25 mV(0.2 mA/cm2)。此外,Gao等[69]制备了Al-2Mg合金,合金负极电位降低(-1.81 V vs.SCE),并在NaOH碱性电解液中加入了Na2SnO3锡酸盐,使锡均匀沉积在Mg掺杂的氧化薄膜上,能抑制负极95%的析氢腐蚀。
另一种策略是用电位较低的Al3+嵌入型氧化物材料替代金属负极作为水系铝离子电池的负极材料[70]。如Joseph等[71]设计的MoO3纳米线负极材料,Kazazi等设计的TiO2纳米球[72]和TiO2/碳纳米管复合材料[73],以及Wang等[61]以铁氰化铜(CuHCF)为正极与聚吡咯(PPy)包覆的MoO3负极组成的柔性水系铝离子电池。
有机高聚物具有良好的结构稳定性,反应活性位点多,比容量大,可以作为嵌入型水系铝离子电池负极材料。Cang等合成了PPTCDI[poly(3,4,9,10-perylentetracarboxylic diimide)]材料,并作为铝离子嵌入型负极,在0.1 mA/g下循环1 000次后几乎无容量衰减[74]。
2.2 水系铝离子电池正极材料(图6)
2.2.1过渡金属氧化物
与水系锌离子电池类似,锰氧化物和钒氧化物也可以作为铝离子电池的正极材料。Wu等[75]以尖晶石Mn3O4纳米颗粒为前体,将其与铝片组装成电池,在30 mA/g下充电至1.8 V(vs.Al/Al3+),实现从尖晶石Mn3O4到层状AlxMnO2·nH2O材料的电化学转变,并组装成水系铝离子电池器件(Al/Al(OTF)3-H2O/AlxMnO2·nH2O),比容量达到467 mAh/g。此外He等[67]还报道了另一种氧化锰材料的电化学转变,在放电过程中,原来的水钠锰矿(Birnessite)MnO2部分溶解,转变为AlxMn(1-x)O2,作为后续充放循环的正极材料。Gu等[76]报道了以V2O5纳米线为正极材料的铝离子电池,V2O5正极表面在充放电过程中会发生晶态与无定型态的转变。Kumar等[77]则报道了另一种钒基正极铝离子电池,以铝箔为负极FeVO4为正极组成的电池器件在60 mA/g电流密度下具有达到350 mAh/g的比容量。此外,Wang等[78]还报道了一种VO2正极材料,通过水热法使用草酸还原V2O5得到纳米带VO2,制成的电极比容量达到235 mAh/g。VO2独特的三维孔道结构有利于Al3+的快速传输,可用于组装高性能的水系铝离子电池。

图6 铝离子电池正极反应机理和制备方法示意图
此外,TiO2也被广泛用作铝离子电池正极材料。TiO2存在8种不同的晶体结构,其中金红石(rutile)、板钛矿(brookite)和锐钛矿(anatase)为常见的晶态。锐钛矿型TiO2晶体结构由堆叠的TiO6八面体组成,这些八面体构成隧道结构,产生适当大小的离子传输路径,可以作为铝离子电池的嵌入型正极材料[60],如图6(a)所示。Liu等[79]首次报道了以锐钛矿型TiO2纳米管作为正极材料的水系铝离子电池。与块体TiO2相比,纳米管TiO2具有更短的离子传输路径和更大的比表面积。XPS分析表明,Al3+嵌入TiO2后,Ti4+会倾向于还原为Ti3+和Ti2+,以维持电荷平衡,这与锂离子电池中的现象类似[80]。由于嵌入TiO2中的Al3+浓度较低,因此没有导致TiO2的晶形转变。Wang等[81]的研究也得出类似的结论,Al3+嵌入后Ti4+还原产生Ti3+,且根据密度泛函理论(DFT)的计算结果,当嵌入的Al3+含量小于0.167时,TiO2晶体结构较稳定,不会发生结构转变,如图6(a)所示。此后,锐钛矿型TiO2材料被广泛用作水系铝离子电极材料,如TiO2纳米管阵列(TiO2-NTA)[82-83]、TiO2纳米颗粒[84]、TiO2纳米棒[81]、介孔TiO2纳米叶[85]等。
2.2.2普鲁士蓝类似物
与锌离子电池类似,普鲁士蓝及其类似物的三维开放孔道结构和较大的晶格间隙有利于Al3+离子的嵌入和脱出,并且其制备方法简单,电化学性能较好,是理想的水系铝离子电池正极材料。Liu等[86]通过简单的共沉淀法制备铁氰化铜(KCu[Fe(CN)6]·xH2O)纳米颗粒作为铝离子电池的正极材料。根据TEM成像分析,铁氰化铜颗粒粒径为30~50 nm,有利于缩短离子在主体材料中的扩散距离,提高倍率性能。铁氰化铜纳米颗粒的制备方法较为简单,适合广泛应用。循环伏安(CV)曲线表现出2个还原峰(0.81 V,0.53 V vs.SCE),如图6(b)所示,文中认为这是由于水合铝离子在嵌入正极时需经过去溶剂化过程。在0.4 A/g电流密度下表现出41.0 mAh/g的比容量,经过1 000次循环后,只能保持54.9%的初始容量,容量较低,循环稳定性较差,可能由于循环过程中电极材料溶解,这是普鲁士蓝类似物作为正极材料亟待解决的问题。Ru等[87]报道了另一种铁氰化钴(K2CoFe(CN)6)材料,通过水合反应和低温煅烧得到K2CoFe(CN)6纳米立方,比容量达到50 mAh/g(电流密度0.1 A/g),循环1 600次后能保持76%的初始容量,稳定性较好。Gao等[88]报道了Fe-Ni混杂的铁氰化镍钾(KNHCF),XRD分析表明,充放循环过程中,随着Al3+的嵌入和脱出晶格参数周期性变化,晶体结构得到保持,但是由于Al金属负极的副反应,Al/KNHCF电池的循环稳定性较差,20 mA/g下充放循环500次后比容量衰减50%。此外,铁氰化锰[66]也被合成并用作铝离子电池正极材料,但关于普鲁士蓝类似物作为水系铝离子电池正极的研究总体较少,且电化学性能都有提示空间。
2.2.3石墨

3 问题与挑战
发展廉价、安全、大容量的水系多价金属离子电池在大规模储能领域有广泛的应用前景,尽管近年来水系多价金属离子电池取得许多研究进展,但未来仍存在着许多问题和挑战。
3.1 负极材料
对于水系锌离子电池体系,廉价的金属锌片可以直接作为负极,但是由于锌片表面不平整,“尖端效应”引起电荷分布不均,进而导致枝晶的产生;且锌片表面之间的电势差会加速自腐蚀。因此需对负极进行合理的设计,目前主要的策略是:① 对金属表面进行改性,如使用活性炭[20]等碳材料或纳米多孔材料(如纳米CaCO3薄膜[16])包覆金属表面,碳材料的主要作用是对枝晶的生成进行物理阻隔,但是其无法阻止锌在导电碳材料表面沉积而形成枝晶,因此这种抑制作用尚不能令人满意。惰性的纳米CaCO3薄膜能使锌较为均匀地在电极表面沉积,但是CaCO3的低导电性限制了离子和电子传输,影响电极的倍率性能。因此,选择合适的涂覆材料对表面改性抑制枝晶的策略尤为重要[9,19];② 设计新颖的锌负极结构,构建三维立体结构负极,增大比表面积的同时抑制枝晶生成。如在碳布[26]、碳纳米管[17]、铜网[90]等载体上沉积锌,降低锌的成核过电势,使电场分布均匀,起到抑制枝晶的效果。
不同于水系锌离子电池,金属铝片不适合直接用作水系铝离子电池的负极[60],这是由于金属铝的溶解/沉积电位低于水的析氢电位,在水系电解液中,金属铝将发生析氢腐蚀而不能稳定存在,进而限制电池的循环稳定性。此外,在中性条件下,金属铝电极还易形成钝化膜,阻断铝离子的传输,限制电池的倍率性能。目前主要的解决策略是:① 使用高浓度的电解质扩展水的稳定电势窗口,例如以高浓度AlCl3作为电解质[63];② 对铝负极进行预处理,抑制钝化现象[65];③ 使用铝合金代替纯铝金属作为负极,例如Zn-Al合金负极[68];④ 使用嵌入型电极材料代替金属负极,如使用MoO3等金属氧化物[61]或有机聚合物电极[74]。
虽然许多报道的负极材料已经能很好地抑制枝晶产生或副反应的发生,但是一些负极的制备方法较为复杂,如三维结构锌负极的制备,复杂的制备方法难以规模化生产,不利于水系多价金属离子电池的广泛应用,因此未来的研究应当在关注高性能的同时,简化负极的制备方法。
惰性表面改性保护层能显著提升负极的稳定性,但是同时由于惰性保护层的导电性通常较差,因此在高电流密度下,电池的倍率性能会受到影响。因此导电性高的表面保护层是未来的发展方向,如使用聚苯胺、聚吡咯等导电高分子作为改性层。
目前大多数研究都关注如何抑制枝晶的产生,如果能研究不同电流、电压条件下枝晶产生和变化的现象[91],研究其机理,设计“自修复”负极材料,或发展消除已产生的枝晶的电化学方法,也许是另一种延长电池寿命的可行思路。
电解液对负极电化学行为的影响显著,如高浓度电解液通常能抑制负极的副反应,因此研究电解液浓度、组成以及添加剂对负极反应的影响十分重要。此外,研究固体电解质,组装柔性可穿戴器件;发展可循环使用的电解液,进一步降低成本减少污染,都是重要的研究方向。
3.2 正极材料
合适的水系多价金属离子电池正极材料需要具有高容量,长循环寿命和合适的氧化还原电位,然而目前的正极材料都还存在一些问题[92]。
表3汇总了目前文献中报道的水系多价金属离子电池正极材料的制备方法、测试条件以及电化学性能,由表3可以看出,虽然许多研究者们已经对水系多价离子电池进行了深入的研究,但是目前的正极材料普遍还存在一些亟待解决的问题。
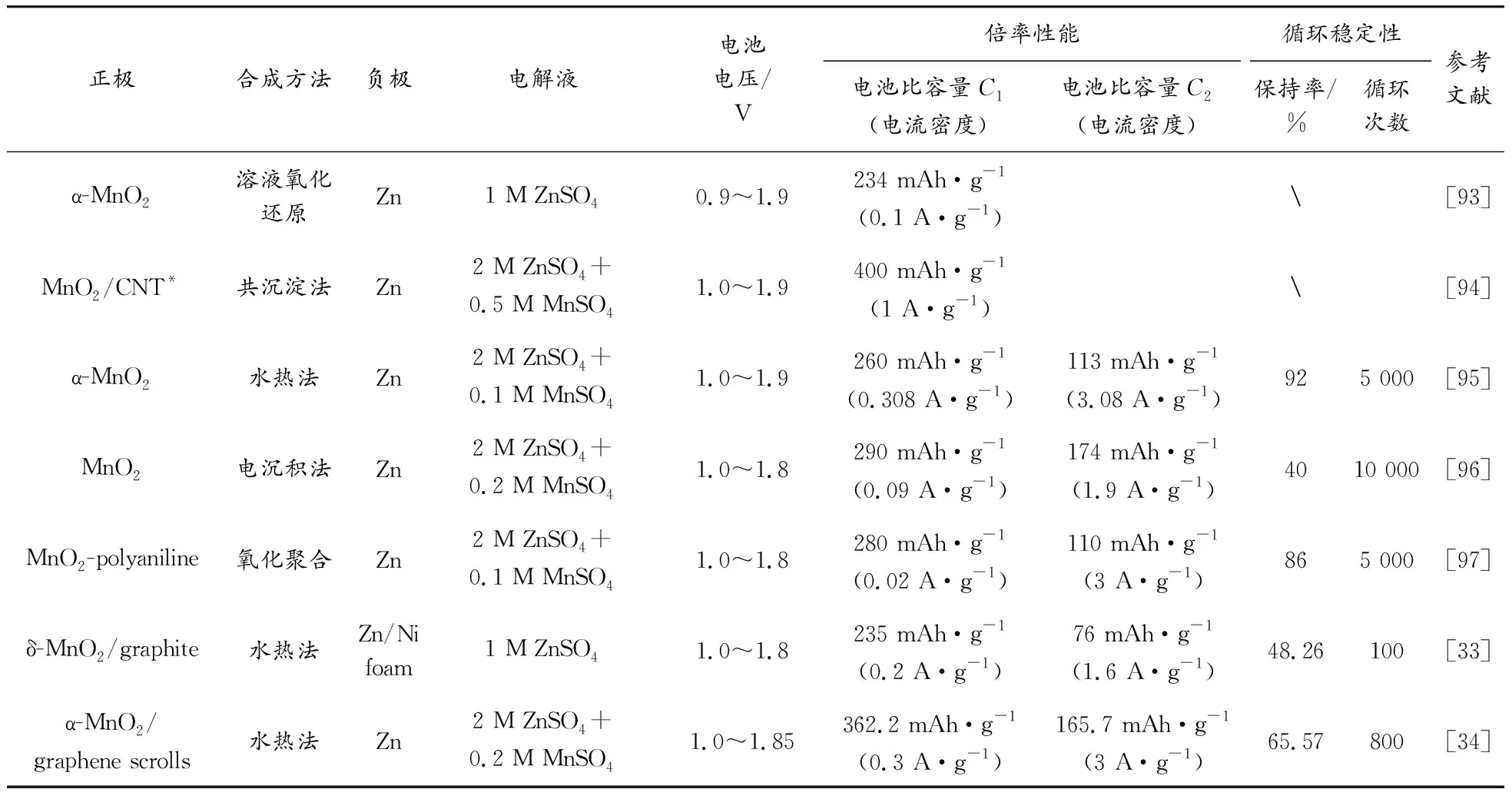
表3 水系多价金属离子电池正极材料汇总

续表(表3)

续表(表3)
首先,许多过渡金属正极材料晶体结构的稳定性较差,在多价金属离子嵌入脱出的过程中往往伴随着晶体结构的破坏,不可逆的相变或电极材料的溶解,进而导致充放循环过程中容量的迅速衰减,氧化锰、氧化钒、普鲁士蓝类似物等材料均存在这种现象。目前可以通过以下方法提高材料的循环稳定性:① 纳米结构设计,具有微观纳米结构的材料通常表现出更好的结构稳定性,如δ-MnO2纳米片的循环稳定性优于δ-MnO2微球[37];② 使用导电聚合物薄膜包覆电极材料,避免电极材料与电解液直接接触,起保护作用,如用PEDOT薄膜包覆MnO2;③ 嵌入其他金属柱撑离子(如Li+、Na+、K+、Mg2+、Ca2+)来提高正极材料的结构稳定性[8]。
其次,正极材料中的离子和电子传输速率较低[60]。大部分正极材料导电能力弱,限制了电子的传输;并且多价金属离子电荷密度高,导致嵌入的离子与正极材料中的阴离子之间具有静电相互作用,限制了离子的扩散速度;此外,虽然多价金属离子的离子半径小于Li+等一价离子,但其在水溶液中的水合离子半径往往大于一价离子,进而导致多价离子更难嵌入正极材料中(可能需去水合化)[63]。因此多价金属离子电池的正极材料倍率性能往往较差,功率密度较低。为了提高正极材料的电荷传输速率,可以采取以下措施:① 与导电性良好的碳材料组成复合材料,大大提高正极材料的导电性[73];② 晶体结构中的水分子能一定程度上屏蔽多价离子的电荷,减少静电作用,提高扩散速率[4];③ 扩大正极材料的结构空隙,促进多价金属离子的嵌入和在主体材料中的快速传输,如使用引入柱撑离子[8]、制备膨化石墨[89,104]等。
虽然上述策略能一定程度上提高正极材料的倍率性能和循环稳定性,但是目前文献报道的材料性能远不能达到商业应用的要求,未来的研究可以进一步发展已有的策略,如探究引入缺陷数量和种类对电化学性能的影响;尝试将其他分子(如某些有机分子)预嵌入材料中等。并应在此基础上,融合多种策略的优势,或者尝试其他新策略。
除了对现有材料的改良,设计新型材料也是重要的研究方向。高分子和有机分子可以通过精准的设计与合成得到高性能材料,目前此类工作的报道较少,未来是十分有前景的研究方向。此外,也可以融合现有材料的优势,制备新型复合材料。复合材料之间的结合方式,如使用粘结剂对性能的负面影响以及异质界面的反应机理等应是主要的研究对象。
合成方法方面,目前大多数正极材料都由水热法合成,总结近几年工作不难发现,使用较为新颖的合成方法,例如电沉积法,无溶剂法,化学气相沉积法等,往往能得到性能更好的电极材料,因此研究新型合成方法也十分必要。
诚然,近年许多报道提出了能够自洽的正极储能机理,但是由于储能机理的复杂性,许多机理尚未被研究,且人们对许多已提出的机理也尚未达成共识。如Zn/MnO2电池的储能机理,除了本文提到的化学相变储能机理之外,还有研究者提出过Zn2+嵌入脱出机理和Zn2+H+共嵌机理[96]等。对新机理的研究理论上能显著地提升材料的性能,根据传统的嵌入机理,电极容量受电极活性位点数量的限制,但是如果考虑电极材料的氧化还原变价,其理论容量将大大提高,若能科学地研究和调控V2O5材料的变价储能,将进一步提高其储能性能,因此对不同材料的储能机理进行深入研究是重要的研究方向之一。
4 结论
目前,大部分研究较少关注与实际应用相关的指标参数,如高载量下材料的性能,极端温度下的稳定性及正负极的间距和质量比等。未来的研究应在提升和优化电极材料性能的同时,探究水系多价金属离子电池商业化的可能性。如应用于电力供应、储存风能、太阳能等间歇性的新能源,稳定地输出汇入电网供电;还可作为公共设施的备用电源,如公交地铁、网络中心、基站等;此外,许多工作成功组装了柔性水系电池,为可折叠可穿戴设备供电也将是水系多价金属离子电池重要的应用领域。与现阶段广泛应用的锂离子电池相比,水系多价金属离子电池具有原料价格低廉,水系器件安全性高,对环境污染小等优势,因此可以与锂离子电池形成互补,为新能源市场注入新活力。

