艰难梭菌A毒素诱导人黏液表皮样癌MEC-1细胞DNA双链损伤研究
尤培蒙, 王丽丽, 杨宇琴, 王晨曦, 赵 晋, 郭 忠
(西北民族大学 医学部, 甘肃 兰州 730030)
艰难梭菌(Clostridiumdifficile)属厌氧革兰阳性杆菌,目前不再被认为是人类肠道正常菌群,而是由于长期卧床或住院等环境因素改变,机体肠道菌群失调而造成患者出现腹泻症状的最常见的主要病原菌。该菌感染后前期大多数无明显症状,但该菌若数量突增,产生的各类毒素大量进入肠道,则可引起伪膜性肠炎(pseudomenbranous colitis,PMC)、盆腔炎和菌血症等疾病,在这些可引起感染性疾病的诸多毒素中艰难梭菌A毒素(Clostridiumdifficiletoxin A,TcdA)最为特殊[1]。艰难梭菌毒素A对SMMC-7721细胞有明显的增殖抑制活性作用,此作用通过诱导细胞凋亡机制产生[2]。它可以诱导多种肿瘤细胞发生程序性死亡,其最主要的原因便是引起肿瘤细胞DNA双链断裂(double strand break, DSB)。DSB造成的细胞DNA双链断裂修复损伤灶点不及时会使细胞周期检查点停滞,从而导致细胞死亡。黏液表皮样癌(mucoepidermoid carcinoma)来源于腺管的上皮细胞,为口腔唾液腺恶性肿瘤,其中低分化型的黏液皮样癌具有恶化程度高、放射治疗不敏感和预后生存率低的显著特点[3]。本文采用人黏液表皮样癌MEC-1细胞作为研究对象,探究艰难梭菌A毒素诱导其DNA双链损伤的机制,旨在为以艰难梭菌A毒素作为抗肿瘤的化疗药物提供实验依据。
1 材料与方法
1.1 材料与试剂
人黏液表皮样癌细胞系MEC-1(空军军医大学口腔医学院);艰难梭菌A毒素(西北民族大学医学院傅思武团队实验室);高糖培养基DMEM(Gibco GlutaMAX公司);胎牛血清(Lonsera公司);噻唑蓝MTT、二甲基亚砜DMSO(SIGMA公司);4′,6-二脒基-2-苯基吲哚DAPI(Molecular Probes公司);碘化丙啶PI(lsbio公司);鼠抗磷酸化组蛋白γH2AX、pATM单克隆抗体(Upstate公司); FITC标记山羊抗小鼠IgG(DAKO公司);其余TBE、TBS、TTN等缓冲溶液均为分析纯(西陇科学化工公司)。AX70型荧光显微镜(Olympus公司);WD-2102A型全自动酶标仪(北京六一公司);DYY-6C型电泳仪(Biobase公司);LSM 700型激光共聚焦显微镜(Zeiss公司)。
1.2 实验方法
1.2.1 细胞培养及药物配制
常规培养MEC-1细胞,传代后取对数生长期细胞用于实验。利用DMEM培养基配制TcdA药物母液,稀释至50、100、200、400、800 μmol·L-1。
1.2.2 MTT法测定细胞活性
取MEC-1细胞消化后计数,调整细胞密度为2×108·L-1,将单细胞悬液接种到96孔板,每孔100 μL,每组设6个复孔,置于培养箱内过夜后吸弃培养液,加入50~800 μmo1·L-1的TcdA药物培养基并继续培养3~48 h,同时设立未加药组和DMSO溶剂组作为对照,使用全波长酶标仪测定各培养孔的吸光值(A490)。每组实验重复3次。
细胞生长抑制率(growth inhibition rate)公式为
Rgi=(1-A1/A2)×100%。
式中:Rgi为细胞生长抑制率;A1为实验组吸光值均值;A2为对照组吸光值均值。以Excel Forcast函数计算出半数抑制浓度(IC50值)[4]。
1.2.3 中性彗星实验
将质量分数为1%的低熔点琼脂糖凝胶加热后取50 μL预铺胶。调整细胞密度为4×107·L-1,取40 ℃预热下的1.2 mL凝胶与400 μL细胞混匀后铺在载玻片上,室温静置3 min;将铺胶玻片置于现配裂解液(含0.5 mg·mL-1蛋白酶K)中,4 ℃裂解1 h,37 ℃静置18~20 h;TBE缓冲溶液漂洗3次,每次0.5 h。将载玻片静置于电泳槽中0.5 h(避光),调整电压为16~18 V,电流为7 mA,电泳25 min;用体积分数为1%的H2O2处理10 min,dd水漂洗后,PI(5 μg·mL-1)染色0.5 h,湿盒中4 ℃保存。荧光显微镜观察彗星图像呈橘红色,拍摄图像时每张玻片50个细胞,每组剂量选择3张玻片观察,采集到的彗星图像用CASP软件分析得出彗星参数[5-7]:尾长、头部DNA百分比,尾部DNA百分比、尾矩和Olive尾矩等指标,该实验重复3次后计算导出数据。
1.2.4 免疫荧光染色
调整细胞密度为2×108·L-1,接种到放有盖玻片的培养皿中(规格为35 mm×10 mm),每皿100 μL单细胞悬液,孵箱放置2 h后每皿加入DMEM培养基2 mL,继续培养24 h。按时间和浓度的要求采取2种处理方式:吸弃上清液,更换含TcdA(800 μmol·L-1)的新培养基继续培养(37 ℃,体积分数为5%CO2),于不同时间点取出;更换不同浓度TcdA新培养基作用于MEC-1细胞24 h后取出。
参照Yang等[8]的方法稍作改动后进行免疫荧光实验。 取出药物处理后的细胞爬片, 使用预冷的TBS缓冲液洗涤2次, 体积分数为4%多聚甲醛浸泡20 min, TBS洗涤3次(每次5 min); 质量分数为0.2%的Triton-X 100破膜, TBS洗涤3次(每次1 min); TTN浸泡10 min, TBS洗涤, 标记TTN稀释鼠γH2AX单克隆抗体或者pATM单克隆抗体(1∶500), 孵育2 h, TBS洗涤2次(每次1 min); 标记TTN稀释山羊抗鼠FITC-IgG(1∶200), 孵育1 h, TBS洗涤3次(每次1 min), 操作过程中注意避光; DAPI(0.05 μg·mL-1)染色5 min, TBS洗涤3次; 固定液封片,荧光显微镜拍照。 使用Image Pro Plus软件随机选取一张玻片上15个100倍视野下的全部细胞, 要求至少统计800个细胞/张; 然后对细胞γH2AX、pATM焦点进行定量计算, 规定细胞核中焦点数>5者为阳性细胞。
1.2.5 统计学分析
2 结果与分析
2.1 TcdA对MEC-1细胞增殖抑制作用
TcdA对MEC-1细胞增殖的抑制作用如表1所示,从表1中可以看到,TcdA可抑制MEC-1细胞的增殖,其影响细胞生长的浓度为50~800 μmol·L-1(P=0.010<0.05),呈时间-浓度依赖性。通过对IC50药敏试验指标计算分析,TcdA作用于MEC-1细胞24、48、72 h的IC50分别为960.65、1 207.31和795.59 μmol·L-1,通过显微镜观察发现超过60%的MEC-1细胞在24~48 h内发生形态学变化,如皱缩、变形以及脱落,确定最佳干预时间为24 h。

表1 TcdA对MEC-1细胞增殖的抑制作用Table 1 Inhibitory effect of TcdA on the growth of MEC-1 cells
2.2 中性彗星电泳检测到MEC-1细胞DSB
TcdA作用24 h诱导MEC-1细胞DNA双链断裂的浓度效应如表2所示,从表中可以看到,MEC-1“彗星细胞”的头部DNA百分比基本呈减少趋势,彗星尾长、彗星全长、尾部DNA百分比、尾矩和Olive尾矩基本呈增加趋势。随着TcdA浓度增大,细胞DNA断裂损伤程度加重,在浓度为400 μmol·L-1时彗星尾长、彗星全长达到最大,从图1中可以清晰观察到。800 μmol·L-1TcdA诱导MEC-1细胞DNA双链断裂的时间效应如表3所示,从表中可以看到,随着时间的延长,DNA断裂损伤也呈现逐渐上升的趋势,48 h彗星全长、彗星尾长、尾矩和Olive尾矩明显减少。

(a) 0μmol·L-1(b) 50μmol·L-1(c) 100μmol·L-1(d) 200μmol·L-1(e) 400μmol·L-1(f) 800μmol·L-1
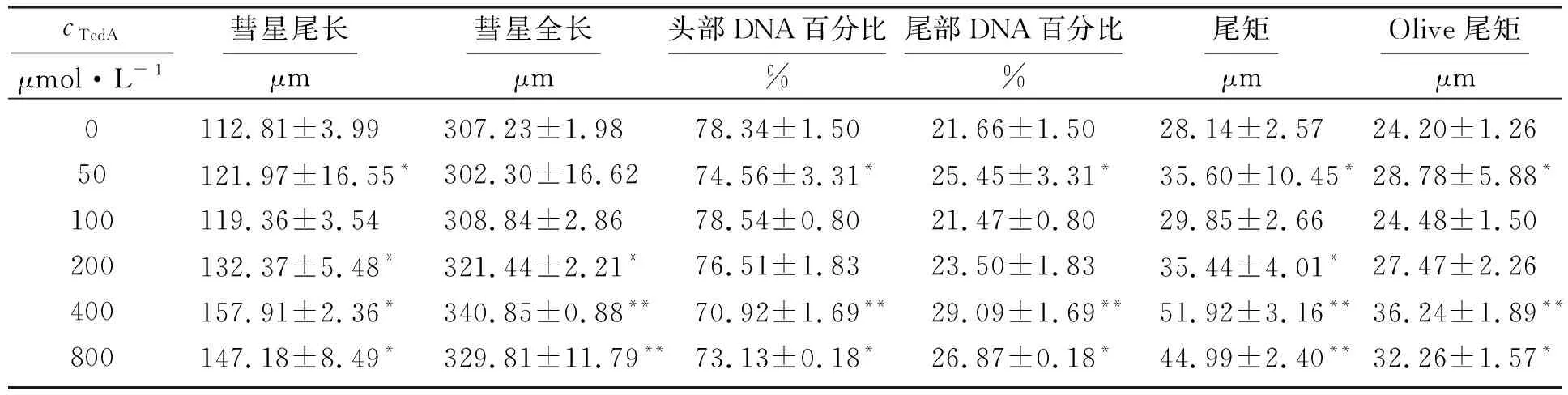
表2 TcdA诱导MEC-1细胞DNA双链断裂的浓度效应(24 h)Table 2 Concentration effect of TcdA on DNA double strand breaks in MEC-1 cells (24 h)
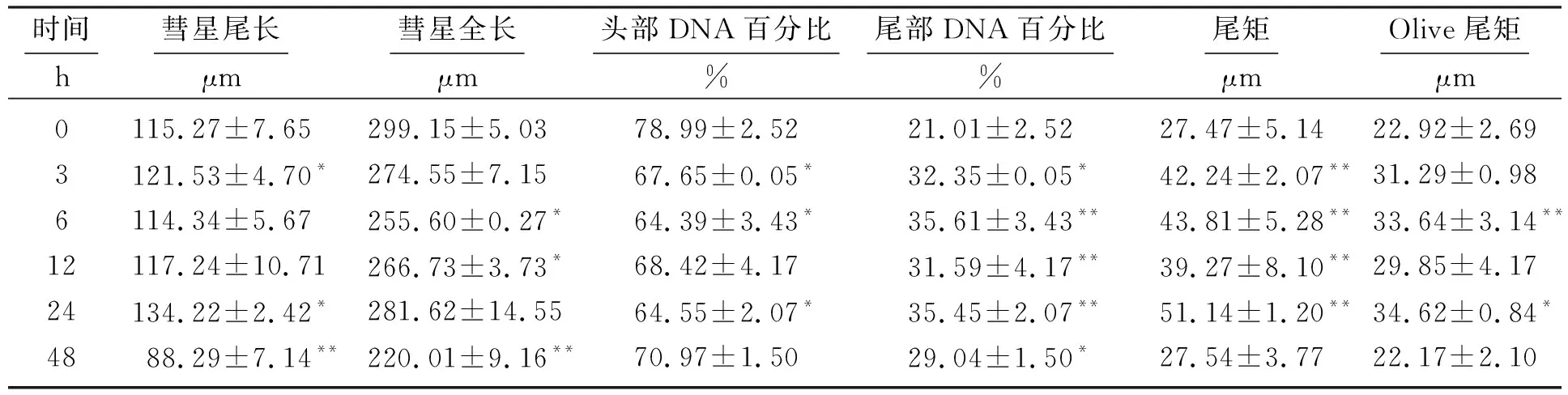
表3 800 μmol·L-1 TcdA诱导MEC-1细胞DNA双链断裂的时间效应Table 3 Time effect of 800 μmol·L-1 TcdA inducing DNA double-strand breaks in MEC-1 cells
2.3 TcdA诱导MEC-1细胞γH2AX、pATM焦点的形成
免疫荧光结果显示,100~1 600 μmol·L-1的TcdA作用MEC-1细胞24 h,γH2AX蛋白阳性表达水平随着TcdA浓度的增加而升高,800 μmol·L-1TcdA作用细胞γH2AX蛋白阳性率有统计学意义(P=0.025<0.050),见图2; 800 μmol·L-1的TcdA作用MEC-1细胞6 h, 即可观察到明显的γH2AX荧光焦点(Foci)表达, 随着作用时间的推移,γH2AX的Foci表达略微发生变化,24 h时γH2AX的Foci数量降低,见图3; 100~1 600 μmol·L-1的TcdA作用MEC-1细胞24 h, pATM蛋白阳性表达水平随着TcdA浓度的增加也随之升高(P=0.025<0.050), 1 600 μmol·L-1pATM表达量接近80%,见图4; 800 μmol·L-1的TcdA作用MEC-1细胞48 h达峰值(P=0.010<0.050),pATM阳性细胞数约占视野下细胞总数的1/2,见图5;低倍镜视野下细胞分布聚集处荧光焦点直径明显偏大,荧光亮度偏高,高倍镜视野可明显观察到损伤标记物γH2AX、pATM Foci的数量差异,见如图6。添加沃曼青霉素组(8 μmol·L-1)和咖啡因组(20 nmol·L-1)2种抑制剂下TcdA诱导MEC-1细胞的结果显示,γH2AX、pATM的平均阳性率均有明显变化。当TcdA的浓度为800 μmol·L-1时,添加抑制剂对MEC-1细胞γH2AX、pATM的平均阳性率影响最大,pATM在添加沃曼青霉素组和咖啡因组后阳性表达率均降至40%左右,见图7;γH2AX在添加沃曼青霉组后阳性表达率上升,添加咖啡因组后阳性表达率下降,见图8。
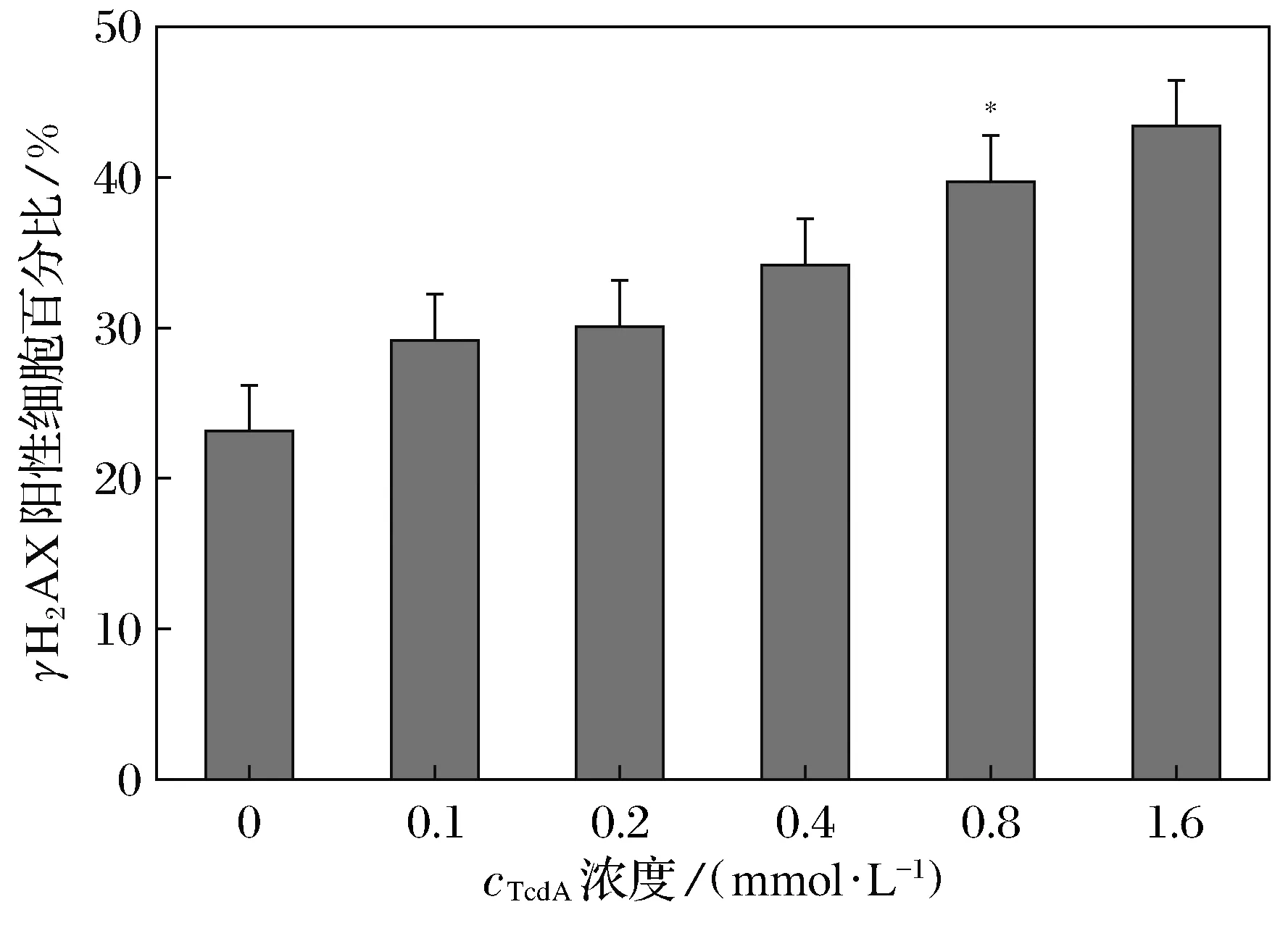
图2 TcdA诱导MEC-1细胞γH2AX生成的浓度效应(24 h)Fig.2 TcdA induces γH2AX foci in MEC-1 cells in a dose-dependent manner(24 h)

图3 TcdA诱导MEC-1细胞γH2AX生成的时间效应(800 μmol·L-1)Fig.3 TcdA induces γH2AX foci in MEC-1 cells in a time-dependent manner(800 μmol·L-1)
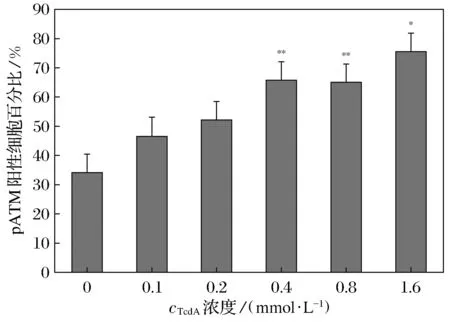
图4 TcdA诱导MEC-1细胞pATM生成的浓度效应(24 h)Fig.4 TcdA induces pATM foci in MEC-1 cells in a dose-dependent manner(24 h)

图5 TcdA诱导MEC-1细胞pATM生成的时间效应(800 μmol·L-1)Fig.5 TcdA induces pATM foci in MEC-1 cells in a time-dependent manner(800 μmol·L-1)

(a)0μmol·L-1 DAPI(5倍)(b)0μmol·L-1 γH2AX(5倍)(c)0μmol·L-1 DAPI(20倍)(d)0μmol·L-1 pATM(20倍)(e)800μmol·L-1 DAPI(5倍)(f)800μmol·L-1 γH2AX(5倍)(g)800μmol·L-1 DAPI(20倍)(h)800μmol·L-1pATM(20倍)
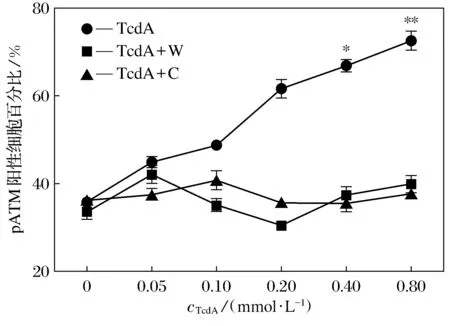
图7 添加沃曼青霉素和咖啡因2种抑制剂对TcdA诱导MEC-1细胞pATM生成浓度效应的影响(24 h)Fig.7 Effects of addition of two inhibitors of Wortmannin and caffeine on TcdA induced MEC-1 cells influence of pATM formation concentration effect (24 h)注: TcdA+W表示添加沃曼青霉素组,TcdA+C表示添加咖啡因组,下同

图8 添加沃曼青霉素和咖啡因2种抑制剂对TcdA诱导MEC-1细胞γH2AX生成浓度效应的影响(24 h)Fig.8 Effects of addition of two inhibitors of wortmannin and caffeine on TCDA induced MEC-1 cells Influence of γH2AX formation concentration effect (24 h)
3 讨 论
近年来,艰难梭菌A毒素渐渐被认知,研究者从诸多角度阐释了其抗肿瘤的机制。在TcdA的作用下,TPC-1细胞的增长抑制、凋亡指数、细胞脱落率及细胞膜损伤情况均高于Vero细胞,从细胞毒作用方面说明了TcdA造成肿瘤细胞死亡的机制[9]。Gerhard等[10]发现TcdA诱导的细胞凋亡依赖于Rho GTPases的糖基化,但不是由肌动蛋白细胞骨架破坏(细胞病变效应)触发的。李明等[11]发现TcdA对K562细胞有增殖抑制作用并诱导凋亡,提出BAX蛋白表达和Caspase基因激活相关假设。Gigli等[12]发现Tcd A能显著降低结肠腺癌细胞Caco-2的活力,降低细胞经上皮的电活性阻力值和RhoA GTP、bax、胞质紧密粘连蛋白1抗体和闭锁蛋白的表达。王涛等[13]发现Tcd A可诱导SW480细胞发生凋亡,其机制可能是通过诱导线粒体膜电位的下降,破坏其外膜结构而诱发。
本文运用MTT法测定了TcdA对 MEC-1细胞增殖抑制作用,分析得出了本研究的最佳干预时间,以此作为探究影响肿瘤细胞生长作用时间节点选取的依据;γH2AX和pATM蛋白表达水平变化的测定和单细胞凝胶彗星细胞头尾参数变化验证了TcdA造成了MEC-1细胞DNA双链断裂的机制。结果表明,TcdA对MEC-1细胞具有诱导DNA双链断裂作用,且存在浓度和时间依赖关系。
1) 目前普遍认为γH2AX抗体标记是验证DNA双链断裂损伤存在的金标准[14],本次免疫荧光实验借助这一原理即组蛋白H2AX与ATM在MEC-1细胞的DNA双链损伤后形成磷酸化组蛋白焦点(γH2AX、pATM)[15],更系统直观地理解TcdA诱导肿瘤细胞DNA双链损伤的分子机制。100~800 μmol·L-1的TcdA随着浓度的增大,磷酸化组蛋白焦点(γH2AX、pATM)数量基本呈现上升趋势。实验6 h、800 μmol·L-1组,镜下细胞核内已能观察到一定荧光强度和数量的Foci,在400和800 μmol·L-1的TcdA作用24 h组中亦可见部分细胞出现较强阳性率。利用单细胞彗星电泳参数数据和免疫荧光相验证,并对一部分荧光Foci进行量化分析,额外添加了2组抑制剂进行检测,来预测DNA双链断裂损伤途径。
2) 目前认为真核细胞修复DNA双链断裂损伤主要有同源重组(homologous recombination,HR)和非同源末端连接(non-homologous end joining,NHEJ)2条途径[16]。其中含有DNA依赖的蛋白激酶(DNA-dependent protein kinase,DNA-PKs)、ATM和ATR的磷脂酰肌醇激酶家族(PI3K)便是参与非同源末端连接修复途径的最重要的蛋白质因子[17]。有研究发现不同因素诱导下形成的DSB可能与PI3K不同家族成员的激活密切相关,如由复制压力诱导的组蛋白磷酸化与ATR有关,经电离辐射(Ionizing radiation,IR)诱导的组蛋白磷酸化与ATM蛋白家族相关[18-19]。添加的沃曼青霉素和咖啡因目前被认为是非ATP竞争型的不可逆PI3K抑制剂,能够通过抑制此途径来降低H2AX和ATM蛋白磷酸化程度[20],本研究中使用2种抑制剂初步探索艰难梭菌A毒素造成DNA双链断裂的可能途径。结果表明,在TcdA组和添加2种抑制剂组γH2AX、pATM蛋白平均阳性率变化不尽相同,具体机制仍在探索当中。
本实验研究目前还存在以下偏差和不足之处:
1) 中性彗星实验中48 h、800 μmol·L-1组的参数显示尾矩和Olive尾矩与对照组相比变化不明显。分析原因,镜下观察发现细胞形态出现异常,免疫荧光染色显示细胞核染呈蓝黑色,胞核发生皱缩或者破裂,提示MEC-1部分细胞可能发生了凋亡,所以凋亡状态下MEC-1细胞彗星的拖尾情况会有所下降,导致实验结果出现偏差。
2) 免疫荧光试验中视野下细胞聚集处γH2AX、pATM Foci直径明显偏大,亮度偏高。通过更改TBS和TTN的漂洗方法步骤发现,这不是由于细胞聚集,荧光染色剂附着太多引起,推测是由于细胞团聚时,TcdA对细胞核DNA造成的损伤范围增大,加之细胞重叠等因素引起。
3) 沃曼青霉素和咖啡因2种抑制剂组是非ATP竞争型的不可逆PI3K抑制剂,本文初步探究了艰难梭菌A毒素通过上述途径引起细胞内组蛋白磷酸化在损伤位点募集、并进行损伤修复的可能性机制,可作为提示TcdA诱导DSB途径的依据,为分析DSB损伤位点提供相关数据。此外,通过定量磷酸化蛋白焦点Foci、细胞增殖试验以及中星彗星电泳试验相结合,可以考虑创建数据函数模型为定量分析损伤程度提供数据支撑。
4) 在探究TcdA诱导MEC-1细胞DNA双链断裂损伤的时间依赖性中,发现12 h和48 h磷酸化H2AX和ATM焦点差异具有显著性,而24 h磷酸化后两者却无差异性,分析认为:①在TcdA引起MEC-1细胞DSB发生后,γH2AX和pATM在损伤处响应集聚,由于γH2AX和pATM焦点数目与DSB灶点是对应数目增加的,理论上两者焦点数量应随着时间逐渐增加,但是24 h磷酸化后两者却无差异性,可能与部分细胞已经进入凋亡早期阶段,影响了对阳性指标的采集有关,同时,数据可靠性可能还与相关焦点量化计数方法有关,后续工作应优化量化损伤灶点的计算指标;②即使免疫荧光实验24 h梯度阳性率差异不显著,结合对中性彗星电泳获取的参数数据和MTT数据,三者相互验证可以说明TcdA在24 h处有效诱导了MEC-1细胞的DNA双链断裂;③基于以上分析,可以考虑构建3项联合实验预测DNA双链断裂的模型,完善实验补充体系。
5) 艰难梭菌A毒素通常以“安全和有效的”量或浓度来使用,这指的是足以产生所需治疗反应而没有发生不良副作用的量。但安全和有效量、治疗和预防有效量将随各种因素而变化,包括所治疗的具体病状、受试者的身体状况、所治疗的受试者类型、治疗的持续时间以及所用的特定制剂等等。随着纳米药物等新型药物载体的研究与发展,对于其在体内产生的副作用等顾虑也会逐渐减小。
4 结 论
艰难梭菌A毒素可作为一种化疗药物,它诱导人黏液表皮样癌MEC-1细胞的DNA双链损伤机制可作为临床低分化型口腔黏液表皮样癌治疗的实验依据。本文通过MTT法、免疫荧光标记法和中性彗星电泳法联合实验探讨了艰难梭菌A毒素诱导MEC-1细胞的DNA双链断裂损伤的机制,发现其与抑制细胞增殖,影响细胞γH2AX、pATM的表达水平密切相关。但是,艰难梭菌A毒素抗肿瘤机制后期仍需进一步深入研究,使其在新型肿瘤药物领域有更大的发展空间。

