食物成分对肠道细胞DNA双链断裂损伤的保护作用及机制研究进展
彭 珍,许晓燕,熊 涛
(南昌大学食品学院,食品科学与技术国家重点实验室,江西 南昌 330047)
DNA双链断裂是最严重的DNA损伤,可引起细胞周期阻滞和细胞增殖障碍,导致基因组不稳定从而诱发免疫缺陷、早衰、肿瘤和神经退行性病变等疾病[1-3]。许多因素如电离辐射、拟辐射化学物质、基因毒性剂和致病菌等均可引起细胞DNA双链断裂[4]。肠道微生物是引起人体肠道细胞DNA双链断裂的主要外源因素,包括致病菌和共生菌在内的微生物可通过毒力因子或黏附素诱导宿主核酸DNA双链断裂和诱发肠癌[5-7]。因此,在日常膳食中摄入有效缓解肠细胞DNA双链断裂的食物是防止肠癌形成的措施之一。本文综述了对肠道细胞DNA双链断裂有保护作用的常见食物成分及其作用机制,并以此为依据提出了益生菌保护肠道细胞DNA双链断裂的可能性,为后续开发有效缓解DNA双链断裂和预防相关疾病的功能性保健食品提供参考。
1 肠道细胞DNA双链断裂及其应答机制
1.1 肠道细胞DNA双链断裂
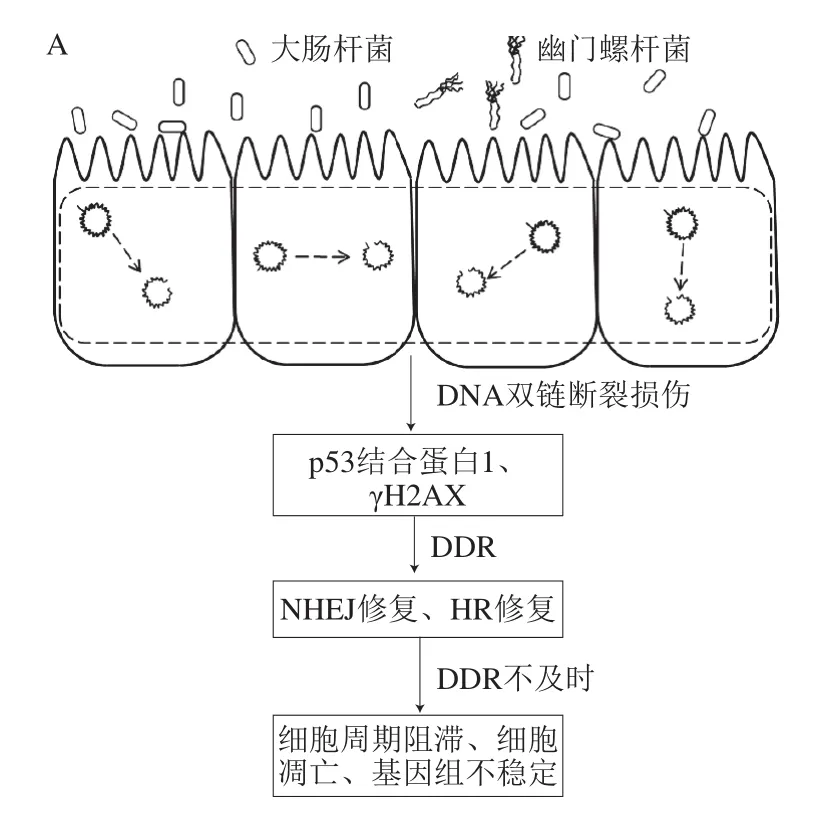
完整的基因组是细胞发挥功能和维持生存的必要条件,多种致病菌或人体共生菌可诱导宿主胃肠道细胞发生DNA氧化损伤,造成DNA双链断裂。2006年,Nougayrède等报道了大肠杆菌诱导HeLa、CHO、A375、IEC-6等细胞形成DNA双链断裂[8]。大肠杆菌IHE3034与HeLa细胞共孵育4 h即造成HeLa细胞体和细胞核渐行性增大,同时有丝分裂消失。采用免疫组化技术检测到DNA双链断裂标志物——组蛋白H2AX磷酸化(histone H2AX phosphorylation,γH2AX),该损伤导致细胞周期阻滞于G2/M期。细胞周期阻滞通常由细胞致死膨胀毒素、周期抑制因子、细胞毒性坏死因子或α-溶血素诱导形成,而敲除了上述毒力基因的大肠杆菌IHE3034同样能造成细胞周期阻滞,说明引起DNA双链断裂的大肠杆菌细胞毒素并不是以上毒素。随后,通过构建大肠杆菌转座子突变体发现,编码肽聚酮的pks毒力岛是造成HeLa细胞DNA双链断裂的关键。人体粪便中分离到的大肠杆菌中,约有34%含有pks毒力岛,该毒力岛普遍存在于B2型大肠杆菌中。为了探索DNA双链断裂对机体造成的后果,构建了大肠杆菌诱导的DNA双链断裂小鼠模型,并通过该模型证实了大肠杆菌诱导的DNA双链断裂与肠癌密切相关[9]。近年来,有报道指出普遍存在于大肠杆菌的外膜囊泡诱导HeLa细胞产生了γH2AX,说明部分人体共生菌也可引起DNA双链断裂和造成基因组不稳定[10]。
幽门螺杆菌慢性感染人胃黏膜是形成胃癌的主要原因。Toller等提出幽门螺杆菌诱导形成胃癌的机制可能是该菌与胃的长期共存过程中造成了胃细胞DNA双链断裂积累,随后通过体内外实验证实了幽门螺杆菌依赖黏附素BabA而非Cag毒力岛引起DNA双链断裂,且该损伤与胃癌的形成密切相关[11]。胃与肠道是相邻的上下消化道,有文献报道了幽门螺杆菌感染胃部的同时造成了肠道炎症,推测幽门螺杆菌对肠道细胞也造成了DNA双链断裂[12]。
1.2 肠道细胞DNA双链断裂应答机制
致病菌诱导宿主DNA双链断裂的同时触发了机体DNA损伤修复(DNA damage repair,DDR)机制,在产生损伤标志物γH2AX的同时招募早期修复蛋白,即p53结合蛋白1进行DDR。一方面,发生DNA双链断裂的细胞通过激活非同源末端连接(non-homologous end joining,NHEJ)修复或同源重组(homologous recombination,HR)修复两条互补竞争的通路进行快速修复或无损修复[13],选择何种修复方式主要取决于受损时的细胞周期。HR修复要求有同源DNA模板,常发生在姐妹染色体已形成的晚S期和G2期;NHEJ修复则主要对G1期和早S期的DDR负责。其中,NHEJ修复通路依赖DNA蛋白激酶DNA-PK磷酸化形成p-DNA-PKcs和p-Ku70/80,进而诱导下游DNA连接酶IV和X射线修复交叉互补蛋白4进行损伤修复[14]。HR修复通路则主要依赖上游“感应器”磷酸化形成磷酸化毛细血管扩张性共济失调症突变蛋白(phosphorylated ataxia telangiectasia-mutated protein,p-ATM),进而调节下游BRCA1和RAD51/52等工具酶进行损伤修复[4]。另一方面,受损细胞启动细胞周期检查点((checkpoint,CHK)1,CHK2)调节p53、p21等基因引起细胞周期阻滞和减缓细胞增殖,为DDR争取时间[15]。幽门螺杆菌和大肠杆菌造成胃肠道DNA双链断裂后会引起短暂的染色体畸变,细胞周期阻滞于G2/M期,随后分别激活细胞NHEJ和HR修复通路进行DDR[9,16]。若未及时进行DDR或修复精度不高则会引起基因组不稳定,肠道菌通过长期低剂量的基因损伤能促进宿主肿瘤或癌症的形成。因此,探究有效缓解DNA双链断裂的食物成分对于预防DNA双链断裂造成的相关疾病具有重要意义。
2 食物成分对肠道细胞DNA双链断裂的保护作用及其机制
部分致病菌感染宿主可激活机体初级保护机制,即通过产生活性氧(reactive oxygen species,ROS)来抑制致病菌,而ROS能够同时引起宿主自身DNA双链断裂[16-17]。对于此类微生物造成的DNA双链断裂,具有抗氧化功能的食物成分可通过缓解氧化应激而起到缓解DNA双链断裂的效果;而对于非氧化胁迫引起的DNA双链断裂,食物成分还可通过调节DDR来提升损伤修复速率或精度进而起到缓解DNA双链断裂的效果。基于此,食物成分主要通过抗氧化作用、调节DDR和抗氧化的同时调节DDR 3 种机制发挥DNA双链断裂保护作用,且不同食物成分的作用机制和靶细胞存在差异(表1)。
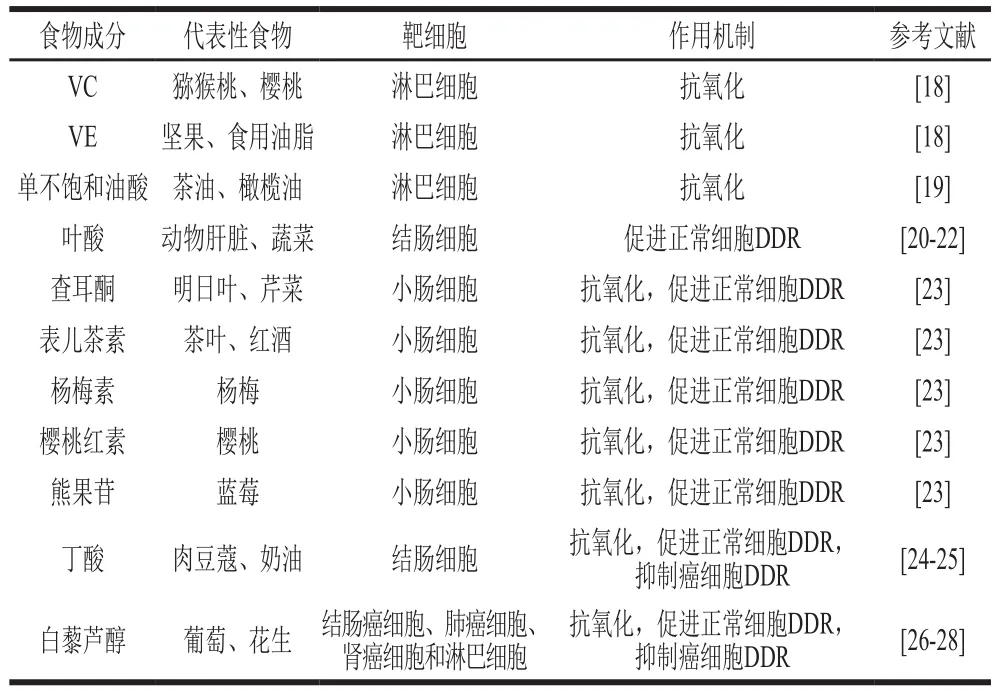
表1 不同食物成分对细胞DNA双链断裂的保护作用Table 1 Protective effects of different food ingredients on cellular DSBs
2.1 抗氧化类食物成分
作为抗氧化剂,VC通过清除ROS为氧化应激造成的细胞损伤提供保护[29]。VE(α-生育酚)是一种人体必需的脂溶性抗氧化剂,可清除脂质环境中的过氧化氢自由基,在保护红细胞膜和神经组织方面起重要作用。有文献报道了VC和VE预防癌症[30]和治疗神经退行性疾病[31-32]的功能,而该功能的作用机制是否与保护宿主细胞DNA双链断裂相关尚未可知。值得注意的是,Brand等报道了VC、β-胡萝卜素和VE具有缓解人外周血淋巴细胞DNA双链断裂的作用,其分别将DNA双链断裂标志物γ-H2AX灶点水平下调了25%、15%和12%,而不同抗氧化剂相互组合后未呈现叠加效应。该研究还通过体外实验发现,此类抗氧化类物质对DNA双链断裂的缓解效果并非与作用时间呈线性相关,而是先呈正相关再呈负相关,提示抗氧化类食物对机体DNA双链断裂的保护作用具有时效性[18]。
国外有大量文献报道了长期食用橄榄油具有延缓衰老的作用。Quiles等采用不同种类的油脂辅助饲喂大鼠24 个月,发现初榨橄榄油可直接调节大鼠血浆总抗氧化能力,进而缓解外周血淋巴细胞DNA双链断裂和调节脂质代谢水平,相比较而言,富含单不饱和油酸的橄榄油对机体DNA损伤更小,而富含多不饱和亚油酸的葵花籽油会造成细胞更为严重的DNA双链断裂[19]。体内外实验均证实VC、VE和单不饱和油酸对淋巴细胞DNA双链断裂有缓解作用,有关其对肠上皮细胞DNA双链断裂的调节作用有待深入研究,以期为预防结直肠癌提供理论依据。
2.2 调节DDR类食物成分
肠道微生物引起的DNA双链断裂未及时修复或修复精度不高则会引起基因组不稳定,长期低剂量的DNA损伤将促进宿主肿瘤或癌症的形成(图1A)。与DDR调节相关的食物成分如叶酸具有缓解DNA损伤的作用,叶酸与DNA甲基化密切相关,叶酸摄入不足将造成DNA低甲基化并增加形成DNA损伤的风险。大量实验证实,摄入足量叶酸对于维护体外细胞、动物和人体基因序列稳定性、DNA完整性和正常的DDR功能具有重要意义[33]。Sohn等发现大鼠连续5 周摄入叶酸虽然上调了结肠细胞p53基因转录水平,但对p53基因启动子及外显子第6~7个碱基的甲基化状态并无显著影响,推断可能是p53基因外显子第6~7个以外的甲基化与结直肠癌相关[20]。p53外显子第5~8序列损伤的基因缺陷型大鼠摄入足量叶酸后,其患结肠癌风险降低,推测其作用机理在于叶酸通过小分子RNA(microRNAs,miRs)缓解了p53外显子第5~8序列损伤,提升了p53基因完整性,故而促进DDR和缓解DNA双链断裂[21-22](图1B)。miRs在DDR的调控中起重要作用,食物类生物活性物质借助miRs影响大量基因的活性。大部分食物类生物活性物质通过6 个共同的miRs(miR-16、miR-25、miR-21、miR-181a、miR-146b和miR-34a)发挥基因调节作用[34]。其中,miR-21参与DNA损伤诱导的G2/M检查点[35],其对结肠癌细胞的细胞周期调控蛋白Cdc25A及细胞周期进程进行负调控[36]。miR-34家族是抑癌基因p53的直接转录靶点,miR-34a的激活使p53能够调节大量DDR基因的表达[37]。反之,miR-34a基因的异位表达将下调一组促进细胞周期进展相关基因的表达并导致细胞在G1期发生阻滞[38-40]。
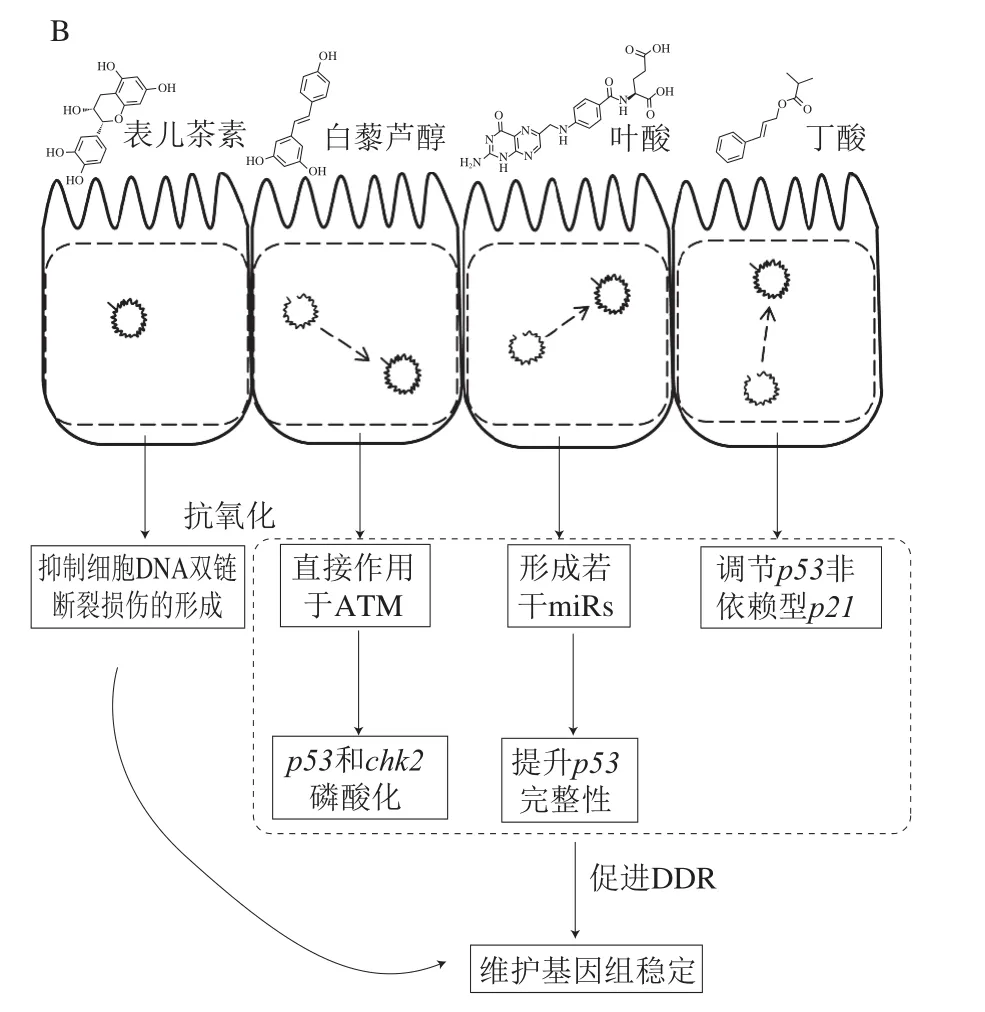
图1 微生物对肠道细胞的DNA双链断裂(A)和食物成分对DNA双链断裂的调节作用(B)Fig.1 DSBs caused by microbes in intestinal cells (A) and regulatory effect of food ingredients on DSBs (B)
外源物质还可通过一类新的非编码miRs,即DNA损伤反应RNAs(DNA damage response RNAs,DDRNAs)调节DNA双链断裂修复,该DDRNAs依赖于DNA双链断裂处产生的RNA水解酶DROSHA和DICER。如抗生素依诺沙星通过刺激DNA双链断裂的染色体和功能失调的端粒产生DDRNAs,该DDRNAs能够促进损伤部位积累p53结合蛋白1并最终抑制HR修复,并将DNA修复方式转变为NHEJ修复来快速修复神经元细胞的DNA双链断裂,缓解了小鼠神经退行性病变[41]。食物成分利用DDRNAs机制调控DNA损伤反应鲜见报道,有待进一步深入研究。
2.3 兼具抗氧化和调节DDR作用的食物成分
大量研究表明,多酚的强抗氧化作用有助于预防癌症,而近年来研究发现,多酚对DDR的调节是其预防疾病的另一种机制(图1B)。Charles等评价了12 种天然多酚(熊果苷、姜黄素、吲哚-3-甲醇、芹菜素、黄芩素、查耳酮、表儿茶素、染料木素、杨梅素、柚皮素、槲皮素和樱桃红)对DNA双链断裂损伤和癌症的预防效果,其中5 种天然多酚(查耳酮、表儿茶素、杨梅素、樱桃红和熊果苷)明显激活了正常人小肠细胞FHS 74 Int的NHEJ修复通路,并促进了DNA双链断裂处的末端连接,而另外3 种天然多酚(芹菜素、黄芩素和姜黄素)则抑制了DDR[23]。5 种天然多酚在体外实验表现出其对NHEJ修复通路的激活效应,有关其在体内通过调节DDR来预防癌症的作用机制值得进一步研究。
白藜芦醇具有延缓衰老[26]和预防癌症[27]的作用,已成为近年来研究的热点。与上述5 种天然多酚作用机制不同的是,白藜芦醇通过直接作用于ATM/共济失调毛细血管扩张Rad3相关蛋白(Rad3-related protein,ATR)促使DDR从NHEJ转向HR来提高淋巴细胞DNA双链断裂的修复效果[28](图1B)。对癌细胞而言,白藜芦醇同样通过直接激活ATM来调节p53基因表达,促进结肠癌细胞、肺癌细胞和肾癌细胞凋亡进而抑制癌细胞增殖和防止癌症恶化[26]。
富含天然多酚的蓝莓能够有效地缓解癌症等疾病,其作用机理之一是蓝莓中花青素和花色苷的抗氧化作用[42]。然而,Liu Wei等研究发现蓝莓不同组分(水提取物、甲醇提取物和乙醇提取物)不仅具有抗氧化作用还有调节DDR的功能[43]。其中,甲醇提取物(主要活性成分为花青素)通过活化p53基因来维护基因组稳定,但该研究使用的细胞模型为肝癌细胞,对于花青素在人体内是否会促进癌细胞DDR进而导致癌细胞增殖和癌症恶化有待深入研究。因此,花青素的DNA双链断裂保护效果有待借助多种体内外模型进行全面评估。有研究指出,多酚只有在低剂量下才能更好地发挥防癌作用,剂量过高反而会对机体造成DNA损伤[44]。
丁酸作为一种短链脂肪酸能有效地维持人体细胞正常生理功能和预防人结肠细胞凋亡[45-46]。丁酸的结构决定了其不具备清除自由基的能力,有研究报道了其通过缓解氧化胁迫来保护DNA的作用,但其作用机理尚不清楚[47-49]。Toden等研究发现,抗性淀粉经肠道微生物代谢生成的丁酸缓解了大鼠结肠细胞DNA双链断裂[24],可能是由于丁酸上调了p53非依赖性p21基因的表达,促进了DDR[25](图1B)。
3 益生菌对肠道细胞DNA双链断裂的保护作用
目前有关食物成分缓解人体和动物DNA双链断裂的报道并不多。因此,开发有效预防DNA双链断裂的新型资源是一个重要的研究方向。大量研究表明,益生菌可通过抑菌作用、增强机体免疫和改变肠道屏障通透性等多种机制来改善肠道功能和缓解肠道疾病[50-53],因此,微生态制剂的开发成为当前研究的热点。已有研究报道了益生菌对人体和动物DNA损伤的保护作用,主要集中于乳酸菌对宿主DNA单链断裂损伤修复的调节[54-56],其对开发有效缓解DNA双链断裂的益生菌具有深远意义。1)益生菌具有抗氧化作用。不同的益生菌菌株可通过不同机制抵抗ROS,包括过氧化自由基、超氧阴离子自由基以及羟自由基[57-58]。益生菌的抗氧化机制包括自身的抗氧化物酶(超氧化物歧化酶和过氧化氢酶)、抗氧化代谢产物(谷胱甘肽)和调节人体或动物体内的抗氧化信号通路(核因子E2相关因子2-胞质伴侣蛋白-抗氧化反应元件和核因子κB)等[59]。如动物双歧杆菌01株的培养上清液、完整细胞和细胞内提取物均可清除羟自由基与超氧阴离子自由基,提升小鼠体内抗氧化酶活性,增强小鼠的抗衰老能力[60]。此外,益生菌还可通过发酵底物来提升抗氧化活性,用4 种瑞士乳杆菌953、474、1188、1315发酵牛奶可以不同程度地释放多种生物活性化合物,此类化合物显著提升了发酵奶的抗氧化活性和预防结肠癌的潜力[61]。2)益生菌代谢生成具有DDR调节功能的叶酸。双歧杆菌属具有合成叶酸的能力,这些菌株大部分属于青春双歧杆菌和假链状双歧杆菌。用此类益生菌制剂饲喂大鼠能够提升其血浆的叶酸水平,证实此类益生菌定植大鼠肠道后代谢生成叶酸并被机体吸收。进一步将该制剂用于人体实验发现,益生菌制剂提升了人粪便中的叶酸浓度[62]。此外,植物乳杆菌由于能够合成对氨基苯甲酸故而也能代谢产生叶酸。3)益生菌代谢生成具有DDR调节功能的丁酸。益生菌在肠道内发酵产生多种短链脂肪酸,其中丁酸占5%[63],结肠细胞能量的70%依赖于丁酸[64-65],丁酸盐在促进正常结肠上皮细胞生长的同时还可诱导大肠癌细胞凋亡[66]。双歧杆菌和产丁酸菌交叉饲喂可提高人体肠道丁酸盐水平和预防结直肠癌,除双歧杆菌外,丁酸产生菌还包括普拉梭菌(Faecalibacterium prausnitzii)、丁酸弧菌属(Anaerostipes)、优杆菌属(Eubacterium)和罗斯氏菌属(Roseburia)[67]。因此,尽管鲜有益生菌缓解宿主细胞DNA双链断裂的报道,益生菌的抗氧化活性、代谢生成叶酸和丁酸等性质决定了其具有缓解宿主细胞DNA双链断裂的潜能,有关其对体内外细胞DNA双链断裂的缓解效果有待进一步研究。
4 结 语
肠道细胞的DNA双链断裂与肿瘤和癌症的形成密切相关,食物成分可通过缓解宿主肠上皮细胞DNA双链断裂起到预防结直肠癌的作用。食物成分发挥DNA双链断裂保护作用的机制包括抗氧化作用、调节DDR和抗氧化同时调节DDR。应注意的是,此类食物成分的摄入具有特殊性,对正常细胞DNA双链断裂具有缓解作用的食物成分作用于非正常细胞(如癌细胞)时,可能会促进癌细胞的增殖。因此,有关此类食物成分的功能研究应囊括正常细胞模型和癌细胞模型,以更全面地评价其维护机体健康的效果。此外,此类食物成分对DNA双链断裂的保护效果与摄入剂量和摄入时间有关,因此,在设计体内实验时还应考察不同剂量和摄入时间的影响以获得最佳保护效果。基于已报道的食物成分对DNA双链断裂的保护机制,结合益生菌自身抗氧化和代谢生成叶酸和丁酸的特征,推断益生菌具有缓解DNA双链断裂的潜能,揭示益生菌有维护宿主基因组稳定的功能。在将来的研究中,应对于此类功能益生菌进行深入研究,为进一步开发预防基因疾病的益生菌类保健食品提供理论依据。

