单核细胞/高密度脂蛋白比值与脑小血管病的相关性分析
姬 燕 杨荣礼 吕金峰 谢 翼 丁 鑫
脑小血管病(cerebral small-vessel disease, CSVD)是指由于脑血管和脑实质结构改变所引起的各种临床表现、病理过程、神经影像学特征的综合征。在所有缺血性脑血管疾病中,CSVD占缺血性脑卒中的25%,而且CSVD也使患者发生脑卒中的风险增加。此外,CSVD是老年人功能丧失、残疾和认知能力下降的主要原因[1]。
单核细胞/高密度脂蛋白比值(monocyte/high density lipoprotein ratio,MHR)是近年来发现的一种新的炎性标志物[2,3]。单核细胞作为一种独特的白细胞参与了炎性反应的各个阶段,在炎性反应中起到了非常重要的作用[4]。相反,高密度脂蛋白主要通过逆向转运胆固醇,阻止单核细胞黏附在动脉壁上,减少内皮细胞黏附分子的转运和表达从而达到抗炎、抗动脉粥样硬化的特性[5]。因此MHR是一个综合了炎症与血脂的指标,与全身性炎症和血管内皮功能障碍有关。已有证据表明,炎症是脑小血管病的发病机制之一,在CSVD发生、发展中发挥重要作用[6]。目前关于MHR的研究多集中在冠心病、脑卒中、糖尿病并发症等方面,较少在CSVD中进行相关研究[7~9]。因此本研究主要探讨了MHR与脑小血管病患者及其严重程度的相关性,旨在为脑小血管病患者的早期预防及诊疗提供参考。
对象与方法
1.研究对象:选取2018 年 9 月~2020 年 9 月徐州医科大学附属医院神经内科收治的CSVD患者400例作为观察组,对照组随机选取同期住院且符合排除标准的非CSVD患者200例。观察组入选标准:①符合脑小血管病诊断标准[10];②行脑部磁共振(MRI)的检查,MRI上至少有1种典型CSVD表型;③年龄≥50岁。排除标准:①既往有颅内外大血管病变、颅脑外伤、颅内肿瘤、合并大面积脑梗死、脑出血病史等;②机体有急性或慢性炎症者;③恶性肿瘤,有严重的脏器衰竭;④自身免疫性疾病、中毒、脱髓鞘疾病、遗传变性、脑积水等明确原因所引起的影像学改变;⑤服用降脂药者。
2.数据收集:记录患者性别、年龄、是否合并高血压、糖尿病以及实验室检查(包括血常规、血脂、FIB、HCY)等。实验室检查项目采集受试者空腹静脉血,并计算 MHR(MHR=单核细胞/高密度脂蛋白)。
3.影像学检查:总CSVD负荷评分标准如下:(1)腔隙:定义为一个圆形或卵圆形、皮质下充满液体的空洞(信号类似脑脊液),T1加权为低信号,T2加权为高信号,直径≥3mm、<15mm的病灶。(2)脑微出血:在GRE图像上表现为<10mm的点状低信号病变。(3)脑白质高信号:脑室周围或深部脑白质高信号依据Fazekas评分系统确定脑白质高信号的程度。脑室周围脑白质Fazekas评分为3分或深部脑白质≥2分提示高级别脑白质病变。(4)血管周围间隙:定义为基底节区T2加权成像上<3mm的点状和(或)线状高信号病变。基底节区2~4级PVS被定义为高级别血管周围间隙。根据上述4种头颅MRI的影像学标志物,每项达到标准计1分,CSVD总负荷评定为 0~4 分[11]。根据总CSVD得分将患者分为3组:轻度组(0~1分)、中度组(2分)、重度组(3~4分)。所有获得的影像学图像均由两名神经影像学专家采取完全随机阅读的方式对影像资料按照CSVD专家共识进行盲审,如有意见不统一,则共同商议决定[10]。

结 果
1.对照组与观察组临床资料比较:两组患者年龄、性别、高血压比例、糖尿病比例比较,差异无统计学意义(P>0.05);两组患者单核细胞与高密度脂蛋白比值(MHR)、单核细胞(M)、高密度脂蛋白(HDL)、同型半胱氨酸(HCY)、纤维蛋白原(FIB)比较,差异有统计学意义(P<0.05,表1)。
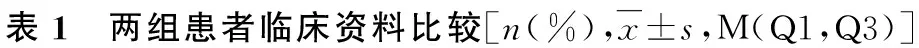
2.按严重程度分组的3组患者的临床资料比较:3组患者性别、糖尿病比例比较,差异无统计学意义(P>0.05);3组患者高血压比例、年龄、MHR、M、HDL、HCY、FIB比较,差异有统计学意义(P<0.05,表2)。

3.观察组发生CSVD的影响因素分析:以发生CSVD为因变量,以单因素分析中差异有统计学意义的指标为自变量进行多因素Logistic回归分析。MHR、FIB、HCY是发生CSVD的危险因素,HDL是发生CSVD的保护因素(P<0.05,表3)。
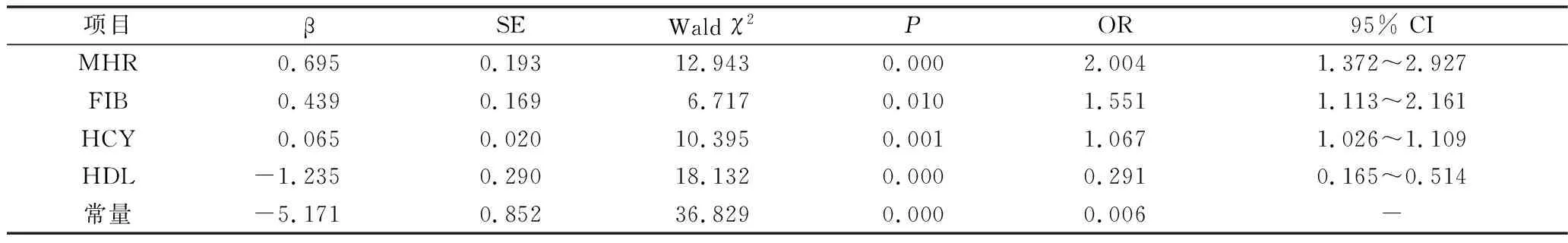
表3 CSVD的多因素Logistic回归分析
4.CSVD患者严重程度的影响因素分析:以CSVD的严重程度为因变量,以单因素分析中差异有统计学意义的指标为自变量进行有序Logistic回归分析。MHR、高血压、年龄、FIB、HCY是影响 CSVD患者严重程度的危险因素,HDL是影响 CSVD患者严重程度的保护因素(P<0.05,表4)。
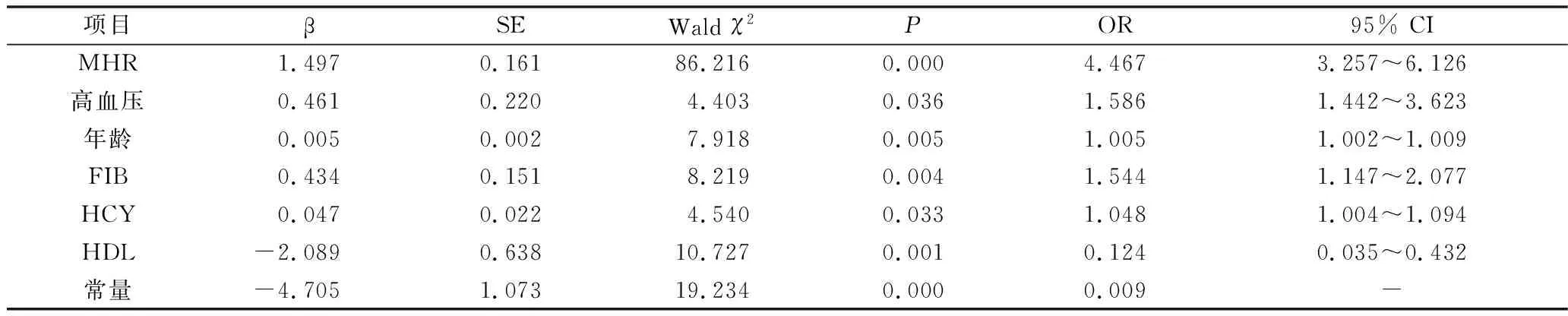
表4 影响CSVD严重程度的有序Logistic回归分析
5.MHR对CSVD的评估价值:ROC曲线分析结果显示,MHR的ROC曲线下面积为0.797(95%CI:0.763~0.829,P=0.000),当分界值为0.24时,敏感度和特异性分别为69.25%和78.00%(图1)。
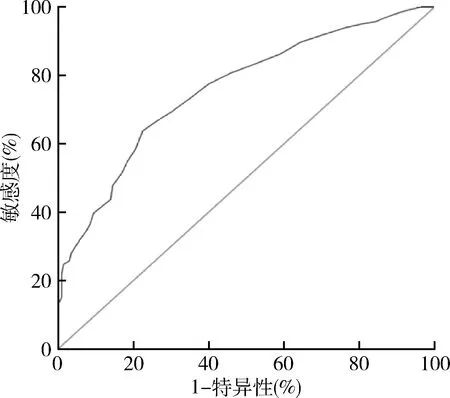
图1 MHR诊断CSVD的ROC曲线
讨 论
随着神经影像学技术的发展和普及,大量CSVD病例被识别和发现,日益受到临床医生的重视。目前,CSVD的发生机制尚不明确,相关研究认为炎性反应、弥漫性血管内皮损伤是引起CSVD的主要病理机制。炎性反应主要通过介导内皮功能障碍、破坏紧密连接蛋白、重塑细胞外基质、激活胶质细胞等途径参与到 CSVD 的发生、发展过程中[12]。
单核细胞参与促炎性细胞因子的释放,激活的单核细胞通过调节炎性细胞因子介导炎症与氧化应激过程,同时也参与机体内源性炎性反应[13]。Rouhl等[14]研究发现,单核-吞噬细胞的活化标志物新蝶呤在CSVD患者中表达增高,表明活化的单核-吞噬细胞在CSVD的病理生理中发挥重要作用。随年龄增加,单核细胞对炎症的抵抗力下降,且会向炎症表型转化。位于中枢神经系统的小胶质细胞来源于单核细胞,小胶质细胞/巨噬细胞的激活会释放蛋白酶和自由基,参与CSVD的炎症过程,对细胞外基质和神经血管单元产生不可逆性损害[15]。而HDL及其主要蛋白质成分载脂蛋白A1抑制CD11b的激活,通过单核细胞抑制炎性反应。低HDL水平可诱导单核细胞CD16水平上调,进而导致促炎型单核细胞水平升高[16]。也有相关研究表明,CSVD患者HDL水平较无CSVD患者降低。王亚男等[17]关于脑小血管病患者认知功能的相关性研究中说明认知功能受损的CSVD患者中HDL水平显著低于对照组,且HDL是CVSD患者认知功能障碍的保护因素。本研究结果也表明,CSVD患者HDL较对照组降低且是CSVD患者及严重程度的保护因素。目前关于HDL与CSVD的研究较少,推测HDL参与CSVD的机制可能是由于其具有保护血管内皮、抵抗炎症等作用。MHR结合了两种常规的生物学指标,被认为是一种可以反映体内炎症的生物学标志物。本研究将MHR作为一种炎性标志物与CSVD的发病机制相联系。同时MHR也与动脉粥样硬化性疾病相关,CSVD与动脉粥样硬化有共同的危险因素。多因素Logistic回归分析表明,MHR是CSVD的危险因素。ROC曲线显示MHR的ROC曲线下面积为0.797(95% CI:0.763~0.829,P=0.000),敏感度和特异性分别为69.25%和78.00%,具有良好的诊断价值。
由于CSVD相对于普通卒中临床症状轻、病死率低,CSVD的发生常被忽视,特别是在早期。因此,神经影像学已经成为诊断CSVD和无症状神经血管疾病的重要工具。CSVD患者常表现为多种影像学表型共存[18]。本研究参照相关文献对CSVD的影像学特征进行评估,获得总CSVD负荷评分。该评分用来评估CSVD对大脑的整体影响,而不是只单独评估其中一种影像学表现,有助于CSVD的量化和分层。高CSVD负荷可导致神经血管网络受损、神经退行性病变,对脑卒中后恢复及预后产生不利影响[19]。本研究结果显示,MHR是影响CSVD患者严重程度的危险因素,MHR值越高,可能预示着CSVD患者的临床症状可能会更严重。在CSVD患者中应关注此生物学标志物,以期在早期阶段通过目前调脂方面使用广泛的他汀类药物、HDL-C靶向治疗及抗炎等相关治疗措施进行干预,延缓CSVD的进展,提高患者的生存质量。
目前研究较多的CSVD相关炎性标志物主要包括C反应蛋白、肿瘤坏死因子-α、白细胞介素6、脂蛋白相关磷脂酶A2等炎性细胞因子。但是传统炎性标志物的成本高,难以解释异常结果以及可能的进一步检测限制了其临床应用。而MHR可以通过常规检查的白细胞亚群、高密度脂蛋白胆固醇计算出来,是容易获得的炎性标志物,具有更广泛的应用。
综上所述, MHR升高是CSVD患者及严重程度的独立危险因素,且MHR对CSVD具有一定的诊断价值。但本研究是单中心回顾性研究,未来还需多中心、前瞻性研究进一步探讨MHR与CSVD患者的关系。

