亚精胺浸种对盐碱胁迫下香椿种子萌发的影响
闫聪 赵胡 樊明琴

摘 要:以红香椿种子为材料,用0.3mmol·L-1亚精胺浸种处理12h,设置浓度为0、25、50、100mmol·L-1的混合盐碱溶液模拟盐碱环境,研究亚精胺浸种对盐碱胁迫下香椿种子萌发、幼苗生长以及盐碱抗性的影响。结果表明:在盐碱胁迫下,香椿种子的发芽率、发芽势、发芽指数、胚根长度以及香椿幼苗的存活率、根长均显著下降;种子中的抗氧化酶、淀粉酶活性以及幼苗中的抗氧化酶活性、脯氨酸含量均有所上升。亚精胺浸种通过进一步提升抗氧化酶、淀粉酶的活性、增加脯氨酸的含量,有效地缓解了盐碱胁迫对香椿种子及幼苗造成的损害,使种子及幼苗的表观指标显著增长。由此可见,0.3mmol·L-1亚精胺浸种能够有效促进盐碱胁迫下香椿种子的萌发及其幼苗的生长,并提高香椿幼苗对盐碱的抗性。
關键词:亚精胺;香椿种子;萌发;盐碱胁迫
中图分类号 S644.4文献标识码 A文章编号 1007-7731(2021)22-0036-07
Effect of Spermidine Soaked Seed on Germination of Toona sinensis Seed under Saline and Alkali Stress
YAN Cong1 et al.
(1School of Biology and Food Engineering Institute, Fuyang Normal University, Fuyang 236037, China)
Abstract: The seeds of Toona sinensis were treated with 0.3mmol·L-1 exogenous Spermidine solution for 12 hours. The mixed saline alkali solutions of 0, 25, 50 and 100mmol·L-1 were set to simulate the saline alkali environment. The treated seeds were divided into groups and placed in the above simulated saline alkali environment for germination test seedling growth and related enzyme activities. It proved that the germination rate, vigor index and radicle length of Toona sinensis Seeds decreased significantly under saline alkali stress. The survival rate and the length of aboveground and underground parts of Toona sinensis seedlings also decreased significantly under saline alkali stress. Under the same saline alkali conditions, the germination speed, vigor index and radicle length of the seeds treated with Spermidine were higher than those treated with distilled water. After the seeds treated with Spermidine grew into seedlings, the survival rate and the length of aboveground and underground parts of the seedlings treated with Spermidine were also higher than those treated with distilled water. In addition, Spermidine soaking can improve the activities of amylase and antioxidant enzymes in seeds, increase the activities of antioxidant enzymes and proline content in seedlings, so as to effectively alleviate the damage caused by saline alkali stress. In conclusion, 0.3mmol·L-1 Spermidine soaking can effectively promote the germination of Toona sinensis Seeds under saline alkali stress, and improve the adaptability of seedlings under saline alkali environment.
Key words: Spermidine; Toona sinensis seed; Germination; Saline-alkali stress
香椿(Toona sinensis)为楝科香椿属的落叶乔木,在我国长江南北地区分布广泛。香椿在春季萌发的新芽由于具有其特殊的风味而深受人们的喜爱,具有较高的市场价值。香椿适宜在土壤肥沃且湿润、光照充足的环境中栽植,适宜其生长的土壤酸碱度在pH5.5~8.0。目前,对香椿幼苗在胁迫条件下的生理特性变化以及外界因素对香椿种子萌发的影响被越来越多的人所关注。
盐碱胁迫是对植物正常生长发育起阻碍作用的非生物胁迫,也是制约经济作物生产和影响生态环境建设的严峻问题。首先,它具有超出适宜植物生长范畴的盐浓度而产生的盐胁迫,这一因素会引发渗透胁迫、离子毒害、氧化应激等不利影响。其次,在碱胁迫下,pH的升高会与盐胁迫引发的次生盐害共同作用,对植物的根系产生更严重的损害,植物对矿物质的吸收受阻,进而使植物体受到严重的营养胁迫[1-2]。植物内部用以维持自身正常生长的稳态环境被打破,各种代谢活动出现明显的变化。植物在盐碱胁迫下,会采取一系列的调控措施来应对不良因素的影响。此时,植物体内的一些重要的酶、活性物质以及与这一调控过程相关的生理生化成分都将发生明显的改变。与此同时,还可以从较为直观的层面即植物的外部形态与生长发育状况来推断其所受胁迫损伤的程度。植物在表观层面所呈现出对盐碱胁迫的响应,集中表现在地上与地下生物量的分配。混合盐碱胁迫下,植物高度、叶片数、茎长及地上部干物质重均有所下降,地下部分含水量和幼苗根长下降[3],导致盐碱胁迫下植物的萌发率明显下降以及植株的成活率显著降低。研究作物的耐盐碱机理,对于开发和有效利用盐碱地有重要的现实意义[4]。
亚精胺(spermidine,Spd)又称三盐酸亚精胺,是一种广泛存在于植物体内的多胺类物质,由于与胁迫状态下植物的抗逆性密切相关,被视为提高植物应对逆境抵抗能力的优良材料。植物在环境压力下,体内活性氧的含量大幅升高,膜脂因发生过氧化及脱脂化作用而受到损伤,进而影响到植株的正常代谢[5]。此时,采用适宜浓度的外源亚精胺溶液进行处理,可以使植物积累渗透物质,提高抗氧化酶等代谢调节相关的酶的活性,以此有效缓解渗透胁迫以及代谢失调所造成的伤害,进而使其抗逆性得到提升。
目前,对于外源亚精胺试剂浸种可以提高植物种子的萌发率、增强其萌发后对不良环境的适应能力的研究,已经在多类植物中得到证明。亚精胺浸种可以提高白三叶草种子在渗透胁迫下的萌发能力,同时提高其幼苗对该胁迫环境的适应性,这可能与亚精胺能够增强三叶草种子内的淀粉酶活性有关[6]。亚精胺浸种也被证实可以提高番茄种子的萌发能力,促进番茄幼苗的生长,并且能够提高番茄幼苗对高温的抗性[7]。此外,随着近年来围绕如何有效利用盐碱土地的研究被越发重视,有关提升植物在盐碱胁迫下的萌发能力以及幼苗在盐碱环境下的抗性也成为了研究热点。亚精胺也被证实能够有效提升植物的盐碱抗性。经过亚精胺浸种处理的苜蓿种子,有效缓解了盐碱胁迫所造成的伤害[8]。但关于亚精胺能否促进盐碱胁迫下香椿种子的萌发,能否提升香椿幼苗在盐碱胁迫下的适应能力,这一研究方向还没有详细的报道。
世界上约有20%的耕地受到盐碱化的影响,且恶化程度逐年增大[9]。预计到2050年,50%以上的耕地会因盐碱化而无法正常栽植作物[10],届时可用耕地进一步缩减将会导致作物产量的显著下降,这将会给蔬菜作物安全带来不小的冲击。结合盐碱土地的利用问题以及多胺类物质可以有效提高植物抗逆性的特点,本试验以红香椿种子为试验材料,研究亚精胺浸种对盐碱胁迫下香椿种子萌发和幼苗生长的影响。试验中记录表观层面特征指标的变化,同时选取不同时间点的试验材料进行淀粉代谢的动态分析,对比不同处理下过氧化物酶、超氧化物歧化酶等重要酶的活性差异,以期寻找到得以提升盐碱胁迫下红香椿种子萌发能力的有效途径,为证明试验结果的准确性以及理解本试验涉及的相关机制提供依据。
1 材料与方法
1.1 试验材料 试验材料选自产地为陕西安康的红香椿种子,其来源于陕西秦巴红叶生态农林开发有限公司,种子为去翅处理后的无翅净籽状态。材料采购后置于阜阳师范大学植物生理学实验室的冰箱中进行冷藏保存。
1.2 试验方法
1.2.1 香椿种子处理与盐碱胁迫 在进行正式的萌发试验前,需要按照试验设置的组别挑选红香椿种子。选种要求为籽粒饱满、大小均匀、色泽明亮的个体,数量设置为每组60粒。本次试验设置2个平行试验组,即蒸馏水浸种处理组与0.3mmol/·L-1亚精胺浸种处理组。浸种处理结束后,各组将继续细分为4个处理,分别在0、25、50、100mmol·L-1的盐碱溶液中进行萌发实验,盐碱试剂为0、25、50、100mmol·L-1混合盐碱溶液(将氯化钠、碳酸氢钠、硫酸氢钠、碳酸钠按照1∶9∶9∶1的比例溶于蒸馏水配置成盐碱溶液,pH为8.5±0.1)。本次试验共计8个组别。每个组别重复3次,各项表观指标与生理指标同样进行3次重复测定。
为方便后续操作与区分,将8个试验组命名如下:以蒸馏水浸种处理的称为CK组,依据后续萌发实验中种子所处盐碱环境的区别,将CK组的4个處理分别命名为CK0、CK25、CK50、CK100;以亚精胺浸种处理的称为S组,同样依据萌发实验中种子所处盐碱环境的区别,将S组的4个处理分别命名为S0、S25、S50、S100。按照试验组别的设置,选取8只洁净干燥的烧杯,依此写上8个试验组的名称,每个烧杯中放入挑选好的红香椿种子。选种结束后即可进入消毒阶段。消毒方式为配制浓度为1%的次氯酸钠溶液作为消毒液,将适量的消毒液加入上述盛有种子的烧杯中,进行时长为30min的浸泡消毒。浸泡消毒后需倒尽消毒液并用蒸馏水冲洗多次。
萌发试验的第1步为浸种处理,CK组中加入等量蒸馏水,S组中加入等量浓度为0.3mmol/L的亚精胺溶液,将盛有浸种试剂与香椿种子的烧杯置于恒温箱内静置12h,温度设置为22℃,恒温箱内处于无光照的黑暗状态。浸种处理12h后,取出烧杯并倒尽浸种试剂,用蒸馏水冲洗3次。取24个洁净干燥的培养皿,按照上述试验组别的编号进行标记,并在皿底放入2层洁净的纱布。按照试验组别的设置,在上述培养皿中分别加入等量浓度为0、25、50、100mmol·L-1的混合盐碱溶液。随后,将上述处理好的种子放置于编号相同的培养皿中,用镊子摆放整齐以便后续的观察与记录。将光照培养箱的温度设置为22℃,光照强度设置为0级,相对湿度设置为70%。将上述的培养皿移入培养箱中。
待萌发期指数记录完毕后,幼苗需要继续培养一段时间才能移栽入穴盘。此阶段需将光照培养箱的温度设置为22℃,光照强度设置为4级,光照时长设置为12h/d。待幼苗状态稳定后,再将其移栽入穴盘。穴盘基质为营养土,用水浇透基质使其成较小的团块状,划分好区域并按试验组别进行标记,将对应组别的幼苗移栽入该区域。全部移栽结束后,将其放入阜阳师范大学温室大棚内继续培养。
1.2.2 香椿种子萌发期表观指标的测定方法 萌发试验阶段需要进行为期7d的连续观察。观察中记录每1天的发芽数,并且保证每天于同一时间进行相关数据的统计。选取种子发芽第3天的发芽数为基础数据,进行发芽势的计算。处理萌发阶段记录的萌发数与其对应的萌发天数的比值,进行有关发芽指数的计算。7d连续观察结束后,整理各组最终的发芽数进行发芽率的计算。在萌发试验结束后,于每1个试验组中随机挑选10株胚根完整的香椿幼苗进行胚根长度的测量。由于根系生长过程中易发生弯曲,可用细线紧贴根系从子叶着生处至根尖末梢,随后取下细线并将其伸直即可用直尺测量出对应植株的根长。
计算公式如下:
发芽率(%)=(萌芽种子数/供试香椿种子数)×100%[11];
发芽势(%)=(发芽3d种子发芽数/种子总数)×100%[12];
发芽指数:GI=∑GT/Dt;
式中:GI为发芽指数,Gt为萌发数,Dt为对应的萌发天数[12]。
1.2.3 香椿幼苗期表观指标的测定方法 萌发试验结束后,将状态稳定的香椿幼苗移栽至穴盘,于温室大棚中继续培养30d。培养期结束时,香椿幼苗的真叶完全展开,其根系也适应了基质的环境并有了进一步的生长,适宜进行各项苗期指标的测定。首先进行各组幼苗存活率的统计,随后将其移出基质用直尺测量其地上与地下部分的长度,地上与地下部分区分点为根茎结合处。计算公式如下:
存活率(%)=(现存植株数/移栽总数)×100
1.2.4 香椿种子及幼苗的生理指标的测定方法 萌发试验阶段选取不同处理的种子作为材料,使用氮蓝四唑法进行SOD活性的测定,以比色法进行POD活性的测定,参考李合生所著实验书进行淀粉酶活力的测定[13]。幼苗阶段选取于温室大棚培养30d后的香椿幼苗为材料。选取幼苗真叶部分进行SOD、POD活性的测定,方法同萌发期一致。选取幼苗真叶进行脯氨酸含量的测定,方法为磺基水杨酸法。
1.2.5 数据处理 试验数据用Excel2016软件进行统计并作图,用SPSS20.0软件进行分析,采用最小显著差数法进行显著性检验。
2 结果与分析
2.1 亚精胺浸种对盐碱胁迫下香椿种子表观指标的影响 由表1可知,盐碱胁迫下香椿种子的发芽率、发芽势、发芽指数、根长均随所处盐碱溶液浓度的增高而下降。首先,与CK0相比,以蒸馏水浸种但处于25、50、100mmol·L-1盐碱溶液中进行萌发的CK25、CK50、CK100组的种子,其发芽率显著下降,与CK0相比分别下降了5.57%、13.84%、22.23%。
其次,受盐碱胁迫的CK25、CK50、CK100组,在发芽势、发芽指数方面对比CK0显著下降,发芽势分别下降了16.67%、32.77%、48.89%,发芽指数分别下降了15.54%、36.41%、55.89%。再次,在根长上,CK25、CK50、CK100组与CK0的数据对比可得,CK25根长较CK0差异不显著,CK50、CK100组的根长较CK0组显著下降,CK50、CK100组的根长与CK0相比分别下降了64.71%、80.07%。
香椿可以在微偏碱性的土壤中正常生长,在部分盐碱地区被视为优质的绿化树种。综上可以推测香椿种子可以耐受一定程度的盐碱胁迫,可以在此范围内保持较好的萌发状态。从CK50与CK100组的萌发状态可得,超过一定阈值后盐碱胁迫对香椿种子的萌发会产生较大的影响,在50mmol·L-1的盐碱环境中萌发的香椿其根长已有显著的下降。此外,在萌发试验阶段,CK100组的香椿种子胚根因盐碱胁迫未能正常生长。最后,CK100香椿种子因胁迫程度过高而腐坏在培养基中,未能长成幼苗,也无法收集到足够的材料进行萌发阶段的生理指标的测定。
由表2可知,亚精胺浸种对未受盐碱胁迫红香椿种子的发芽率、萌发后的根长无显著影响,但显著提升了香椿种子的发芽势及发芽指数。
此外,受盐碱胁迫的6组中,经亚精胺浸种处理的S25、S50、S100组显著提高了同等胁迫处理CK25、CK50、CK100组的发芽率、发芽势及发芽指数。S25、S50、S100组与对应的CK25、CK50、CK100组相比,发芽率分别提高了3.34%、6.05%、5.55%,发芽势分别提高了8.34%、6.66%、6.12%,发芽指数提高了6.88%、10.54%、9.03%。
最后,在根长方面,CK0、S0、CK25、S25等4组根长无显著性差异,CK50、S50、CK100、S100等4组根长无显著差异。在0mmol·L-1、25mmol·L-1混合盐碱溶液中萌发的种子,其根长显著大于在50mmol·L-1、100mmol·L-1混合盐碱溶液中萌发的种子。
由此可见,亚精胺浸种促进香椿种子的萌发,一定程度上缓解了盐碱胁迫对香椿种子萌发的抑制作用。
2.2 亚精胺浸种对盐碱胁迫下香椿种子萌发过程中淀粉酶活性的影响 由图1可知,不同处理的α-淀粉酶活性在第0d无显著差异。在种子萌发的第0、3、7天,不同处理的α-淀粉酶活性均呈现出先升后降的变化趋势。CK25、CK50组种子的α-淀粉酶活性在萌发第3天和第7天均显著高于CK0组。CK25组在萌发第3、7天的α-淀粉酶活性对比相同萌发天数的CK0组酶活性,分别提升了18.53%、12.13%。CK50组则分别提升了31.66%和23.70%。S25、S50组种子的α-淀粉酶活性在第3天和第7天均显著高于CK25、CK50組。S25组在萌发第3、7天的α-淀粉酶活性较相同萌发天数的CK25组酶活性,分别提高了9.12%、22.68%。S50组在萌发第3、7天的α-淀粉酶活性较相同萌发天数的CK50组酶活性分别提高了18.77%、55.14%。S0组种子的α-淀粉酶活性与CK0组的酶活性相比,在种子萌发的第0、3、7天均无显著性差异。
由图2可知,在萌发第0天,β-淀粉酶的活性于各组处理之中无显著差异。在种子萌发的第0、3、7天,β-淀粉酶的活性变化在CK0组中呈现先升后降的趋势,而在CK25、S25、CK50、S50等4组中则为持续升高的趋势。
CK25、CK50组种子的β-淀粉酶活力在萌发第3d和第7d均显著高于CK0组。CK25组在萌发第3、7天的β-淀粉酶活性对比相同萌发天数的CK0组酶活性,分别提升了7.13%、92.80%,CK50组则分别提升了17.38%、115.71%。
S25、S50组种子的β-淀粉酶活性在第3天和第7天均显著(P<0.05)高于CK25、CK50组。S25组在萌发第3、7天的β-淀粉酶活性较相同萌发天数的CK25组酶活性,分别提高了13.09%、12.15%。S50组在第3、7天的β-淀粉酶活性较相同萌发天数的CK50组酶活性,分别提高了20.96%、22.08%。S0组种子的β-淀粉酶活性与CK0组的酶活性相比,在种子萌发的第0、3、7天均无显著性差异。
由图3可知,(α+β)-淀粉酶活性,在第0、3、7天的变化趋势与β-淀粉酶活性变化趋势相似。在萌发第0天,(α+β)-淀粉酶的活性于各组处理之中无显著差异。在种子萌发的第0、3、7天,(α+β)-淀粉酶的活性变化在CK0组中呈现先升后降的趋勢,而在CK25、S25、CK50、S50等4组中则为持续升高的趋势。
CK25、CK50组种子的(α+β)-淀粉酶活力在萌发第3d和第7d均显著高于CK0组。CK25组在萌发第3、7天的(α+β)-淀粉酶活性对比相同萌发天数的CK0组酶活性,分别提升了9.09%、77.91%,CK50组则分别提升了19.84%、98.72%。
S25、S50组种子的(α+β)-淀粉酶活性在第3天和第7天均显著(P<0.05)高于CK25、CK50组。S25组在萌发第3、7天的(α+β)-淀粉酶活性较相同萌发天数的CK25组酶活性,分别提高了12.35%、13.38%。S50组在第3、7天的(α+β)-淀粉酶活性较相同萌发天数的CK50组酶活性,分别提高了20.54%、25.87%。S0组种子的(α+β)-淀粉酶活性与CK0组的酶活性相比,在种子萌发的第0、3、7天均无显著性差异。
综上所述,受到盐碱胁迫的香椿种子会提升自身的淀粉酶活性,而经过亚精胺浸种处理后再受到盐碱胁迫的香椿种子,其在萌发的过程中淀粉酶活性会进一步的提升。淀粉酶的作用为催化淀粉水解,水解生成的糖类物质可以参与到植物的代谢过程,为植物提供能量。由此可知,香椿萌发阶段通过提升淀粉酶活性加速淀粉向糖类物质的转化,从而应对盐碱胁迫,而亚精胺处理后再受到盐碱胁迫的香椿则进一步加速了这一转化过程。
2.3 亚精胺浸种对盐碱胁迫下香椿种子中SOD、POD活性的影响 由图4、图5可知,盐碱胁迫下香椿种子的SOD、POD活性较未受胁迫处理的种子有了显著的提升。随着盐碱浓度的升高,2种酶的活性随之上升。经亚精胺浸种处理后再受盐碱胁迫的种子,SOD、POD的活性有进一步的提升。CK25与CK50组较CK0组酶活性显著升高。其中,CK25组SOD活性较CK0组提升了101.74%,POD活性较CK0组提升了12.23%。CK50组SOD活性较CK0组提升了346.28%,POD活性较CK0组提升了34.57%。相同盐碱胁迫下,S组种子的SOD、POD活性较CK组显著升高。其中,S25组SOD活性较CK25组提升了39.39%,POD活性提升了18.52%。S50组的SOD活性较CK50组提升了33.90%,POD活性提升了20.62%。S0组较CK0组SOD、POD的活性显著升高,SOD活性上升了48.91%,POD活性上升了9.61%。
综上可知,香椿种子在盐碱胁迫下,其SOD、POD活性得到了显著提升。这2种酶在植物体内消除活性氧的反应,以减轻活性氧积累对植物体的损伤。亚精胺浸种处理后再受到盐碱胁迫的种子,其体内SOD、POD活性进一步提升,进而缓解了种子在盐碱胁迫下萌发受阻的情况。
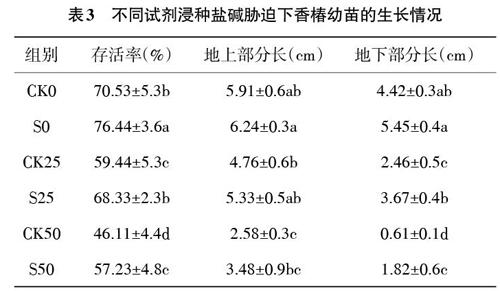
2.4 亚精胺浸种对盐碱胁迫下香椿幼苗表观指标的影响 由表3可知,随着盐碱胁迫程度的增大,幼苗移栽30d后的存活率不断下降,其地上部分与地下部分的生长均受到了盐碱胁迫的阻碍。S0组与CK0组相比其存活率有了显著的提升,S0组存活率较CK0组提升了5.91%,而S0组与CK0组的地上部分长度、地下部分长度差异均不显著。在盐碱胁迫状态下,经过亚精胺浸种处理可以显著提高幼苗的存活率,促进幼苗根系的生长。S25组与CK25相比较,其存活率提升了8.89%,地上部分长度差异不显著,地下部分长度差异显著,S25组的地下部分长度较CK25组增长了49.19%。S50组与CK50组相比,其存活率提升了11.12%,地上部分长度差异不显著,地下部分长度差异显著,S50组的地下部分长度较CK50组增长了198.36%。
由此可见,在盐碱胁迫下,蒸馏水浸种处理后萌发的香椿幼苗其根系受损严重,而相同胁迫环境下,亚精胺浸种处理能有效地缓解盐碱胁迫下香椿幼苗根系生长受阻的状况。综上可知,盐碱胁迫下,通过亚精胺浸种处理可以有效地促进幼苗根系的生长,显著提升了香椿幼苗的存活率。
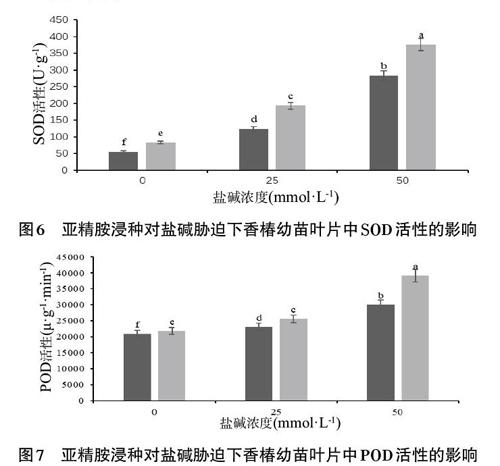
2.5 亚精胺浸种对盐碱胁迫下香椿幼苗叶片中SOD、POD活性的影响 由图6与图7可知,盐碱胁迫下香椿幼苗叶片中SOD、POD的活性显著升高,并且随着胁迫程度的加大,叶片中SOD、POD的活性会随之升高。通过分析CK25、CK50组与CK0组的数据可得,其SOD活性较CK0组分别升高121.98%、407.25%,其POD活性分别升高了10.20%、42.98%。
相同盐碱胁迫环境下,S组香椿幼苗叶片中SOD与POD的活性较CK组显著升高。S25组与CK25组相比,其SOD活性升高了55.65%,POD活性提升了10.91%。S50组与CK50组相比,其SOD活性升高了33.04%,POD活性提升了30.72%。此外,S0组幼苗叶片中SOD、POD的活性与CK0组相比也有显著地提升,其SOD活性升高了49.21%,POD活性提升了4.32%。
综上可知,盐碱胁迫下,香椿幼苗叶片中SOD与POD的活性显著提升,而抗氧化酶活力的提升可以加速积累在植物体内的活性氧的消除。在亚精胺浸种处理后,其叶片中的抗氧化酶的活性将会进一步的提升,从而缓解盐碱胁迫对香椿幼苗生长的阻碍,提升幼苗应对盐碱胁迫的抗性。
2.6 亚精胺浸种对盐碱胁迫下香椿幼苗根系中脯氨酸含量的影响 由图8可知,随着盐碱溶液浓度的升高,香椿幼苗根系中脯氨酸的含量显著增加。CK25、CK50组与CK0组相比,其脯氨酸的含量分别增加了32.57%、103.26%。此外,在相同程度的盐碱胁迫下,S组香椿幼苗根系中脯氨酸的含量较CK组显著增加。S25组与CK25组相比,其根系中脯氨酸的含量增加了35.96%。S50组与CK50组相比,其根系中脯氨酸的含量增加了43.96%。此外,S0组幼苗根系中脯氨酸的含量与CK0组相比差异不显著。
综上可知,盐碱胁迫下香椿幼苗通过增加脯氨酸在根系中的含量来响应胁迫。脯氨酸作为渗透调节物质,在防止植物细胞因外界不良环境而造成的水分大量流失,维持细胞膜完整性等方面发挥着重要的作用。而亚精胺浸种后,盐碱胁迫下香椿幼苗的根系之中,脯氨酸的含量进一步增加,通过脯氨酸在调节渗透平衡方面的重要作用,缓解盐碱胁迫对香椿幼苗根系的损害。
3 讨论
3.1 亚精胺浸种对盐碱胁迫下香椿种子萌发的影响 植物对于盐碱胁迫的响应,不仅可以从其自身出发,从内而外的进行调节,同样也可以接受由外界因素带来的影响,从而由外到内引发相关调节机制的变化。盐碱胁迫作用方式为多因素综合作用,在综合作用的影响下能够显著降低香椿种子的发芽率、发芽势、发芽指数并阻遏胚根的生长。盐碱胁迫的存在破坏了渗透平衡,导致细胞内水分的大量流失,根系吸水困难。亚精胺作为一种可以提高植物应对逆境的抵抗能力的活性物质,与植物对胁迫的响应联系密切。本试验结果表明,施用外源亚精胺试剂处理香椿种子可以提升种子应对盐碱胁迫的能力,缓解盐碱胁迫对其造成的损害,促进种子的萌发以及胚根的生长。亚精胺浸种可以提高盐碱胁迫下香椿种子的淀粉酶活力,加速淀粉水解为小分子糖类物质的过程,以供种子的萌发与生长。淀粉加速分解可以促进糖类物质的积累,除供给植物生长所需外,还可以作为渗透调节物质发挥作用。此外,亚精胺浸种提升了盐碱胁迫下香椿种子内抗氧化酶的活性,增强了植物在盐碱胁迫下的抵御能力。
3.2 亚精胺浸种对盐碱胁迫下香椿幼苗生长的影响 盐碱胁迫能够显著降低香椿幼苗的存活率、地上及地下部分的长度,而香椿幼苗自身对该胁迫具有一定的抵抗能力。通过试验中对其真叶部分SOD、POD活性的测定可知,盐碱胁迫下香椿幼苗体内的保护酶活性升高,用以缓解因胁迫造成的损害。此外,通过对香椿幼苗根系部分的脯氨酸含量的测定可知,除提升保护酶活性这一机制外,增加体内脯氨酸的含量,也是植物自身抵抗盐碱胁迫的一项重要机制。在相同的盐碱环境下,经外源亚精胺试剂处理后生长而成的幼苗,其对于盐碱胁迫的抵抗性显著增强。SOD、POD可以帮助细胞抵御活性氧造成的伤害、保护细胞膜、控制膜脂过氧化以及清除植物体内的自由基,以此提高植物对盐碱胁迫的抗性。脯氨酸作为渗透调节物质参与植物体内的渗透调节,它能够提高胁迫状态下细胞内溶质的浓度、降低细胞水势、增强细胞的吸水能力,其含量的增加可有效防止细胞内水分的过度流失。此外,脯氨酸在保持细胞膜完整性方面也发挥着重要的作用。由此可知,外源亚精胺通过增强抗氧化酶活性、增加渗透调节物质的含量等多方面的抵抗能力,响应盐碱胁迫带来的综合作用,从而有效地促进了香椿幼苗在盐碱胁迫下的生长。
4 结论
由本次试验可知。0.3mmol·L-1亚精胺浸种能够有效促进盐碱胁迫下香椿种子的萌发及其幼苗的生长,并提高香椿幼苗对盐碱的抗性。
参考文献
[1]郭瑞,李峰,周际,等.亚麻响应盐、碱胁迫的生理特征[J].植物生态学报,2016,40(1):69-79.
[2]CAPULA-RODRIGUEZ ROBERTO, VALDEZ-AGUILAR LUIS A, CARTMILL DONITA L, et al. Supplementary Calcium and Potassium Improve the Response of Tomato (Solanum lycopersicum L.) to Simultaneous Alkalinity, Salinity, and Boron Stress[J]. Communications in Soil Science and Plant Analysis, 2016, 47(4):505-511.
[3]BINSHUO LIU, CHUNLI KANG, XIN WANG, et al. Physiological and morphological responses of Leymus chinensis to saline-alkali stress[J]. Grassland Science, 2015, 61(4):217-226.
[4]王佺珍,刘倩,高娅妮,等.植物对盐碱胁迫的响应机制研究进展[J].生态学报,2017,37(16):5565-5577.
[5]ASISH KUMAR PARIDA, ANATH BANDHU DAS. Salt tolerance and salinity effects on plants: a review[J]. Ecotoxicology and Environmental Safety, 2005, 60(3):324-349.
[6]潘明洪,李州,彭丹丹,等.亚精胺浸种对渗透胁迫下白三叶种子萌发及淀粉代谢的影响[J].植物生理学报,2014,50(4):426-432.
[7]王玉,刘国州,蔡溧聪,等.亚精胺浸种对番茄种子萌发及幼苗高温抗性的影响[J].中国蔬菜,2020,(5):34-39.
[8]夏关雪莹,王冰,屈琳俐,等.亚精胺浸种缓解盐碱胁迫对苜蓿生长抑制的研究[J].中国草地学报,2019,41(5):17-23.
[9]XIAXIANG ZHANG, ZHIQIANG SHI, YOUJIA TIAN, et al.Salt stress increases content and size of glutenin macropolymers in wheat grain[J]. Food Chemistry, 2016, 197:516-521.
[10]WANGXIA WANG, BASIA VINOCUR, ARIE ALTMAN. Plant responses to drought, salinity and extreme temperatures: towards genetic engineering for stress tolerance[J]. Planta, 2003, 218(1):1-14.
[11]李文嬈,张岁岐,山仑.水分胁迫下紫花苜蓿和高粱种子萌发特性及幼苗耐旱性[J].生态学报,2009,29(6):3066-3074.
[12]焦树英,李永强,沙依拉·沙尔合提,等.干旱胁迫对3种狼尾草种子萌发和幼苗生长的影响[J].西北植物学报,2009,29(2):308-313.
[13]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:169-172. (责编:张宏民)

