固体核磁共振技术在锡硅分子筛表征中的应用
肖 瑶,夏长久,易先锋,刘凤庆,刘尚斌,郑安民*
固体核磁共振技术在锡硅分子筛表征中的应用
肖 瑶1,2,夏长久3,易先锋1#,刘凤庆1,2,刘尚斌4,郑安民1*
1. 中国科学院精密测量科学与技术创新研究院,武汉物理与数学研究所,波谱与原子分子物理国家重点实验室,湖北 武汉 430071;2. 中国科学院大学,北京 100049;3. 中国石油化工股份有限公司石油化工科学研究院,石油化工催化材料与反应工程国家重点实验室,北京 100083;4. 原子与分子科学研究所,台湾 台北 10617
生物质等绿色资源的高效转化利用是催化科学的重要发展方向.锡硅分子筛因具有优良的催化性能而得到相关研究者的普遍关注.准确构建催化剂活性中心结构/酸性与催化反应性能之间的构效关系是新型高效催化剂设计与研发的基础.固体核磁共振(NMR)是研究分子筛活性中心局域结构、酸特性与催化反应机理的重要手段.本文简述了近年来固体NMR技术在锡硅分子筛研究领域的一系列主要进展,并进行了展望.
固体核磁共振;锡硅分子筛;活性中心结构;酸特性;反应机理
引 言
生物质等绿色能源主要来自植物的光合作用,是取代煤炭、石油等不可再生资源,实现绿色和可持续生产精细化学品和燃料的重要途径[1,2].生物质及其衍生物(如葡萄糖、果糖、乳酸和乳酸酐等)的高效转化利用有望实现碳中和,缓解全球能源危机与气候变化等问题,因此已经成为国内外催化科学的重要发展方向[3].近年来,有研究发现具有Lewis酸性的锡硅分子筛在糖类异构化[4-10]、Meerwein-Ponndorf-Verley-Oppenauer(MPVO)反应[11,12]、乳酸及乳酸酯制备[8,13],以及Baeyer-Villiger(BV)氧化[14]等反应过程中表现出优异的催化性能,具有潜在的工业应用价值.比如,Davis等发现Sn-Beta分子筛可以高效催化葡萄糖异构化生成果糖,不仅表现出与葡萄糖异构化酶相似的功能,还克服了酶催化活性受反应条件限制的弊端[4-6].而且,锡硅分子筛催化生物质分子转化的反应条件温和、过程清洁高效[4-14].
众所周知,分子筛的活性中心结构及酸特性(酸类型、酸强度、酸浓度和酸分布等)与其催化反应性能(活性、选择性和反应机理)密切相关,准确构建分子筛活性中心结构特性与催化反应性能之间的构效关系是新型高效催化剂设计与研发的基础,具有重要的现实意义与应用价值[15].因此,相关研究者一直试图从原子分子水平上揭示锡硅分子筛催化反应活性中心的局域精细结构与酸性特征,从而阐明其独特催化性能的本质,为新一代高性能催化剂的定向合成与改性提供理论指导.
固体核磁共振(NMR)技术能够探测原子核的微观化学环境,是研究分子筛等固体酸催化剂活性中心局域结构、酸特性与催化反应机理的重要实验手段[6,13,15-23].比如,通过119Sn魔角旋转(MAS)NMR可以探测各种锡物种的配位状态[6],1H MAS NMR可以提供各种羟基物种的结构信息[16,17].借助合适的碱性探针分子,如吡啶、氘代乙腈、2-13C-丙酮、三甲基膦、三烷基氧膦等,固体NMR还可以给出定性/定量的酸性特征信息(酸类型、酸强度、酸浓度、酸分布和酸位可接近性等),以及探测主客体之间的相互作用[13,15,17-22].此外,固体NMR还能监测反应物种的转化历程、捕获活泼的反应中间体[6,23],为催化反应机理的研究提供重要的实验证据,进一步加深人们对分子筛催化反应机制的理解.近年来,随着高场NMR谱仪的发展以及更先进NMR脉冲序列的开发与应用,固体NMR在锡硅分子筛研究中的应用越来越广泛.本文主要从活性中心局域精细结构表征、酸性特征的定性与定量探测,以及催化反应机理研究等三个方面总结了固体NMR技术在锡硅分子筛研究中的主要进展.
1 锡硅分子筛活性中心结构的固体NMR表征
1.1 119Sn MAS NMR
锡硅分子筛是由锡原子同晶取代骨架上的硅原子而形成,活性中心往往与锡原子的引入密切相关,因此,119Sn MAS NMR是表征锡硅分子筛活性中心结构最直接的方法,它能够准确提供锡原子的局域化学环境、配位状态等各种重要的结构信息[6,24-33].Davis等[6]通过119Sn MAS NMR技术研究了119Sn同位素富集(119Sn天然丰度8.6%)的Sn-Beta分子筛的活性中心结构,如图1(A)所示,他们发现水合样品的119Sn NMR谱中主要出现了位于Sn−700左右的信号;而当样品在120 ℃真空脱水后,Sn−700附近的信号消失了,额外又出现了位于Sn−420和−443信号;当样品重新水合后,Sn−700处的信号再次出现.据此,他们将Sn−420和−443的信号归属为四配位骨架锡物种,将Sn−700的信号归属为吸水的六配位锡物种.为了进一步鉴定Sn−420和−443两种不同四配位骨架锡的来源,他们进行了1H-119Sn交叉极化(CP)实验,通过改变接触时间,在谱图中只观察到Sn−420处的信号,表明该信号与H物种空间临近[图1(B)].通常情况下,锡硅分子筛骨架四配位锡原子有两种不同的配位状态:一种是锡原子与4个−OSi−基团配位,形成[Sn(OSi)4]的“closed”锡位点;另一种是锡原子与邻近3个−OSi−基团和1个−OH配位,形成[Sn(OSi)3-OH]的“open”锡位点.因此,可以将Sn−420归属为骨架四配位“open”锡位点,将Sn−443归属为骨架四配位“closed”锡位点[6].Ivanova等[26]利用1H-119SnCP-CPMG MAS NMR方法研究不同脱水温度的Sn-Beta分子筛时,发现脱水温度越高,Sn−418信号越弱[图1(C)].当脱水温度高于250 ℃时,已经完全观测不到Sn−418处信号,表明高温脱水可能导致“open”锡位点发生聚合生成“closed”锡位点[26].值得一提的是,由于分子筛中存在的硅羟基物种也可能导致邻近的骨架“closed”锡位点产生CP信号,因此,对于锡硅分子筛“open”锡位点的归属目前仍然存在一定的争议[24-33].
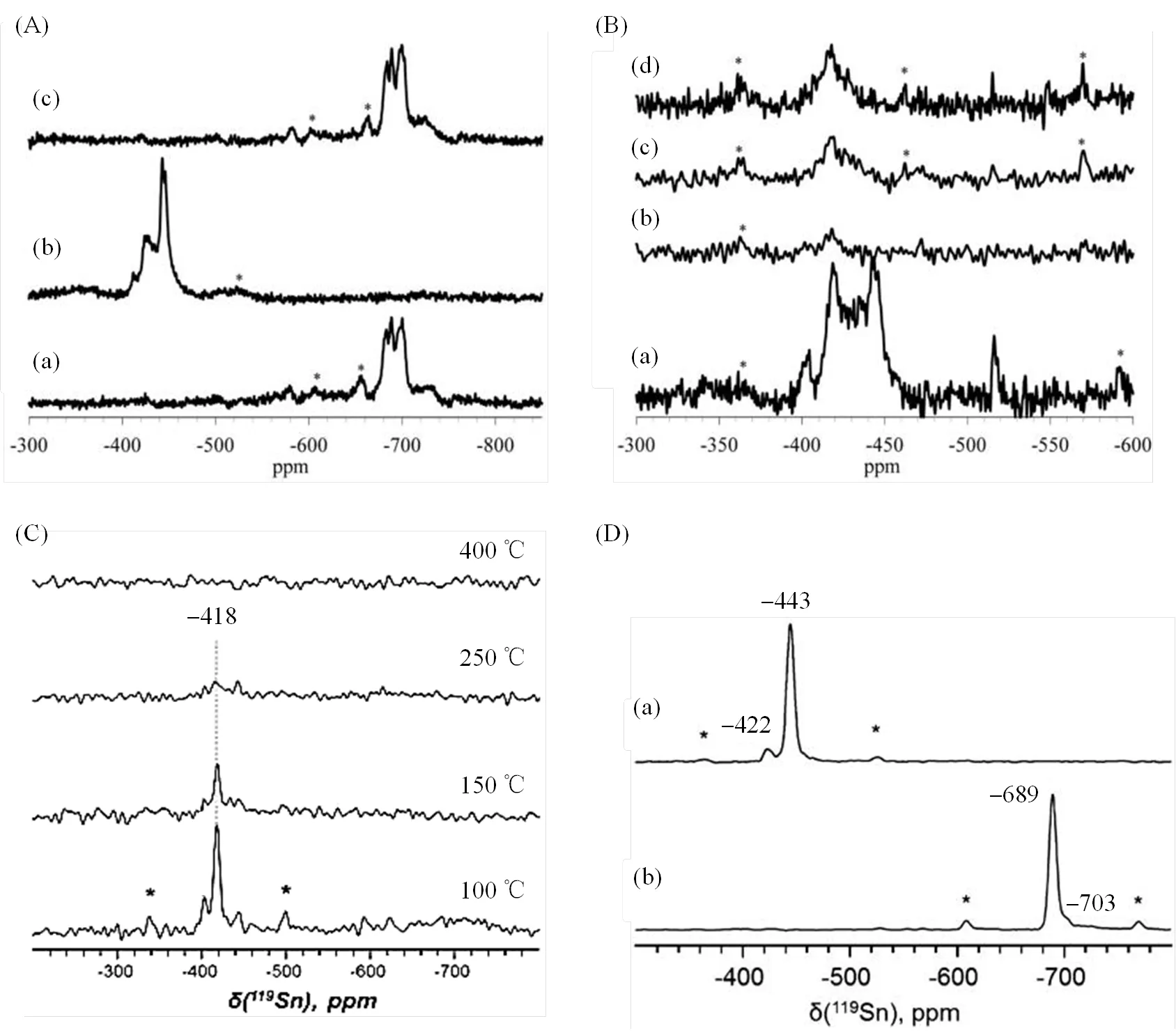
图1 (A)不同处理条件下,Sn-Beta分子筛的119Sn MAS NMR谱图:(a)煅烧;(b)煅烧后脱水;(c)煅烧脱水后再水合.(B)脱水Sn-Beta分子筛的(a) 119Sn MAS与(b~d)不同CP接触时间[(b) 0.2 ms,(c) 1.0 ms,(d) 2.0 ms]的1H-119Sn CP MAS NMR谱图.(C)不同温度真空脱水的119Sn-Beta分子筛的1H-119Sn CP-CPMG MAS NMR谱图.(D) (a)脱水与(b)未脱水Sn-Beta分子筛的119Sn DP-CPMG MAS NMR谱图,*表示旋转边带(根据文献[6]和[26]修改)
由于锡硅分子筛中锡的含量非常低(通常小于2 wt. %),且119Sn核的弛豫时间非常长(通常几十秒甚至上百秒),因此常规119Sn MAS NMR实验往往非常耗时,并且谱图信噪比较差[24-33].针对这一问题,人们一般采用昂贵的119Sn同位素富集样品开展相关NMR实验.在固体NMR方法方面,Ivanova等[25-27]最近发展了一种Carr-Purcell-Meiboom-Gill(CPMG)多回波采样技术,能够在较短时间内实现对天然丰度锡硅分子筛含锡物种的高灵敏高分辨NMR观测.如图1(D)所示,Ivanova等[26,27]利用119Sn direct polarization (DP)-CPMG MAS NMR技术得到了Sn-Beta分子筛脱水前后的高分辨119Sn NMR谱,特别地,基于信号强度比例,他们推测水合样品中的Sn−703六配位锡物种脱水后转变成Sn−422的四配位骨架锡物种,而水合样品的Sn−689六配位锡物种则与脱水样品的Sn−443四配位骨架锡物种密切相关.进一步,他们还利用该方法研究了水合程度对锡硅分子筛活性中心结构的影响[26],如图2(a)所示,当脱水样品在水汽中暴露3 h,所有的四配位骨架锡物种全部吸水转变成五配位锡(Sn−581)与六配位锡物种(Sn−689和−703).随着水合时间的增加,Sn−581五配位锡信号逐渐降低,而Sn−689六配位锡物种信号逐渐增强.值得注意的是,Sn−703信号强度几乎保持不变,表明少量四配位锡物种能够迅速吸附水分子生成Sn−703的六配位锡物种;而大多数四配位锡物种则在快速吸水形成五配位物种(Sn−581)后,再缓慢地继续水合形成六配位锡物种(Sn−689),即使长达67 h也无法完全水合完成[26].研究同样发现,水合样品经过再次脱水处理,所得到的119Sn NMR谱图与之前完全一致,表明锡硅分子筛的水合−脱水过程是完全可逆的.基于这些119Sn NMR实验结果,他们给出了锡硅分子筛含锡物种的水合机制[图2(c)]:脱水Sn-Beta分子筛中的Sn−422四配位锡物种能够快速水合直接生成Sn−703六配位锡;而Sn−443的四配位锡物种则首先快速水合1个水分子生成Sn−581的五配位锡,随后再缓慢水合形成Sn−689的六配位锡物种[26].
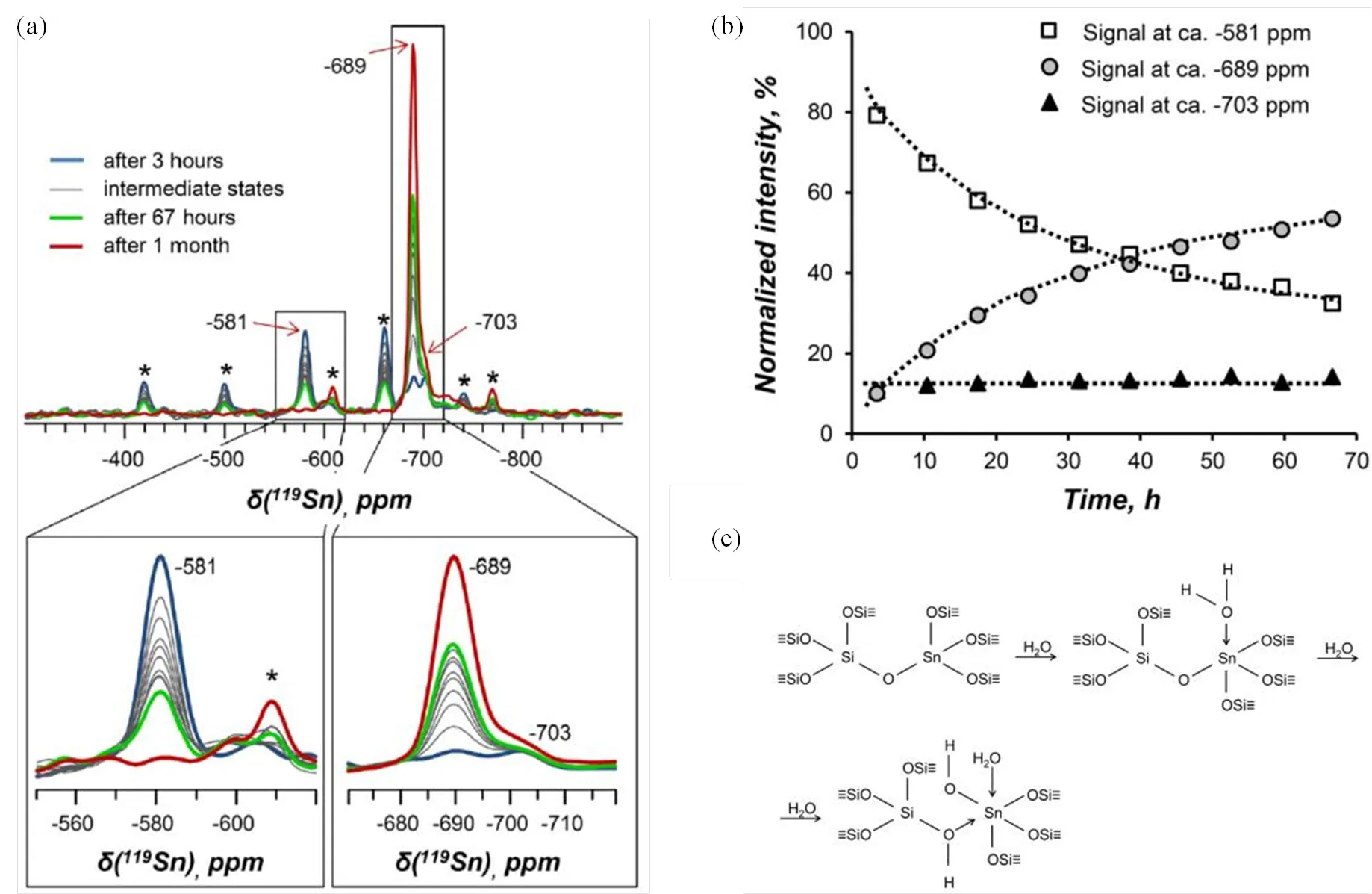
图2 (a)脱水119Sn-Beta在水汽中(H2O/Sn=4)暴露不同时间的119Sn DP-CPMG MAS NMR谱图变化;(b) dSn −581,−689和−703三处不同119Sn NMR信号积分面积与暴露时间之间的关联;(c) Sn-Beta分子筛Sn位点的水合机制(根据文献[26]修改)
此外,由于动态核极化(DNP)NMR技术[34,35]也能够显著提高原子核的NMR观测灵敏度,因此,近年来,该技术也被用来研究锡硅分子筛的锡物种[24,28,31,32].比如,Copéret和Hermans等采用DNP增强的119Sn NMR技术研究了Sn-Beta分子筛的锡位点及活性中心的局域精细结构.相比于常规的固体119Sn NMR技术,119Sn DNP NMR能够显著提高119Sn NMR谱图的分辨率与信噪比,从而有利于不同锡位点及活性中心的鉴定与归属[24,28,31].尽管如此,由于DNP NMR谱仪非常先进,实验条件也较为苛刻(通常需要在100 K低温下进行),因此其实验成本较高,目前仍难以普及;另外,实验操作中通常需要额外加入极化试剂,这些极化试剂分子可能改变活性中心的局域配位化学环境;极化试剂分子的不均匀分散同样可能影响样品的整体观测,导致无法准确定量.
总的来说,119Sn MAS NMR能够用来直接观测锡硅分子筛中不同锡物种的微观化学环境与配位状态,为锡硅分子筛活性中心结构的探究提供直接而有力的实验技术支撑.
1.2 1H MAS NMR
除119Sn MAS NMR以外,1H MAS NMR由于具有极高的检测灵敏度也常用来研究锡硅分子筛的活性中心,特别是各种各样羟基物种的局域结构[27,36].如图3所示,Ivanova等[27]通过1H MAS NMR实验研究了脱水Sn-Beta分子筛水合过程中各种羟基物种的变化.他们发现,脱水Sn-Beta分子筛中只存在硅羟基(H1.8~3.2);接触水分子后,1H NMR谱图中很快就出现了H6.4信号,并且在随后的水合过程中,该信号强度几乎保持不变.而H5.8信号则随水合时间的增加逐渐缓缓增强,同时伴随着物理吸附水的信号(H4.0)逐渐降低.只有在水合时间超过70 h后,H5.8的信号强度才逐渐保持不变.根据信号强度随水合时间变化的曲线[图3(c)],他们发现H6.4的1H NMR信号与119Sn谱中的Sn−703信号变化规律完全一致,表明H6.4是Sn−703六配位锡上吸附的水分子信号.同样地,H5.8的1H NMR信号与Sn−689六配位锡的变化规律也一致,表明H5.8是Sn−689六配位锡上吸附的水的信号[27].由此可知,通过1H MAS NMR实验所得到的结论与上述119Sn NMR实验结果完全一致[26].最近,Deng等[36]结合1H NMR和二维1H-119Sn NMR相关实验也研究了不同水合条件下Sn-Beta分子筛的活性中心结构及其水合机制,他们也发现,不同温度脱水的Sn-Beta分子筛中锡活性中心结构并不相同:在393 K脱水时,样品中同时存在“open”和“closed”两种结构的锡位点;而当样品在673 K脱水时,“open”锡位点的Sn-OH会和邻近Si-OH发生脱水反应,重构Sn-O-Si键,此时样品中主要存在“closed”锡位点.其中,二维1H-119Sn HMQC NMR谱为Sn-OH的存在提供了直接的实验证据(图4)[36].
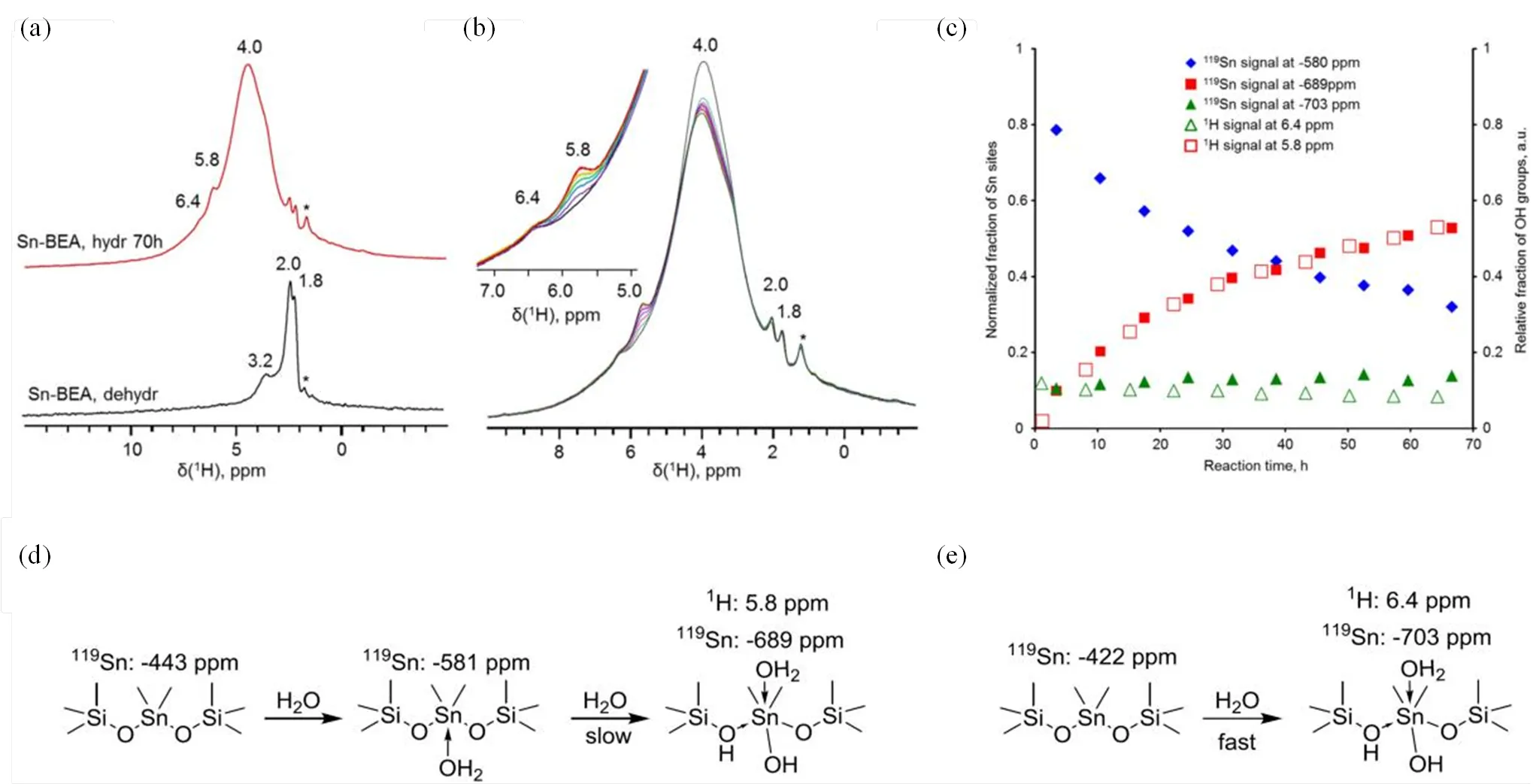
图3 (a)脱水Sn-Beta水合前与在水汽中水合70 h的1H MAS NMR谱图;(b) Sn-Beta不同水合时间的1H MAS NMR谱图;(c)1H和119Sn NMR归一化积分面积与水合时间的关系;(d, e)脱水Sn-Beta两种不同的水合机制(根据文献[27]修改)
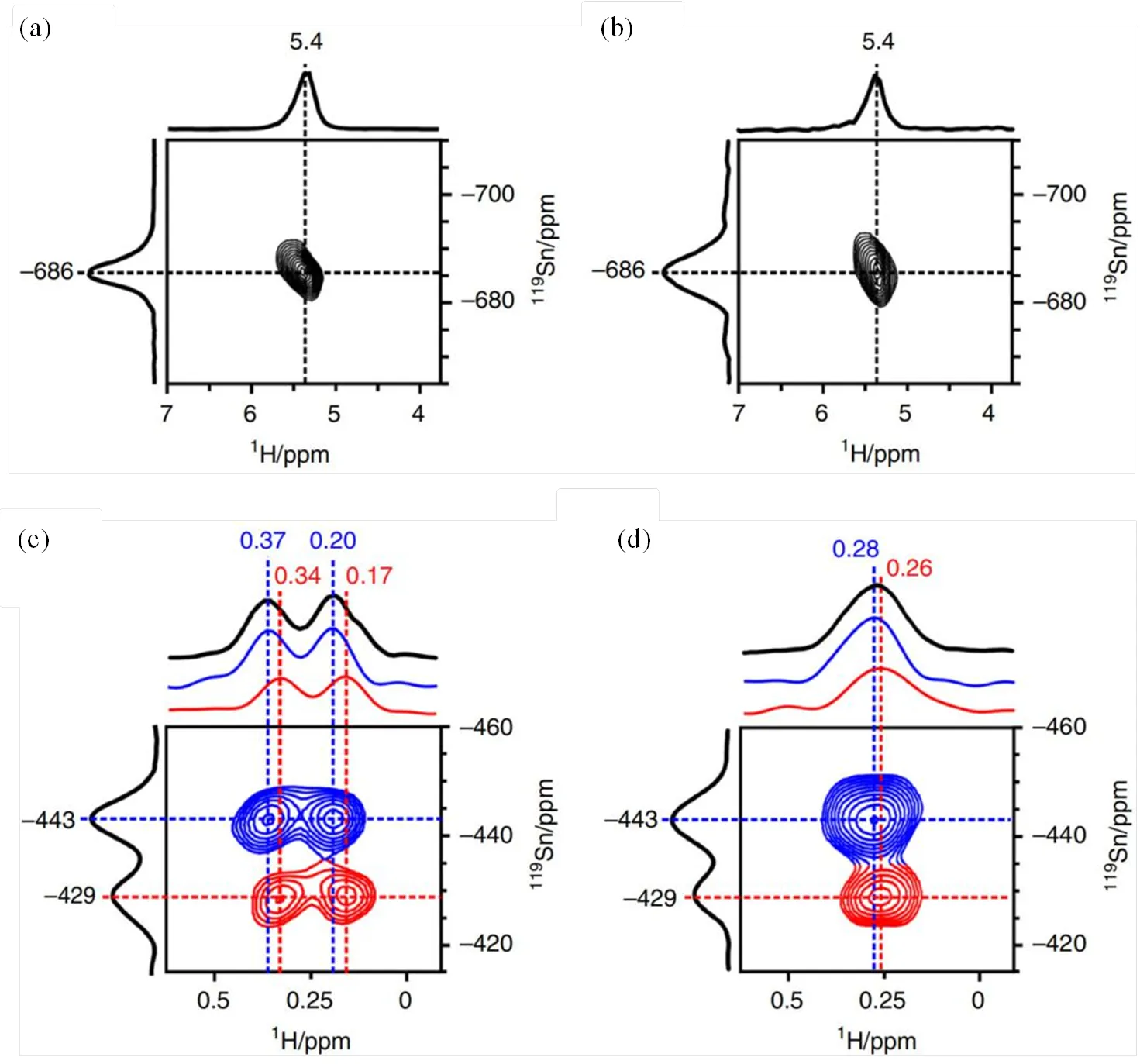
图4 不同处理条件下Sn-Beta分子筛的1H-119Sn HMQC NMR谱图.(a)不脱水;(b) 298 K脱水;(c) 393 K脱水,不对119Sn去耦;(d) 393 K脱水,并对119Sn去耦(根据文献[36]修改)
2 锡硅分子筛酸特性的固体NMR研究
众所周知,作为一种固体酸催化剂,分子筛的酸性特征(酸类型、酸强度、酸浓度与酸分布等)与其催化反应性能密切相关[15,37].尽管119Sn和1H MAS NMR方法能够准确提供锡硅分子筛的活性中心结构信息,但并不能给出这些重要的酸性特征.为解决这一难题,往往需要借助探针分子吸附的方法.通过选择合适的探针分子,就可以获得锡硅分子筛相应的酸性信息.常用的NMR探针分子主要有氘代吡啶、氘代乙腈、2-13C-丙酮、三甲基膦(TMP)、三烷基氧膦等等[13,15,17-22,38-49].
其中,基于TMP和三甲基氧膦(TMPO)的31P NMR技术是应用极为广泛的固体催化剂酸性表征方法.这主要是由于31P是一种非常理想的NMR可观测核,具有较高的旋磁比及100%天然丰度,无需额外的同位素标记,并且31P NMR谱具有较宽的化学位移范围(~600 ppm),因此具有较高的NMR检测灵敏度与分辨率,便于信号的精细区分[21,44].
Lunsford等[38]率先将TMP用于固体催化剂的酸性表征.当TMP吸附在Brønsted酸中心时,会质子化生成TMPH+阳离子,在31P NMR谱一般位于P0左右;而TMP吸附到Lewis酸中心的化学位移分布范围较宽,一般在P−20 ~ −60.由此可知,TMP对酸类型非常敏感,能够轻易区分Brønsted/Lewis酸中心,并且能够用来很好地表征Lewis酸中心的酸强度[21,44].Lin等[13]基于31P-TMP NMR方法研究了Sn-MFI分子筛的酸性特征.如图5所示,研究发现脱水Sn-MFI分子筛中存在两种不同酸强度的Lewis酸中心(P−19和−25),可能对应于骨架中的“closed”和“open”两种不同的锡位点.另外,样品中还有少量Brønsted酸中心(P−4),这可能与样品中的Si-OH和Sn-OH有关.当TMP和甲醇共吸附时,发现随着甲醇吸附量的增加,Brønsted酸量也在不断增加,同时Lewis酸量在不断减少,由此可以推测,甲醇在锡位点上的吸附能够诱导产生新的Brønsted酸中心[13].该实验结果表明Sn-MFI分子筛中同时存在Brønsted酸和Lewis酸中心,并且它们均与锡原子的引入密切相关.
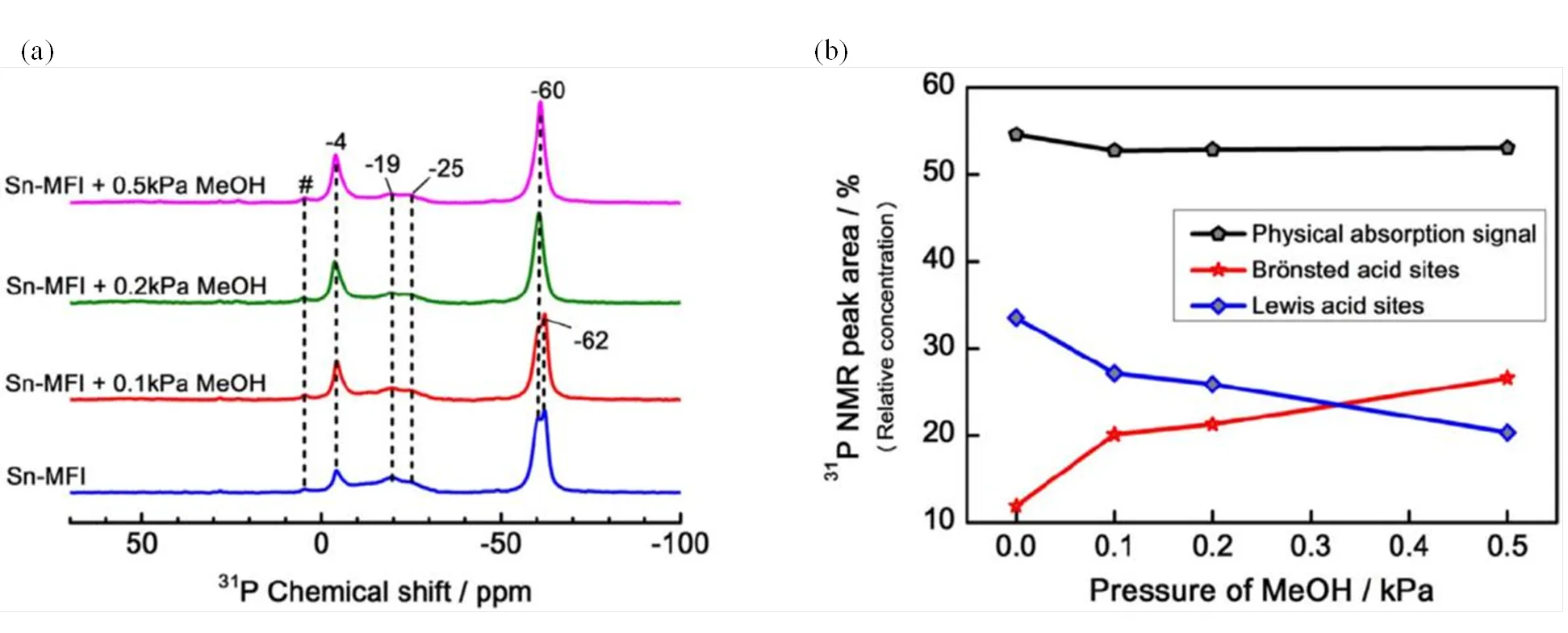
图5 (a)不同甲醇负载量的Sn-MFI分子筛吸附TMP的31P NMR谱图;(b)不同甲醇负载量的Sn-MFI分子筛的Lewis与Brønsted酸量(根据文献[13]修改)
Román-Leshkov等[45]利用31P NMR结合TMPO探针分子研究了Sn-Beta分子筛的酸性特征.如图6(a)所示,吸附较少量TMPO时,31P NMR谱图中出现了P58.6和54.9的信号;而当TMPO吸附量较高时,谱图信号重叠较为严重,给归属带来了很大困扰.随后他们通过将不同TMPO吸附量的Sn-Beta分子筛的31P NMR谱和119Sn NMR谱结合,同步观察31P化学位移及锡配位数的变化[图6(b)],根据积分面积之比,将31P NMR谱中P55.8和54.9归属为TMPO吸附在“open”锡位点,将P58.6和57.2归属为TMPO吸附在“closed”锡位点.为进一步建立Sn-Beta分子筛活性中心与葡萄糖异构化以及苯甲醛与丙酮的缩合反应活性之间的关联,他们合成了一系列不同锡含量的Sn-Beta分子筛.通过TMPO吸附实验将“open”和“closed”锡位点的含量归一化,从而获得了活性中心含量与催化反应活性中心含量(STY)之间的线性关系.如图7所示,研究表明,P55.8和54.9的活性中心(“open”锡位点)主要催化葡萄糖异构化反应的进行,而醇醛缩合的反应活性则与P58.6和57.2处的31P NMR信号(“closed”锡位点)密切相关[45].
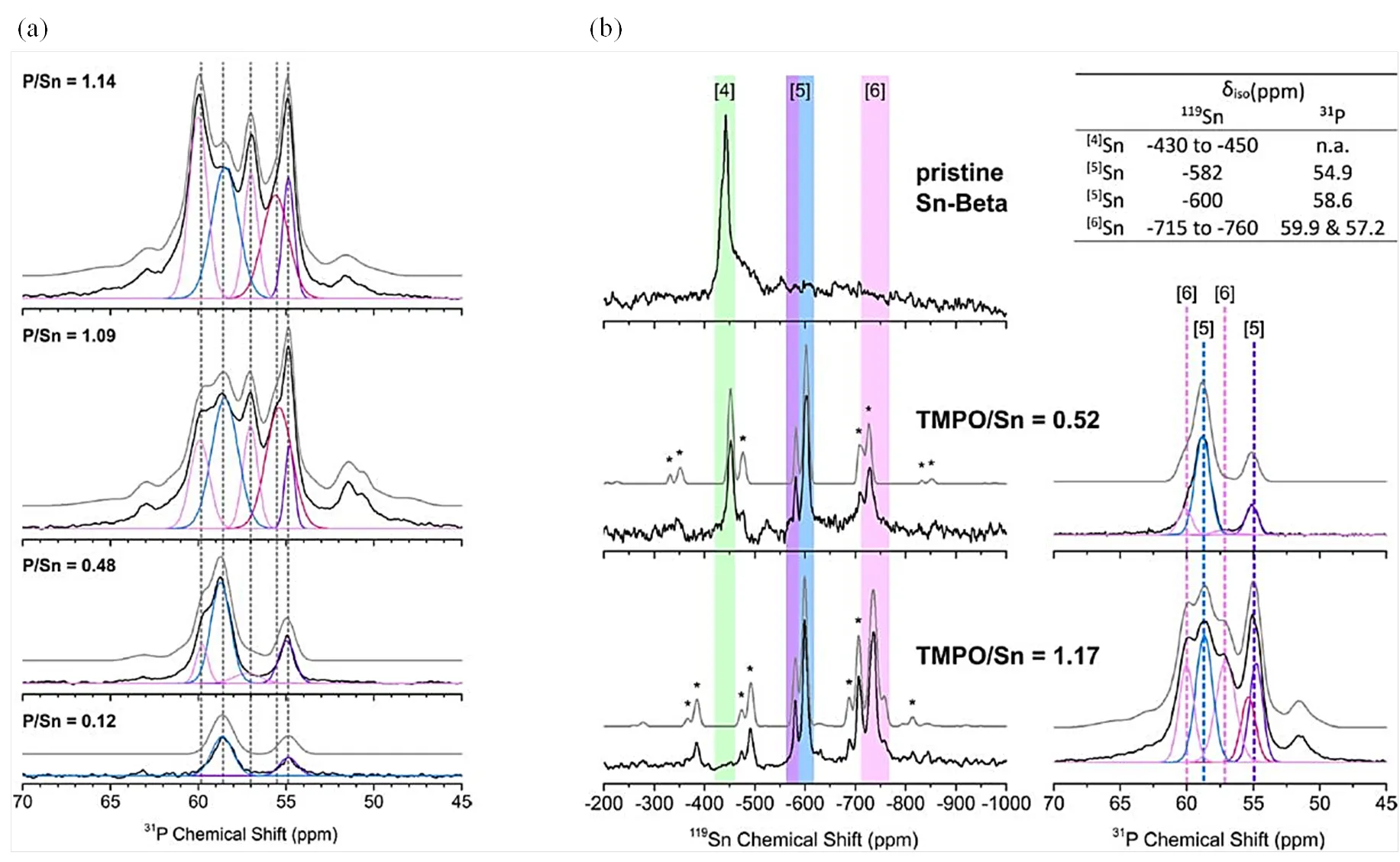
图6 不同TMPO吸附量Sn-Beta分子筛的(a) 31P与(b) 119Sn和31P MAS NMR谱图(根据文献[45]修改)
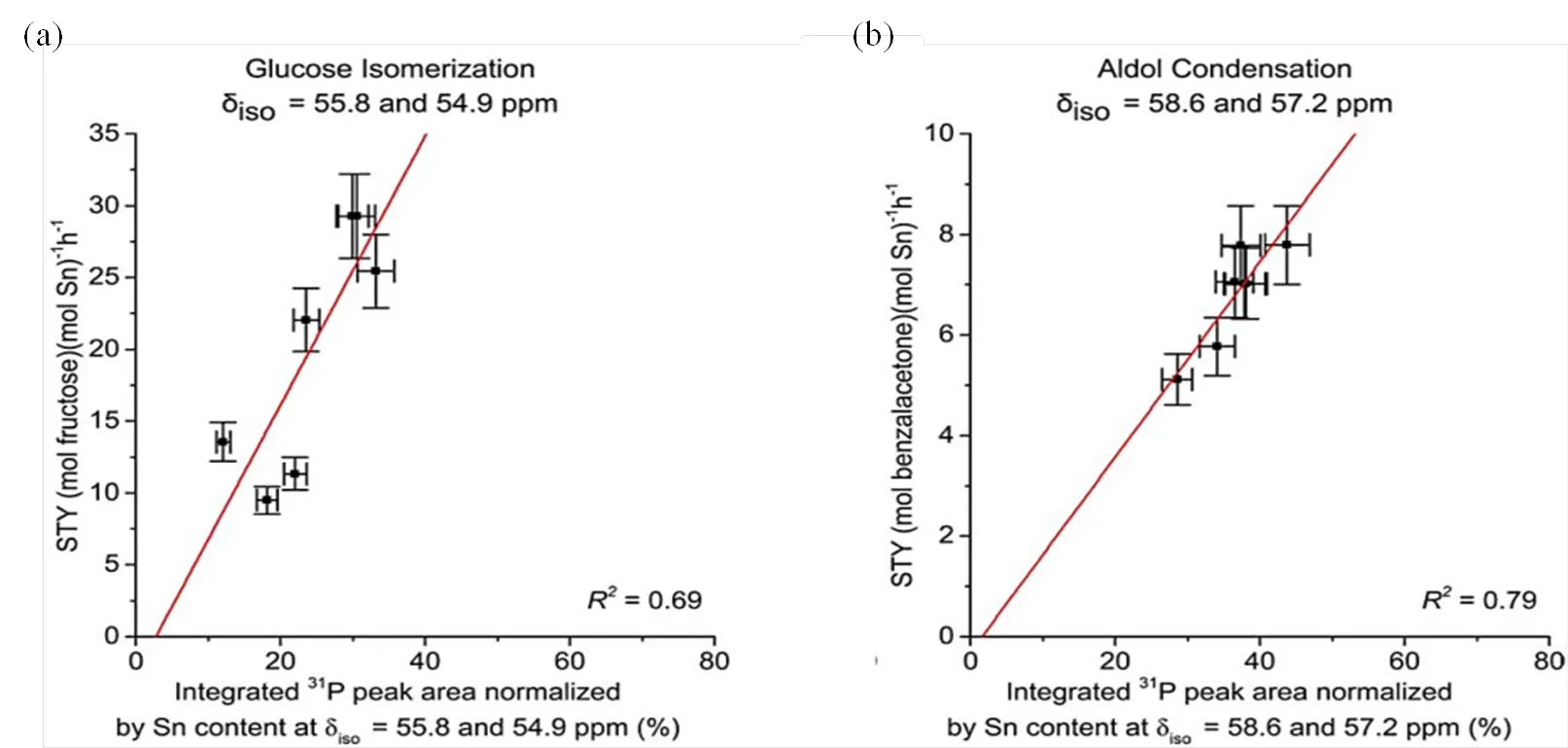
图7 (a) Sn-Beta分子筛不同活性中心(dP55.8和54.9的“open”锡位点)含量与葡萄糖异构化反应活性之间的关系;(b) Sn-Beta分子筛不同活性中心(dP58.6和57.2的“closed”锡位点)含量与催化苯甲醛与丙酮缩合反应活性之间的关联(根据文献[45]修改)
最近,Li等[46]也利用31P-TMPO NMR方法探究了不同合成方法得到的Sn-Beta分子筛的酸特性.如图8(a)所示,他们发现Sn-Beta-I和Sn-Beta-II均具有较强的Lewis酸性(P56),其中,Sn-Beta-I的Lewis酸中心主要来源于骨架锡物种,而Sn-Beta-II的Lewis酸中心则是孔道内小尺寸的SnO颗粒(0.5~2 nm).另外,Sn-Beta-II和Sn-Beta-III样品中还存在酸性较弱的Lewis酸中心(P51).与此同时,他们还发现TMPO很难吸附在大尺寸的SnO2上,表明当SnO颗粒尺寸增大时(> 2 nm),Lewis酸性会减弱甚至消失[46].
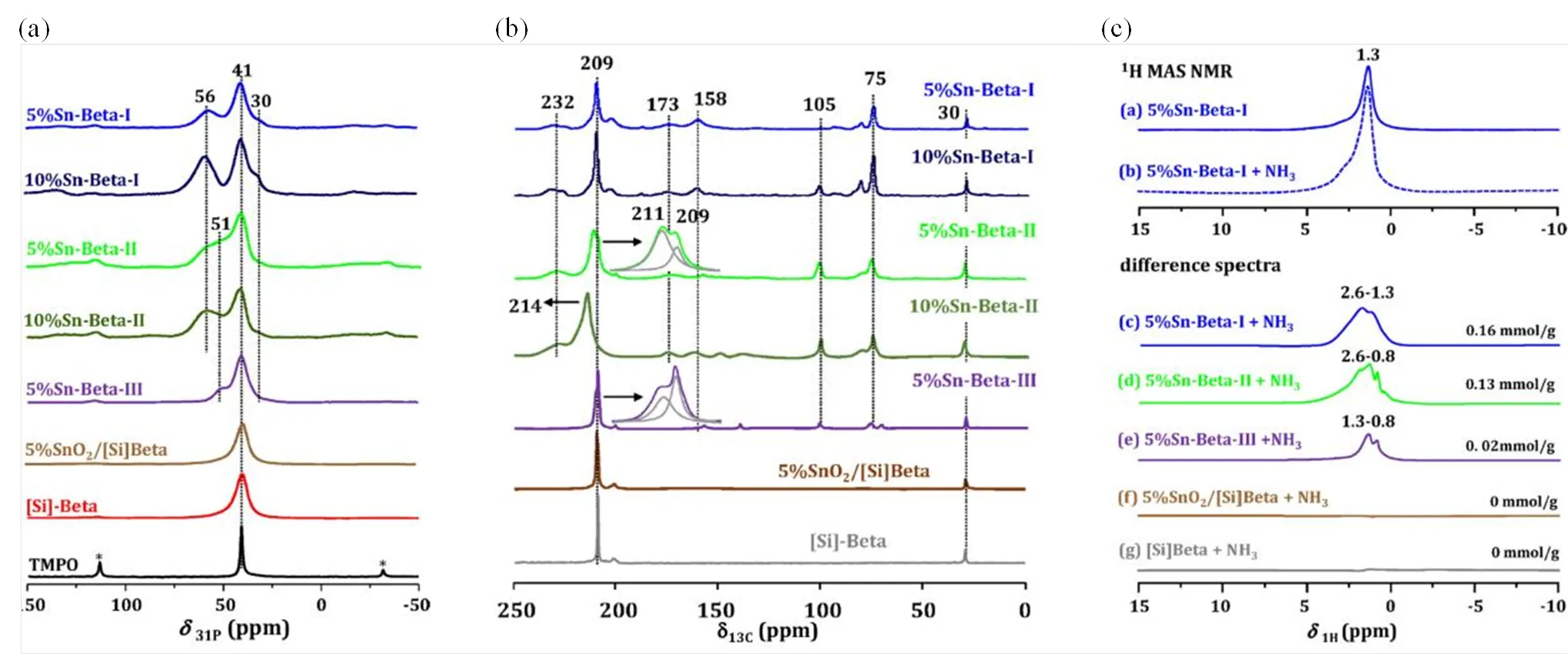
图8 Si-Beta分子筛以及各种锡硅分子筛(a)吸附TMPO的31P NMR谱图、(b)吸附2-13C-丙酮的13C CP MAS NMR谱图、(c)吸附NH3的1H NMR谱图及差谱(根据文献[46]修改)
除了含膦探针分子以外,2-13C-丙酮也常用来表征锡硅分子筛的Lewis酸特性[46,47].如图8(b)所示,2-13C-丙酮物理吸附在Si-OH上的信号位于C209,而其吸附在Sn-Beta-I和Sn-Beta-II的Lewis酸中心上的信号位于C232,表明这两种不同合成方法得到的Sn-Beta分子筛均具有较强的Lewis酸性,而Sn-Beta-III样品只有较弱的Lewis酸中心,与上述31P-TMPO NMR方法得到的结论完全一致[46].另外,结合NH3分子吸附,Li等[46]还利用1H MAS NMR实验定量测量了不同Sn-Beta样品的Lewis酸含量[图8(c)].其中,H0.8~1.3为NH3吸附在Sn-Beta分子筛弱Lewis酸中心的信号,~H2.6则为强Lewis酸中心信号,由此通过计算5% SnO2/Si-Beta、5% Sn-Beta-III、5% Sn-Beta-II和5% Sn-Beta-I对应的H0.8~2.6的1H NMR信号的峰面积,可以得到它们的Lewis酸含量分别为0、0.02、0.13和0.16 mmol/g.结合环己酮BV氧化反应与氧化环己烯水合反应催化评估实验,进一步建立了Lewis酸量与反应性能之间的线性关联,证实Lewis酸中心就是该催化反应的活性位点(图9)[46].
此外,15N MAS NMR结合15N同位素标记的吡啶也可以用来表征各种锡硅分子筛的酸性特征[48,49].研究表明,气相15N-吡啶的15N NMR化学位移为N317,当其吸附到Lewis酸位点时,15N NMR信号在N260~285范围内;而当其吸附在Brønsted酸位点时,15N NMR化学位移范围为N212~288.不管是Brønsted还是Lewis酸,酸性越强,吸附吡啶的15N NMR化学位移均越小(图10)[48].
3 锡硅分子筛催化反应机理的固体NMR研究
通过仔细讨论固体NMR在锡硅分子筛活性中心局域结构及酸特性表征方面的应用,可以发现固体NMR不仅能够准确提供锡原子的精细化学环境、水合程度、配位状态等重要的结构信息,而且还能定性/定量探测活性中心的酸类型、酸强度、酸浓度和酸分布等酸性特征,这些结果对于人们准确构建催化剂结构特性与反应性能之间的构效关系具有重要的意义.除此之外,固体NMR还能监测反应物种的转化历程、捕获活泼的反应中间体,为催化反应机理的研究提供重要的实验证据,进一步加深人们对分子筛催化反应机制的理解.
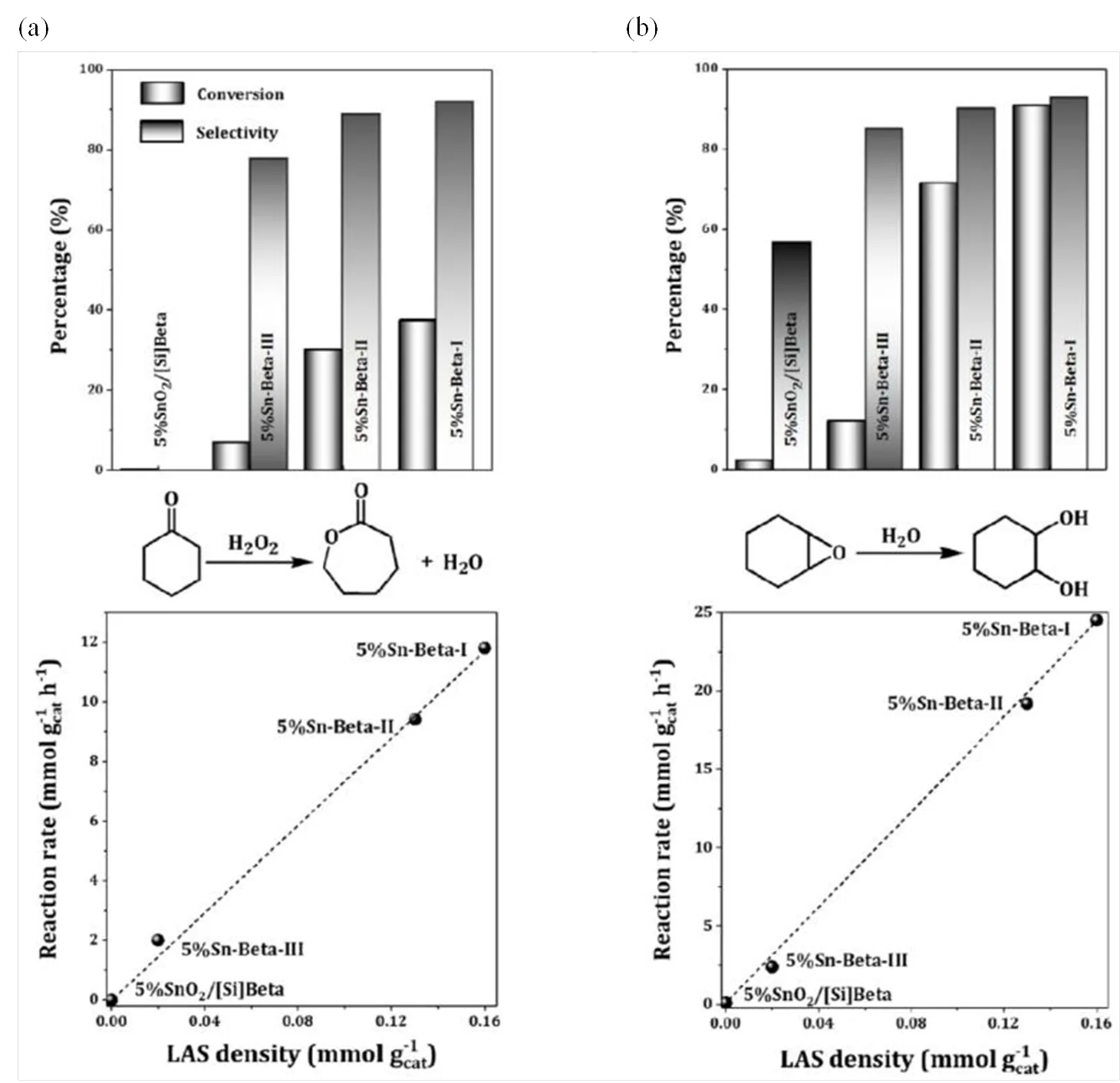
图9 锡硅分子筛催化(a)环己酮BV氧化、(b)氧化环己烯水合反应性能与可接近性Lewis酸(LAS)酸量之间的关联(根据文献[46]修改)
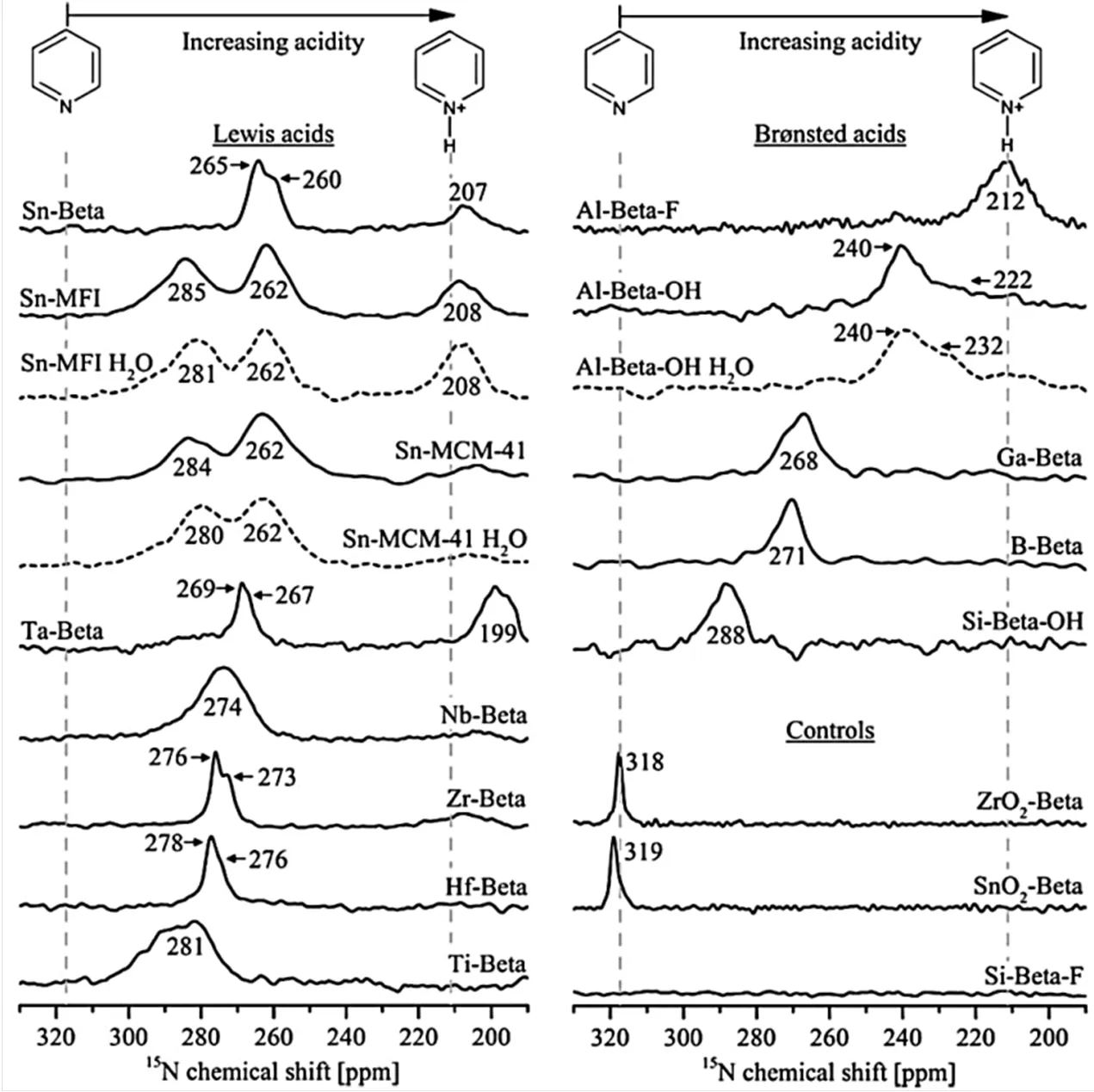
图10 各种金属掺杂分子筛吸附吡啶的15N CP MAS NMR谱图(根据文献[48]修改)
Davis等[6]利用13C MAS NMR结合13C标记的葡萄糖和果糖分子研究了Sn-Beta分子筛催化转化葡萄糖异构化的反应历程.如图11(A)所示,葡萄糖和果糖吸附在无活性中心的Si-Beta分子筛上的化学位移在C60~100 [图11A(a,b)];而当它们分别吸附在含有Lewis酸中心的Sn-Beta分子筛上时,明显产生了一系列新的13C NMR信号[C30、130、180和214;图11A(c,d)].特别是C214信号的出现证实有羰基分子(醛或酮)生成,结合图11(B)的13C CP MAS NMR实验,进一步明确该信号为果糖开环结构上的酮基.辅以理论计算,他们推测葡萄糖首先在Sn-Beta分子筛的“open”锡位点发生开环,随后酮基碳原子经过氢迁移反应异构化生成果糖[6].
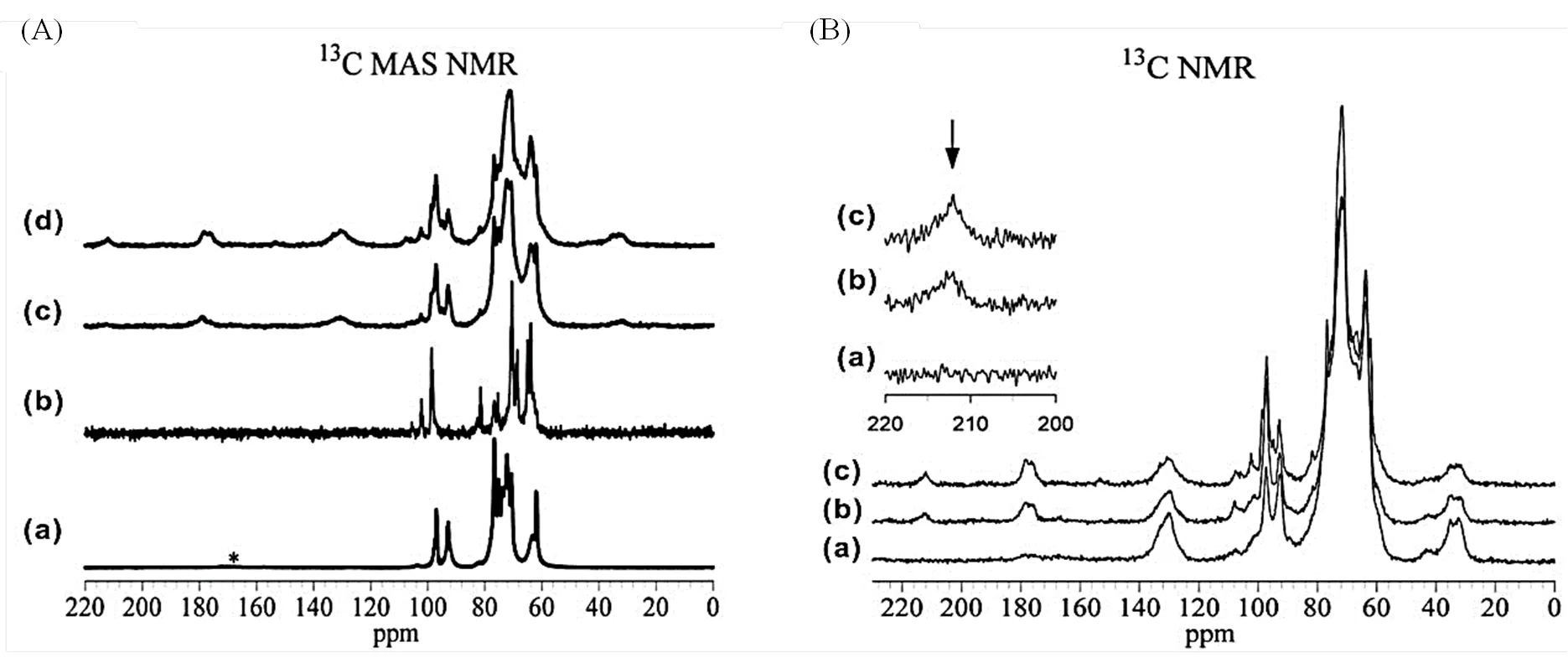
图11 (A) (a, c)葡萄糖和(b, d)果糖分别吸附在(a, b)Si-Beta和(c, d) Sn-Beta分子筛上的13C MAS NMR谱图.(B)果糖吸附在Sn-Beta分子筛上不同CP接触时间[(a) 0.1 ms, (b) 1.0 ms, (c)无CP]的CP MAS NMR谱图(根据文献[6]修改)
最近,Xu等[50]以丙酮和环己醇的MPVO反应为例,利用13C MAS NMR研究了Sn-Beta分子筛催化转化该过程的反应机理.研究发现,当丙酮吸附在Sn-Beta分子筛的“open”锡位点时(393 K脱水),在13C NMR谱上除了出现丙酮羰基信号(>C200)外,还额外观测到C76信号;而当减少Sn-Beta分子筛的“open”锡位点时(673 K脱水),C76信号强度明显降低[图12(A)].结合理论模拟,他们将该信号归属为“open”锡位点的羟基加成到丙酮羰基碳原子而生成的偕二醇物种.基于固体NMR实验与理论计算结果,他们证实这种偕二醇反应中间体具有较高的催化反应活性,不仅能协助促进环己醇分子在“open”锡位点上的吸附,还能进一步促进环己醇的脱水与转化过程 [图12(B)][50].
4 总结与展望
锡硅分子筛在生物质绿色能源分子(如葡萄糖、果糖、乳酸和乳酸酐等)催化转化过程中具有优异的反应性能,有望缓解能源危机,具有重要的工业应用潜力.锡硅分子筛的活性中心结构及酸特性(酸类型、酸强度、酸浓度和酸分布等)与其催化反应性能(活性、选择性和反应机理)密切相关,准确构建其活性中心局域结构、酸性与催化反应性能之间的构效关系,能够为新型高效催化剂的合成、选择与改性提供理论指导,具有重要的现实意义与应用价值.固体NMR是研究锡硅分子筛等固体酸催化剂活性中心结构、酸性与催化反应机理的重要实验手段,本文着重总结了近年来固体NMR在锡硅分子筛相关研究中的进展.主要包括三个方面:1)119Sn、1H NMR以及二维相关实验可以提供锡硅分子筛活性中心的局域精细结构信息;2)NMR探针分子技术可以定性/定量表征锡硅分子筛的酸性特征;3)NMR能监测反应物种的转化历程、捕获活泼的反应中间体,为催化反应机理的研究提供重要的实验证据.
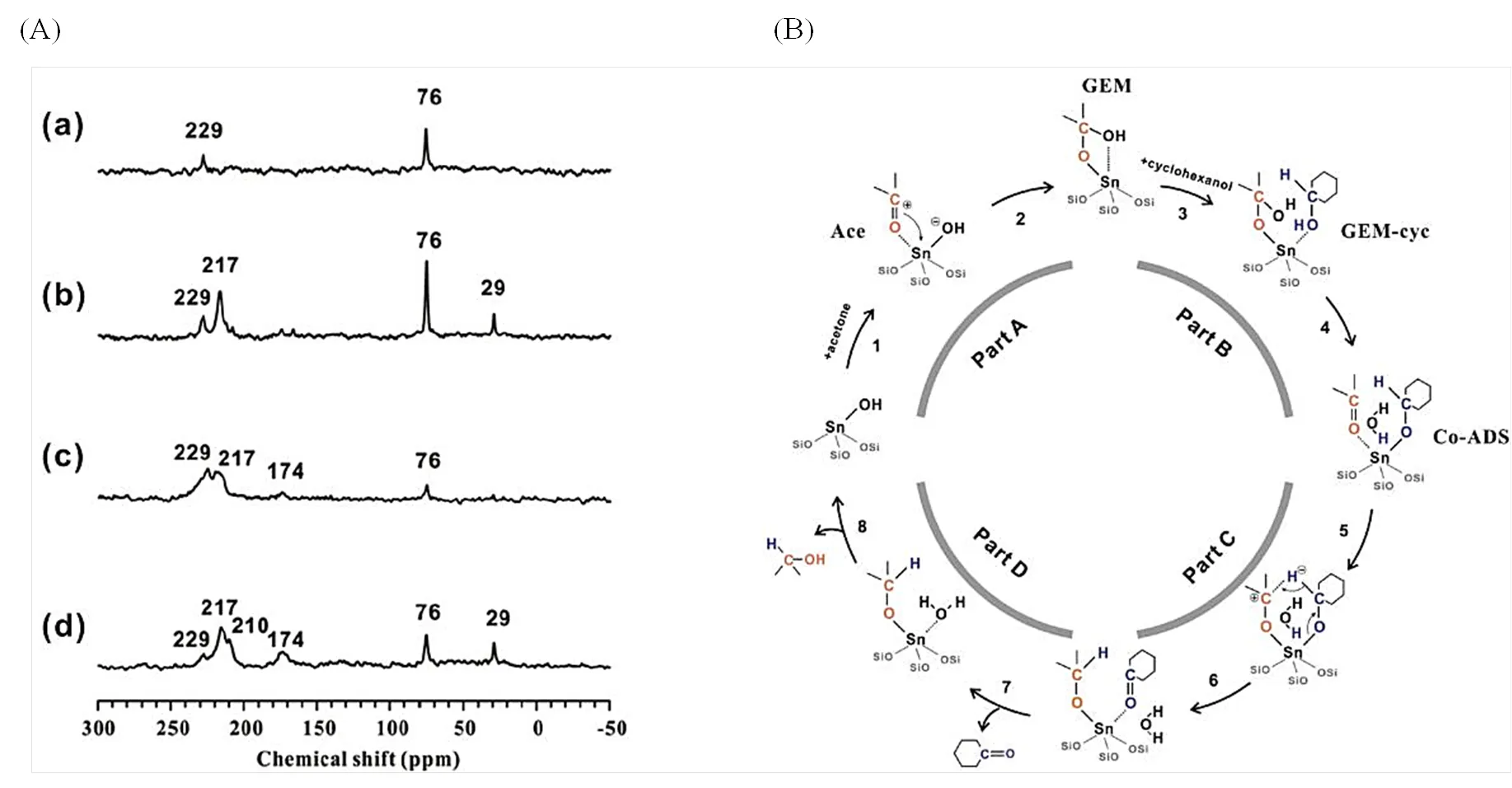
图12 (A) (a) 30 mmol×g-1、(b) 100 mmol×g-1的丙酮吸附在393 K脱水的Sn-Beta分子筛上,以及(c) 30 mmol×g-1、(d) 100 mmol×g-1的丙酮吸附在673 K脱水的Sn-Beta分子筛上的13C CP MAS NMR谱图.(B) Sn-Beta分子筛催化丙酮与环己醇反应机理(根据文献[50]修改)
尽管在该领域人们目前已经取得了一定的进展,但仍存在一定的限制与挑战,比如119Sn NMR谱图信噪比、灵敏度与分辨率有待进一步提升,先进二维NMR技术在空间结构解析上的开发与应用亟需加强,以及真实反应条件下活性中心结构、酸性与反应机理的原位表征等等.随着未来NMR谱仪硬件的不断更新、先进脉冲技术的持续开发,固体NMR将越来越成为锡硅分子筛等固体酸催化领域的高效可靠的研究利器,推动催化科学与NMR谱学领域的交叉融合与持续发展.
感谢石油化工催化材料与反应工程国家重点实验室(中国石油化工股份有限公司石油化工科学研究院)开放基金课题(33600000-20-ZC0607-0024)和国家自然科学基金(22032005和21802164)对本研究工作的资助.
无
[1] ROGELJ J, NABEL J, CHEN C, et al. Copenhagen accord pledges are paltry[J]. Nature, 2010, 464(7292): 1126-1128.
[2] RAGAUSKAS A J, WILLIAMS C K, DAVISON B H, et al. The path forward for biofuels and biomaterials[J]. Science, 2006, 311(5760): 484-489.
[3] ALVIRA P, TOMáS-PEJó E, BALLESTEROSM, et al. Pretreatment technologies for an efficient bioethanol production process based on enzymatic hydrolysis: A review[J]. Bioresource Technol, 2010, 101(13): 4851-4861.
[4] MOLINER M, ROMáN-LESHKOV Y, DAVIS M E. Tin-containing zeolites are highly active catalysts for the isomerization of glucose in water[J]. Proc Natl Acad Sci USA, 2010, 107(14): 6164-6168.
[5] ROMáN-LESHKOV Y, MOLINER M, LABINGER J A, et al. Mechanism of glucose isomerization using a solid Lewis acid catalyst in water[J]. Angew Chem Int Ed, 2010, 49(47): 8954-8957.
[6] BERMEJO-DEVAL R, ASSARY R S, NIKOLLA E, et al. Metalloenzyme-like catalyzed isomerizations of sugars by Lewis acid zeolites[J]. Proc Natl Acad Sci USA, 2012, 109(25): 9727-9732.
[7] NIKOLLA E, ROMáN-LESHKOV Y, MOLINER M, et al. “One-Pot” synthesis of 5-(hydroxymethyl)furfural from carbohydrates using tin-Beta zeolite[J]. ACS Catal, 2011, 1(4): 408-410.
[8] HOLM M S, SARAVANAMURUGAN S, TAARNING E. Conversion of sugars to lactic acid derivatives using heterogeneous zeotype catalysts[J]. Science, 2010, 328(5978): 602-605.
[9] ZHANG X, WILSON K, LEE A F. Heterogeneously catalyzed hydrothermal processing of C5-C6sugars[J]. Chem Rev, 2016, 116(19): 12328-12368.
[10] MIKA L T, CSEFALVAY E, NEMETH A. Catalytic conversion of carbohydrates to initial platform chemicals: Chemistry and sustainability[J]. Chem Rev, 2018, 118(2): 505-613.
[11] BORONAT M, CORMA A, RENZ M. Mechanism of the Meerwein-Ponndorf-Verley-Oppenauer (MPVO) redox equilibrium on Sn- and Zr-Beta zeolite catalysts[J]. J Phys Chem B, 2006, 110(42): 21168-21174.
[12] CORMA A, DOMINE M E, VALENCIA S. Water-resistant solid Lewis acid catalysts: Meerwein–Ponndorf–Verley and Oppenauer reactions catalyzed by tin-beta zeolite[J]. J Catal, 2003, 215(2): 294-304.
[13] LIU Y J, XIAO Y, XIA C J, et al. Insight into the effects of acid characteristics on the catalytic performance of Sn-MFI zeolites in the transformation of dihydroxyacetone to methyl lactate[J]. J Catal, 2020, 391: 386-396.
[14] CORMA A, NEMETH L T, RENZ M, et al. Sn-zeolite beta as a heterogeneous chemoselective catalyst for Baeyer-Villiger oxidations[J]. Nature, 2001, 412(6845): 423-425.
[15] ZHENG A M, LI S H, LIU S B, et al. Acidic properties and structure-activity correlations of solid acid catalysts revealed by solid-state NMR spectroscopy[J]. Acc Chem Res, 2016, 49(4): 655-663.
[16] KLINOWSKI J. Solid-state NMR studies of molecular sieve catalysts[J]. Chem Rev 1991, 91(7): 1459-1479.
[17] JIANG Y J, HUANG J, DAI W L, et al. Solid-state nuclear magnetic resonance investigations of the nature, property, and activity of acid sites on solid catalysts[J]. Solid State Nucl Magn Reson, 2011, 39(3-4): 116-141.
[18] WANG Z C, JIANG Y J, BAIKER A, et al. Pentacoordinated aluminum species: New frontier for tailoring acidity-enhanced silica–alumina catalysts[J]. Acc Chem Res, 2020, 53(11): 2648-2658.
[19] SUN T T, XU S T, XIAO D, et al. Water-induced structural dynamic process in molecular sieves under mild hydrothermal conditions: Ship-in-a-bottle strategy for acidity identification and catalyst modification[J]. Angew Chem, 2020, 132(46): 20853-20862.
[20] GONG K, LIU Z M, LIANG L X, et al. Acidity and local confinement effect in mordenite probed by solid-state NMR spectroscopy[J]. J Phys Chem Lett, 2021, 12(9): 2413-2422.
[21] ZHENG A M, LIU S B, DENG F.31P NMR chemical shifts of phosphorus probes as reliable and practical acidity scales for solid and liquid catalysts[J]. Chem Rev, 2017, 117(19): 12475-12531.
[22] YI X, PENG Y K, CHEN W, et al. Surface fingerprinting of faceted metal oxides and porous zeolite catalysts by probe-assisted solid-state NMR approaches[J]. Acc Chem Res, 2021, 54(10): 2421-2433.
[23] XU S T, ZHENG A M, WEI Y X, et al. Direct observation of cyclic carbenium Ions and their role in the catalytic cycle of the methanol-to-olefin reaction over chabazite zeolites[J]. Angew Chem Int Ed, 2013, 52(44): 11564-11568.
[24] WOLF P, VALLA M, ROSSINI A J, et al. NMR signatures of the active sites in Sn-β zeolite[J].Angew Chem, 2014, 126(38): 10343-10347.
[25] KOLYAGIN Y G, YAKIMOV A V, TOLBORG S, et al. Application of119Sn CPMG MAS NMR for fast characterization of Sn sites in zeolites with natural119Sn isotope abundance[J]. J Phys Chem Lett, 2016, 7(7): 1249-1253.
[26] YAKIMOV A V, KOLYAGIN Y G, TOLBORG S, et al.119Sn MAS NMR study of the interaction of probe molecules with Sn-BEA: The origin of penta- and hexacoordinated tin formation[J]. J Phys Chem C, 2016, 120(49): 28083-28092.
[27] SUSHKEVICH V L, KOTS P A, KOLYAGIN Y G, et al. Origin of water-induced Brønsted acid sites in Sn-BEA zeolites[J]. J Phys Chem C, 2019, 123(9): 5540-5548.
[28] WOLF P, VALLA M, NúñEZ-ZARUR F, et al. Correlating synthetic methods, morphology, atomic-level structure, and catalytic activity of Sn-β catalysts[J]. ACS Catal, 2016, 6(7): 4047-4063.
[29] ROY S, BAKHMUTSKY K, MAHMOUD E, et al. Probing Lewis acid sites in Sn-Beta zeolite[J]. ACS Catal, 2013, 3(4): 573-580.
[30] KOLYAGIN Y G, YAKIMOV A V, TOLBORG S, et al. Direct observation of tin in different T-sites of Sn-BEA by one- and two-dimensional119Sn MAS NMR spectroscopy[J]. J Phys Chem Lett, 2018, 9(13): 3738-3743.
[31] WOLF P, LIAO W C, ONG T C, et al. Identifying Sn site heterogeneities prevalent among Sn-Beta zeolites[J].Helvetica Chimica Acta,2016, 99(12): 916-927.
[32] GUNTHER W R, MICHAELIS V K, CAPORINI M A, et al. Dynamic nuclear polarization NMR enables the analysis of Sn-Beta zeolite prepared with natural abundance119Sn precursors[J]. J Am Chem Soc, 2014, 136(17): 6219-6222.
[33] DIJKMANS J, DUSSELIER M, GABRIëLS D, et al. Cooperative catalysis for multistep biomass conversion with Sn/Al Beta zeolite[J]. ACS Catal., 2015, 5(2): 928-940.
[34] OVERHAUSER A W. Polarization of nuclei in metals[J]. Phys Rev, 1953, 92(2): 411-415.
[35] BARKER W A. Dynamic nuclear polarization[J]. Rev Mod Phys, 1962, 34(2): 173-185.
[36] QI G D, WANG Q, XU J, et al. Direct observation of tin sites and their reversible interconversion in zeolites by solid-state NMR spectroscopy[J]. Commun Chem, 2018, 1(1): 22.
[37] ZHAO S F, HE S L, DUKIM K, et al. Influence of hierarchical ZSM-5 catalysts with various acidity on the dehydration of glycerol to acrolein[J]. Magn Reson Lett, 2021, 1(1): 71-80.
[38] LUNSFORD J L, ROTHWELL W P, SHEN W. Acid sites in zeolite Y: A solid-state NMR and infrared study using trimethylphosphine as a probe molecule[J]. J Am Chem Soc, 1985, 107(6): 1540-1547.
[39] TRICKETT C A, OSBORN-POPP T M, SU J, et al. Identification of the strong Brønsted acid site in a metal-organic framework solid acid catalyst[J]. Nat Chem, 2019, 11: 170-176.
[40] GAO X Z, ZHANG Y, WANG X M, et al. Structure and acidity changes in ultra-stable Y zeolites during hydrothermal aging: A solid-state NMR spectroscopy study[J]. Chinese J Magn Reson, 2020, 37(1): 95-103.
高秀枝, 张翊, 王秀梅, 等. NMR研究超稳Y分子筛水热老化过程中结构与酸性的变化[J]. 波谱学杂志, 2020, 37(1): 95-103.
[41] XU C, CAI Z, WANG Q, et al. Preparation of biodiesel using silver-modified phosphotungstic acid as catalyst[J]. Chinese J Magn Reson 2020, 37(1): 86-94.
徐超, 蔡哲, 王晴, 等. 银改性磷钨酸催化制备生物柴油工艺研究[J]. 波谱学杂志, 2020, 37(1): 86-94.
[42] YI X F, LIU K Y, CHEN W, et al. Origin and structural characteristics of tri-coordinated extra-framework aluminum species in dealuminated zeolites[J]. J Am Chem Soc, 2018, 140(34): 10764-10774.
[43] YI X F, XIAO Y, LI G C, et al. From one to two: Acidic proton spatial networks in porous zeolite materials[J]. Chem Mater, 2020, 32(3): 1332-1342.
[44] YI X F, KO H, DENG F, et al. Solid-state31P NMR mapping of active centers and relevant spatial correlations in solid acid catalysts[J]. Nat Protoc, 2020, 15: 3527-3555.
[45] LEWIS J D, HA M, LUO H, et al. Distinguishing active site identity in Sn-Beta zeolites using31P MAS NMR of adsorbed trimethylphosphine oxide[J]. ACS Catal, 2018, 8(4): 3076-3086.
[46] DAI W L, LEI Q F, WU G J, et al. Spectroscopic signature of Lewis acidic framework and extraframework Sn sites in Beta zeolites[J]. ACS Catal, 2020, 10(23): 14135-14146.
[47] KIM K D, WANG Z C, JIANG Y J, et al. The cooperative effect of Lewis and Brønsted acid sites on Sn-MCM-41 catalysts for the conversion of 1,3-dihydroxyacetone to ethyl lactate[J]. Green Chem, 2019, 21(12): 3383-3393.
[48] GUNTHER W R, MICHAELIS V K, GRIFFIN R G, et al. Interrogating the Lewis acidity of metal sites in Beta zeolites with15N pyridine adsorption coupled with MAS NMR spectroscopy[J]. J Phys Chem C, 2016, 120(50): 28533-28544.
[49] HARRIS J W, LIAO WC, DI IORIO J R, et al. Molecular structure and confining environment of Sn sites in single-site chabazite zeolites[J]. Chem Mater, 2017, 29(20): 8824-8837.
[50] QI G D, CHU Y Y, WANG Q, et al. Gem-Diol-type intermediate in the activation of a ketone on Sn-β zeolite as studied by solid-state NMR spectroscopy[J]. Angew Chem, 2020, 59(44): 19532-19538.
Progress in the Studies on Sn-Zeolites by Solid-State Nuclear Magnetic Resonance
1,2,3,1#,1,2,4,1*
1. State Key Laboratory of Magnetic Resonance and Atomic and Molecular Physics, Innovation Academy for Precision Measurement Science and Technology, Chinese Academy of Sciences, Wuhan 430071, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. State Key Laboratory of Catalytic Materials and Reaction Engineering, Research Institute of Petroleum Processing, SINOPEC, Beijing 100083, China; 4. Institute of Atomic and Molecular Sciences, Taipei 10617, China
Due to their excellent catalytic performances in the conversion of biomass molecules such as glucose and lacticacid, the Sn-containing zeolite catalysts have received wide attention. Understanding detailed structures and acidity properties of the active sites and the corresponding catalytic reaction mechanisms is a critical step in developing fundamental insights into the catalytic function and exploiting more highly active zeolite catalysts. Solid-state nuclear magnetic resonance (NMR) spectroscopy provides useful information on the local structures and acidity properties of active centers, as well as the catalytic reaction mechanisms in zeolites. This review briefly introduces the application of solid-state NMR technique in the studies on Sn-containing zeolites. Further challenges and perspectives are also discussed.
solid-state nuclear magnetic resonance (NMR), Sn-zeolite, active center, acidity, reaction mechanism
O482.53
A
10.11938/cjmr20212926
2021-06-28;
2021-08-14
石油化工催化材料与反应工程国家重点实验室(中国石油化工股份有限公司石油化工科学研究院)开放基金课题资助(33600000-20-ZC0607-0024);国家自然科学基金资助项目(22032005, 21802164).
* Tel: 027-87197127, E-mail:zhenganm@wipm.ac.cn;
# Tel: 027-87197127, E-mail: yxf@wipm.ac.cn.

