经导管主动脉瓣置换术后三度房室传导阻滞植入无导线起搏器一例
崔腾飞, 杨 光
1 病例介绍
患者,男,90岁,因“气短2 d”于2020年12月12日入院。1个月前因“主动脉瓣重度狭窄及腹主动脉溃疡”于北京安贞医院行“经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)、腹主动脉支架植入术”,术后规律口服阿司匹林及氯吡格雷,否认糖尿病、高血压病史。患者于入院2 d前无明显诱因出现气短,呈持续性,与活动无关,伴恶心、乏力,遂就诊于我院。查体:脉搏35次/min,呼吸16次/min,血压168/42 mmHg,神志清,口唇无发绀,结膜略苍白,两肺呼吸音粗,双肺底可闻及少许湿性音,心界无扩大,心率35次/min,心律不齐,可闻及大炮音,双下肢无水肿。心电图示三度房室传导阻滞(见图1)。N末端脑钠肽前体4 272 pg/ml,心肌梗死三项未见异常。于12月12日16时植入临时心脏起搏器(起搏电压2 V,感知灵敏度2.0 mV,起搏频率60次/min),术后给予扩血管,抗感染,间断利尿等治疗。患者于12月16日2时心电监护示自主心律,考虑该患者再次出现心律失常的可能性大,建议行“无导线心脏起搏器植入术”。经患者家属知情同意后,于12月16日10时植入无导线起搏器(起搏电压阈值0.75 V,阻抗1 030 Ω,起搏频率50次/min)(见图2)。术后第2天,起搏器工作良好,患者下肢可活动。后行进一步检查,胸部CT平扫示双肺炎症,心包积液。主动脉支架植入术后,主动脉及冠脉壁钙化,两侧胸腔积液,右肺下叶膨胀不全。心脏彩超示射血分数60%,起搏器植入及主动脉瓣膜术后,主动脉瓣前向血流增高瓣关闭不全(中度),二尖瓣关闭不全(中度),三尖瓣反流(中度),肺动脉瓣高压(轻度),左室舒张功能减低,心包积液(少量)。继续相关治疗后,患者病情好转出院。随访至今1年7个月,患者生活质量改善明显。
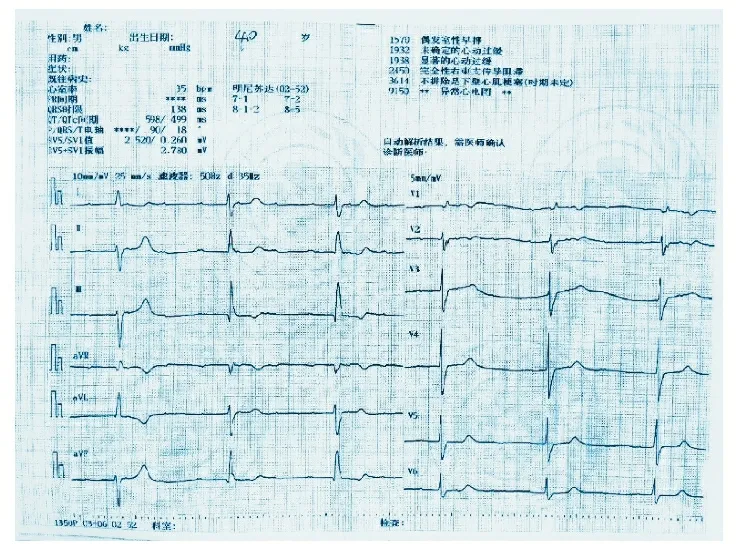
图1 心电图示室性早搏,三度房室传导阻滞
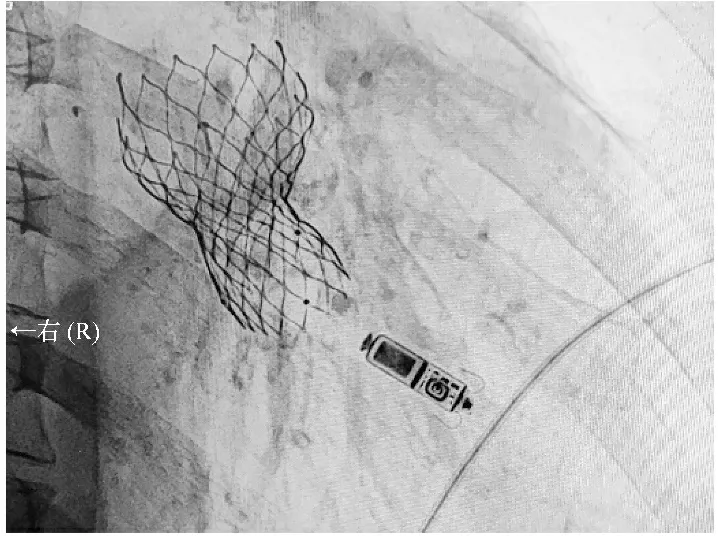
图2 X线透视下显示起搏器已固定于右心室
2 讨论
2.1TAVR是治疗主动脉瓣重度狭窄的常用手术方案,其主要并发症包括传导阻滞、瓣周漏、卒中、心肌梗死等。三度房室传导阻滞,又称完全性房室传导阻滞,是一种由于房室传导系统功能障碍而导致来自房室交界区以上的传导冲动下传受阻的缓慢性心律失常,其极易造成血流动力学不稳定,导致晕厥甚至猝死。导致永久起搏器植入的房室传导阻滞大多数发生于TAVR术中和术后1个月内,少部分患者发生在术后1个月至6个月内[1]。对于TAVR术后发生高度或者完全性房室传导阻滞已恢复的患者,数周到数月内出现危及生命的心律失常的风险仍然很高,而在48 h内未恢复的患者,应植入心脏永久起搏器[2]。
2.2传统起搏器需制作囊袋放置脉冲发生器和经静脉植入电极导线,易引起囊袋感染、血肿和电极脱位、断裂等并发症,其发生率约为10%[3]。20世纪70年代,Spickler等[4]提出了无导线起搏器的设想,即将脉冲发生器和电极整合为一体,通过递送系统经静脉直接将起搏器植入右心室。随着电池、程控等技术的发展及革新,无导线起搏器开始应用于临床。目前商业化的无导线起搏器主要有2012年圣犹达公司推出的Nanostim无导线起搏器(LCP)和2013年美敦力公司推出的Micra经皮起搏系统(TPS),两者均通过可调弯递送系统经股静脉植入,但它们在外径大小、固定方式等方面不同:Nanostim LCP外径为4.14 cm×0.59 cm,预期使用寿命为9~10年,经18F鞘管植入,采用顶部的螺旋结构主动固定到右心室;而Micra TPS外径为2.59 cm×0.67 cm,预期使用寿命为7~15年,使用23F鞘管植入,通过顶端的4个镍钛倒钩被动固定于右心室。
2.3本例患者植入的是Micra TPS,又称为“胶囊起搏器”,是目前临床上所应用的最小的无导线起搏器,较传统起搏器体积减少了约90%,植入时无需制作囊袋及放置连接导线。对Micra TPS的研究中证实了其安全性及有效性,其植入成功率高达99.2%,平均手术时间约28 min,随访6个月,与传统起搏器相比,囊袋血肿、电极脱位等主要并发症发生率下降了51%[5-6]。因此Micra TPS特别适用于低体质量指数、长期服用抗凝或抗小板药物以及三尖瓣重度反流或机械瓣等高龄老年患者。并且Micra TPS可接受1.5T和3.0T磁共振成像检查,Kiblboeck等[7]和Blessberger等[8]对14例患者在接受MRI扫描后的3个月随访中,未发现不良事件,设备参数较MRI扫描前以及在1.5T和3.0T之间无显著差异。
综上所述,植入永久起搏器是治疗TAVR术后并发三度房室传导阻滞的有效手段,无导线起搏器具有植入成功率高、手术时间短、创伤小以及并发症少等优点,并且可实现房室顺序起搏的双腔无导线起搏器也开始应用于临床。随着无导线起搏器的优化和改进,更多的患者将会从中获益。

