水飞蓟宾缓解油酸诱导的HepG2细胞脂质沉积的机制探讨
肖素军, 肖亚君, 吴培赛, 彭忠田
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)是常见的慢性肝病,临床上组织学和影像学检查显示超过5%肝细胞出现脂肪变性[1],且无继发性病因,如药物、过量饮酒等。在全球范围内,NAFLD的发病率约为25%[2]。尽管脂肪变性本身是相对良性且可逆的,但仍有8%~20%的单纯肝细胞脂肪变性会进展为非酒精性肝炎(nonalcoholic steatohepatitis,NASH),甚至肝纤维化或肝癌[3-4]。NAFLD的主要发病机制是脂质代谢失衡以及肝脏脂毒性的产生。研究表明,自噬在NAFLD的发生和发展中也起着至关重要的作用[5-9]。水飞蓟宾(silibinin)是从水飞蓟的果实中提取的水飞蓟素,是一种包含活性黄酮木素和类黄酮的混合物,具有清除自由基、抗氧化和抗炎症的功能[10]。目前水飞蓟宾在临床上主要用于治疗慢性肝炎、急性肝炎、肝脏脂肪变性以及肝硬化等疾病,但对于其是否通过激活自噬通路机制来缓解NAFLD,目前仍鲜有研究。鉴此,本研究旨在通过构建油酸诱导的HepG2细胞脂肪变性模型,探讨水飞蓟宾缓解HepG2细胞脂质沉积的机制。现报道如下。
1 材料与方法
1.1主要材料 HepG2细胞由湖南医药学院生物医学中心保存并提供。主要试剂和仪器:水飞蓟宾(sigma,Lot:6015V52LB)、油酸(sigma,Lot:0459K0731V)、氯喹(Macklin,CAS:54-05-7)、油红O(sigma-aldrich,O9755)、重组Anti-LC3B抗体(abcam,ab192890)、GAPDH抗体(proteintech,10494-1-AP)、HRP-抗兔IgG(中杉金桥,ZB-5301)、甘油三酯(triglyceride,TG)检测试剂盒(南京建成,A110-1-1)、BCA检测试剂盒(碧云天,BD0028)、显微镜(奥林巴斯BX53)、凝胶成像系统(Tanon-5200)、SpectraMax M5-多功能酶标仪。
1.2实验方法
1.2.1 药物配置 (1)水飞蓟宾:溶解于DMSO中,配置成1×104μM母液,使用时稀释1 000倍,终浓度为10 μM。(2)氯喹:溶解于双蒸水中,配置成60 mM母液,使用时稀释1 000倍使用,终浓度为60 μM。(3)油酸:溶解在无水乙醇中,配置成40 mM母液,70 ℃水浴30 min助溶,用0.22 μm滤器过滤除菌,-80 ℃分装保存,使用时用1%无脂肪酸BSA-MEM培养基稀释100倍,终浓度为0.4 mM。
1.2.2 构建油酸诱导的HepG2细胞脂肪变性模型[11]
用含10%胎牛血清(fetal bovine serum,FBS)的DMEM高糖培养基培养HepG2细胞,待细胞生长至融合度约60%时,用不含脂肪酸的1% BSA-MEM培养细胞过夜。对照组继续用不含脂肪酸的1% BSA-MEM培养,油酸组(OA组)、油酸+水飞蓟宾组(OA+S组)、油酸+氯喹组(OA+CQ组)、油酸+氯喹+水飞蓟宾组(OA+CQ+S组)均加入0.4 mM油酸,AO+S组在油酸刺激24 h后加入10 μM的水飞蓟宾继续培养24 h。OA+CQ组采用油酸刺激24 h后再加入60 μM氯喹继续培养24 h。OA+CQ+S组则在油酸刺激24 h后,用60 μM氯喹预处理1 h,再加入水飞蓟宾继续培养24 h。
1.2.3 油红O染色 将0.5 g油红O粉末加入到100 ml异丙醇中,配置成0.5%油红O母液,60 ℃水浴溶解。使用时,取6 ml油红加入4 ml双蒸水,双层滤纸过滤,制备油红O工作液,全程避光(油红O工作液现配现用)。用磷酸盐缓冲盐溶液(phosphate buffered saline,PBS)将细胞洗3次,吸净PBS,加入4%多聚甲醛固定15 min。弃去固定液,双蒸水洗两次,待细胞培养板干燥后,加入油红O工作液反应25 min。用双蒸水清洗两次,而后用异丙醇溶液漂洗5 s,加入适量双蒸水洗涤,待样品干燥后在显微镜下观察。
1.2.4 Western blot检测 裂解细胞后用BCA试剂盒检测蛋白浓度,蛋白质通过12% SDS-PAGE分离,转移到0.22 μm PVDF固定膜上,并分别置入LC3B抗体(用含5% BSA的TBST液稀释,稀释比例为1∶1 000)、GAPDH抗体(用含5%BSA的TBST液稀释,稀释比例为1∶10 000),4℃孵育过夜。用辣根过氧化物酶标记的IgG进行印迹分析。用Image J软件进行灰度值分析,以LC3BⅡ灰度值与LC3BⅠ灰度值的比值表示LC3蛋白表达量。
1.2.5 TG检测 用胰酶消化细胞,以1 000 r/min条件离心10 min,弃上清液,留细胞沉淀。用PBS洗两次,再次以1 000 r/min离心10 min,弃上清。加入300 μl PBS,冰水浴条件下通过超声破碎(功率300 W,5 s/次,间隔1 min,重复5次),制备好的匀浆液,在酶标仪下通过波长510 nm光进行检测。
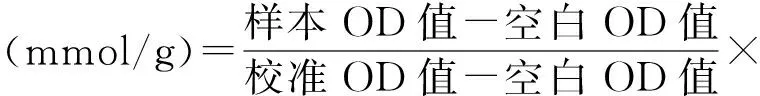
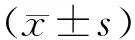
2 结果
2.1各干预组HepG2细胞脂质沉积情况 油红O染色结果显示,OA组脂质沉积程度较对照组明显,提示0.4 mM能够引起HepG2细胞脂肪变性,造模成功。OA+S组HepG2细胞内脂质沉积的程度较OA组轻,提示水飞蓟宾可缓解油酸诱导的HepG2细胞脂质沉积。OA+CQ+S组HepG2细胞内出现显著脂质沉积,与OA组情况相似。见图1。
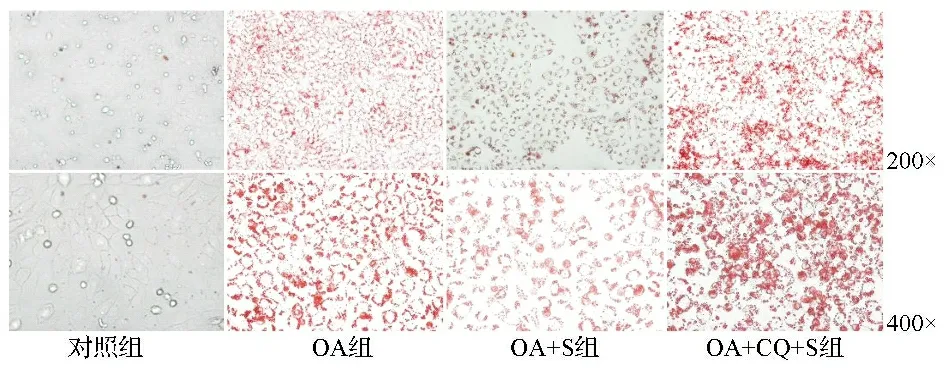
图1 显微镜下观察HepG2细胞脂质沉积所见(油红O染色)
2.2各干预组TG水平比较 经油酸处理后,HepG2细胞TG水平上升,OA组、OA+S组、OA+CQ+S组的TG水平均高于对照组,差异有统计学意义(P<0.05)。水飞蓟宾处理后,HepG2细胞的TG水平获得下调,OA+S组TG水平显著低于OA组(P<0.05)。但水飞蓟宾的干预效应会受到氯喹的阻断,OA+CQ+S组的TG水平显著高于OA+S组(P<0.05),但与OA组比较差异无统计学意义(P>0.05)。见表1。
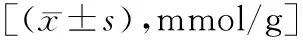
表1 各干预组TG水平比较
2.3各干预组LC3BⅡ/LC3BⅠ水平比较 油酸刺激后LC3BⅡ/LC3BⅠ水平下调,OA组与对照组比较差异有统计学意义(P<0.05)。油酸刺激后再加入水飞蓟宾处理24 h,LC3BⅡ/LC3BⅠ水平上调,OA+S组与OA组比较差异有统计学意义(P<0.05),与对照组比较差异无统计学意义(P>0.05)。应用自噬抑制剂氯喹处理后,LC3BⅡ/LC3BⅠ水平上调,OA+CQ组、OA+CQ+S组与对照组、OA组及OA+S组比较差异有统计学意义(P<0.05)。见图2,表2。
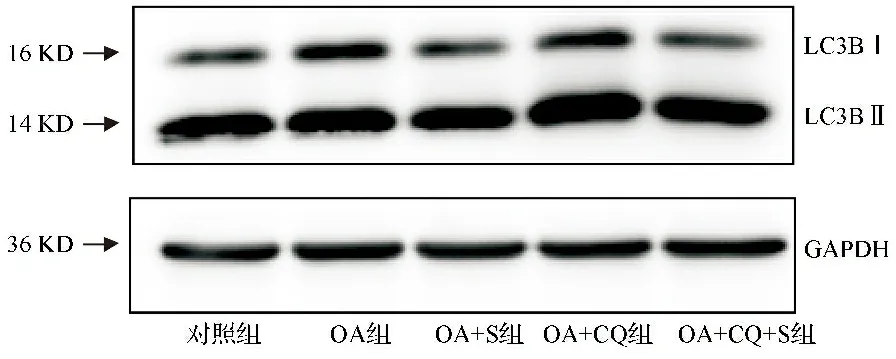
图2 Western blot检测自噬标志蛋白LC3BⅡ/LC3BⅠ结果图
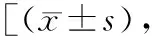
表2 各干预组LC3BⅡ/LC3BⅠ水平比较灰度值]
3 讨论
3.1NAFLD始于肝脏中TG的异常积累,严重者可进展为肝损伤、肝纤维化。肝脏脂肪变性与营养过剩、肥胖、胰岛素抵抗等密切相关。肝损伤与多种机制有关,包括肝细胞凋亡、内质网应激、自噬和线粒体功能障碍、免疫反应的改变和炎性细胞因子的增加[12]。因此,NAFLD是多因素参与的病理过程。自噬是机体的一种保护性反应,有助于维持机体稳态并促进细胞生存。脂质吞噬是细胞内双层膜包裹脂滴,并将其输送至溶酶体进行降解,是一种特殊的自噬。脂质吞噬能将细胞内异常脂滴降解以使细胞处于稳态。越来越多的证据表明,在NAFLD患者以及NAFLD动物模型中肝脏自噬受到损伤,高胰岛素血症和一些自噬相关的蛋白如Atg7和Atg5的下调与自噬体的形成障碍有关[13]。自噬异常可以导致肝脏脂质积累、损伤以及炎症,甚至纤维化和癌变。
3.2目前,对于NAFLD缺乏有效的治疗措施,最好的方法仅限于平衡饮食、规律体育锻炼和减重等生活方式层面上的干预[14]。水飞蓟宾是从植物水飞蓟中提取的一种天然黄酮类化合物,具有稳定肝细胞膜、抗氧化以及保护肝脏等作用,临床上用于护肝治疗。研究表明,水飞蓟宾在NAFLD患者中的治疗作用,包括降低谷丙转氨酶(alanine aminotransferase,ALT)和谷草转氨酶(aspartate aminotransferase,AST)水平,改善胰岛素抵抗,降低血浆总胆固醇、TG、低密度脂蛋白-胆固醇(low-density lipoprotein-cholesterol,LDL-C)水平[15]。研究表明,水飞蓟宾可降低大鼠血清TG水平,减轻肝脏相对重量和肝细胞脂质沉积,改善胰岛素抵抗,上调脂肪分解相关基因脂肪甘油三酯脂肪酶(adipose triglyceride lipase,ATGL)的表达,从而改善高脂饮食引起的肝脏损伤[16]。然而,水飞蓟宾减轻NAFLD的机制尚未完全了解。
3.3NAFLD主要表现为大泡样脂肪变性,是肝脏对饮食和脂肪组织高水平脂肪酸的反应[17]。饱和棕榈酸(PA,16∶0)和单不饱和油酸(OA,9-顺式18∶1)是饮食和血清中最为丰富的脂肪酸,进入肝细胞的脂肪酸(fatty acid,FA)主要合成TG[18]。本研究采用含0.4 mM油酸的1%无脂肪酸BSA-MEM培养HepG2细胞24 h,细胞内脂质明显增加,提示成功构建体外NAFLD模型。自噬过程中LC3/Atg8被Atg4在羧基端剪切,生成胞质LC3Ⅰ。LC3Ⅰ通过泛素样反应,使磷脂酰乙醇胺偶联,生成LC3Ⅱ,它可以附着到自噬体膜上,是自噬体的结构蛋白,最终LC3Ⅱ被溶酶体降解。本研究结果显示,加入油酸刺激24 h后,HepG2细胞内TG含量显著增加,且自噬相关蛋白LC3Ⅱ/LC3Ⅰ水平下调,提示油酸可用于诱导肝细胞脂肪变性,且能抑制细胞的自噬水平。加入油酸后用自噬抑制剂氯喹处理HepG2细胞,与单纯用油酸刺激比较,LC3BⅡ/LC3BⅠ水平上升,提示氯喹可通过抑制溶酶体功能抑制LC3Ⅱ的降解从而抑制自噬。在油酸刺激的基础上加入水飞蓟宾,HepG2细胞内TG含量显著降低,且细胞LC3BⅡ/LC3BⅠ水平有所恢复;而在油酸刺激HepG2细胞后,用自噬抑制剂氯喹预处理1 h,再加水飞蓟宾干预24 h,细胞TG含量显著增加,提示水飞蓟宾通过增强自噬缓解油酸诱导的HepG2细胞脂质沉积。
综上所述,通过油酸刺激HepG2细胞可以建立肝细胞脂肪变性的体外模型,水飞蓟宾通过增强自噬改善油酸诱导的HepG2细胞脂质沉积,为临床用药提供了理论依据。

