血清半乳糖凝集素-3与急性心肌梗死患者新发心房颤动的关联性研究
李庆宽, 覃绍明, 卢志红, 刘开有
心房颤动(atrial fibrillation,AF),是常见的心血管疾病,致死率、致残率高,严重危害人们的生命健康[1]。冠心病、高血压病及风湿性心脏病等是AF发生的危险因素,其中尤以急性心肌梗死(acute myocardial infarction,AMI)患者并发AF的临床情况最为复杂,且预后不佳。研究表明,AMI患者新发AF概率为7%~20%,新发AF会增加AMI患者心力衰竭、死亡、大出血和延长住院时间等不良事件的发生风险[2]。而且随着我国AMI患者人数的不断攀升,临床上合并AF的患者越来越多。如何尽早地识别这类患者,并及时进行干预是临床面临的一大难题。有研究证实,半乳糖凝集素-3(galectin-3,Gal-3)在AMI、AF等心血管疾病的发生过程中发挥重要作用[3],但其与AMI新发AF这一特殊人群的关系并未明确。本文旨在探讨Gal-3与AMI患者新发AF的关联,为临床诊治提供参考。
1 资料与方法
1.1一般资料 回顾性收集2018年10月至2019年12月我科收治的AMI合并新发AF患者30例(新发AF组),另选同期AMI未合并新发AF患者30例(非AF组),通过医院病历系统收集其资料。纳入标准:(1)符合AMI的临床诊断[4];(2)行急诊冠脉介入治疗术;(3)既往无AF发生史;(4)血清Gal-3等研究指标检测结果完整,病历资料完整。排除标准:(1)既往有风湿性心脏病、慢性心功能不全;(2)既往有慢性阻塞性肺疾病、甲状腺功能亢进、自身免疫性疾病、肝硬化和肿瘤疾病。
1.2AF诊断标准 根据2006年美国心脏病学会、美国心脏协会及欧洲心脏病学会联合制定的AF诊治指南[5]:心电图或心电监测能捕捉到持续30 s以上的AF,则定义为AF。本研究监测时长为3~5 d。
1.3方法 (1)应用医院病历系统收集两组患者的一般资料、合并症状、心功能情况以及实验室生化检查结果[包括血常规、肝肾功能、电解质、血脂、血糖、心肌酶、肌钙蛋白I(cardiac troponin I,cTnI)、超敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)、B型利钠肽前体(N-terminal prohormone of brain natriuretic peptide,NT-proBNP)]等资料。血常规采用SYSMEX XT-4000i血液分析仪进行检测;采用Cobas e 602免疫分析仪进行生化检测;采用Vivid E9型彩色多普勒超声诊断仪(美国GE公司)测量左室射血分数、左心房前后径及二尖瓣反流量;采用PHILIPS IntelliVue MP40心电监护仪连续监测患者住院期间的心电情况,每日进行12导联心电检查(MedEx麦迪克斯)。(2)抽取上肢外周静脉血10 ml,装于一支促凝管,离心后提取血清于-20 ℃冰箱保存备用,采用Gal-3酶联免疫吸附检测试剂盒(美国eBioscience公司)检测血清Gal-3。
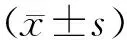
2 结果
2.1两组临床指标比较 单因素分析结果显示,新发AF组左心房前后径、NT-proBNP和血清Gal-3水平高于非AF组,差异有统计学意义(P<0.05)。其余指标在两组间比较差异无统计学意义(P>0.05)。见表1。
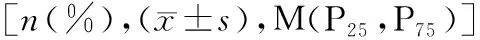
表1 两组临床指标比较
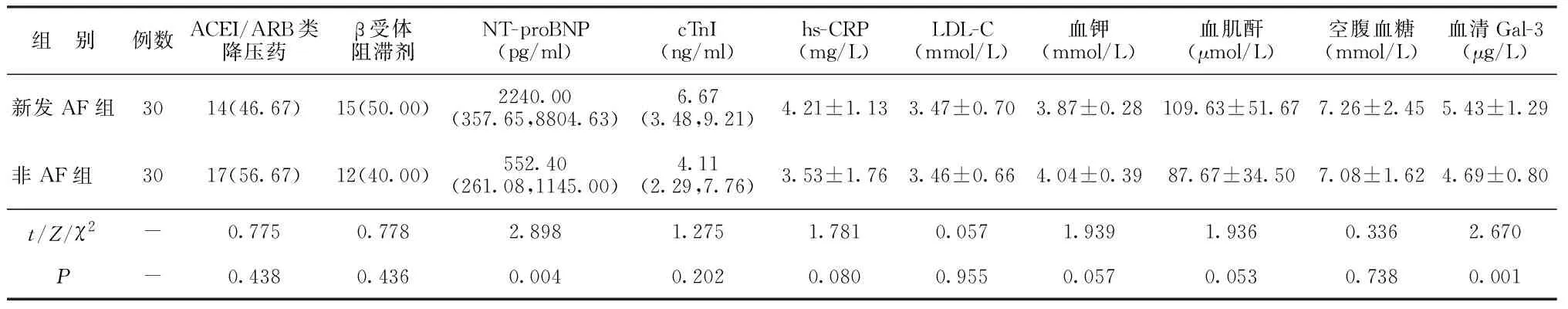
续表1
2.2AMI合并新发AF的多因素logistic回归分析结果 以是否新发AF为因变量(1=是,0=否),以单因素分析中有统计学意义的指标(血清Gal-3、NT-proBNP和左心房前后径)为自变量进行多因素logistic回归分析,结果显示,较高水平的血清Gal-3是促进AMI患者新发AF的危险因素(P<0.05)。见表2。
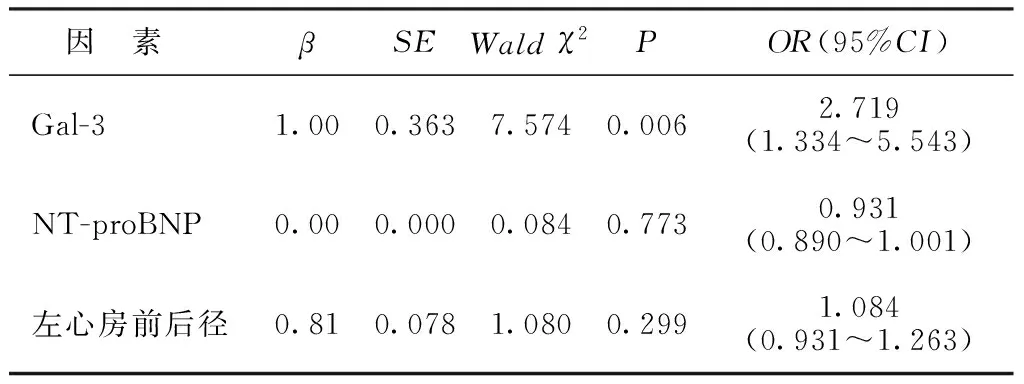
表2 AMI合并新发AF的多因素logistic回归分析结果
2.3血清Gal-3与NT-proBNP、左心房前后径的相关性分析结果 Pearson相关分析结果显示,AMI患者的血清Gal-3水平与NT-proBNP水平、左心房前后径呈显著正相关(r=0.773,P=0.000;r=0.518,P=0.000)。
3 讨论
3.1AMI是我国心血管疾病患者的主要病因之一,其发病率有逐年增高的趋势[6]。由于心肌缺血、血流动力学改变及氧化应激等因素,AMI患者常常并发AF[7],这不但加大了临床诊治的难度,而且还增加了患者的死亡风险。因此,如何识别这类高危患者,是临床亟待解决的问题。目前,对于AMI合并新发AF的预测主要依赖临床综合指标,如年龄、NT-proBNP、左室射血分数及左心房大小等[8],但实践证明这些指标临床价值有限,寻找更可靠、更客观的生化指标以预测AMI合并新发AF是当前的研究热点之一。
3.2Gal-3是β-半乳糖苷动物凝集素家庭成员之一,是一种强大的炎症因子,可调节细胞黏附、活化和趋化,参与免疫应答,并具有调节细胞生长与凋亡等作用[9]。Ho等[10]针对3 306位健康者进行了研究,结果发现基线血浆Gal-3水平高者其10年随访中发生AF的概率更高。Yalcin等[11]研究也发现,对于无器质性心脏病的AF患者,其血浆Gal-3水平与左心房磁共振延迟成像及左心房电-机械延迟现象具有相关性,认为血浆Gal-3与左心房重构相关,可反映左心房纤维化程度。推测Gal-3与左心房纤维化密切相关,可作为左房纤维化程度的指标。而心房纤维化是AF的病理基础之一,也是AF发生、发展的核心环节[12]。心房间质纤维化干扰了兴奋及冲动的传导,引起局部区域传导的异质性,导致传导减慢,引起单向阻滞和多子波折返的形成,阻滞区域存在的心房基质成分可以引起心电波的空间分离,从而构成了AF发生的病变基础[13]。基线血清Gal-3水平较高的AMI患者,代表着其左房纤维化程度更重[14],因此,在急性缺血因素诱发心电紊乱情况下更易发生AF。本研究发现,对于AMI患者,新发AF组的血清Gal-3水平显著高于非AF组。这也证实了以上的结论与观点。
3.3本研究发现,新发AF组血浆NT-proBNP、左心房前后径显著高于非AF组,这与既往的研究结果相似。高水平的NT-proBNP与AMI患者心肌梗死面积大相关,提示心肌重构的进程及不良预后[15]。有研究显示,NT-proBNP水平升高可提示梗死相关血管病变更严重或者罪犯血管为前降支[16]。相比于左室射血分数及临床心功能分级,NT-proBNP可更好地反映心功能状态。NT-proBNP水平越高,患者心功能越差,此时患者心房压力增加,心房牵拉导致心房有效不应期缩短,从而导致AF发生。而左心房大小在一定程度上是左心房纤维化的解剖表现,左心房越大则表明左心房纤维化越重,越可能导致AF的发生及维持[17]。本研究结果还发现,血清Gal-3水平与NT-proBNP、左心房前后径呈正相关。Gal-3是左房纤维化的生化标志,左心房前后径则是解剖标志,NT-proBNP水平则反映心肌缺血的程度,因此,临床上联合这三种标志物可能可以更好地预测AF的发生。
综上所述,在AMI患者中,血清Gal-3与NT-proBNP、左心房前后径呈正相关,具有作为预测AMI患者新发AF标志物的潜力。但本研究仍存在研究样本量偏小、随访时间短等缺点,也尚未能解释Gal-3是否参与了AMI新发AF的发生、发展过程,这有待更大规模的前瞻性临床研究进行验证。

