基于生物信息学的人P2X7R 结构分析及功能预测
张云芳,罗淑萍,李明萱,彭效祥,赵荣兰
(潍坊医学院医学检验学院,山东潍坊 261053)
核苷酸是核酸分子中的关键亚基,为细胞代谢提供能量,同时又可释放至胞外,生理上充当胞外信使或在病理情况下充当危险信号[1,2]。胞外核苷酸可通过激活嘌呤受体P2 发挥作用。P2 受体分为G 蛋白耦联型P2Y 受体和离子型P2X 受体。目前,P2X 受 体 可 以 分 成P2X1-7 七 种 亚 型[3]。其 中,P2X7R 是细胞外ATP 门控的非选择性阳离子通道受体,允许K+、Ca2+、Na+3 种阳离子通过[4,5]。该受体广泛表达于多种造血系细胞,例如单核细胞、巨噬细胞、淋巴细胞,神经细胞中小胶质细胞、少突胶质细胞,星形胶质细胞表面也存在P2X7R 的表达[6-8]。P2X7R 分布广泛,可通过多种信号通路参与调节组织及细胞的生理功能,影响多种疾病的发生、发展过程。
研究证明,P2X7R 的激活可引起多种细胞反应,例如质膜成分和形态的改变,胞外区脱落,脂肪酶、激酶和转录因子的激活,以及细胞因子的释放[9]。Baricordi 等[10]将P2X7R 转染至LG14 和K562细胞,发现P2X7R 可增强细胞增殖。P2X7R 参与肿瘤及炎症的发生发展,炎症与肿瘤相关,恶性肿瘤可在慢性炎症发生的部位发展,且炎症可促进肿瘤的发生;而肿瘤细胞释放的ATP 可作为P2X7R 的天然激动剂,通过激活P2X7R 参与炎症过程[11-13]。P2X7R 也可参与肿瘤细胞的转移、浸润,及侵袭等[14-16]。因此,针对P2X7R 的靶向治疗可能成为抗肿瘤的新途径,同时也可为P2X7R 相关的炎症性疾病提供新的治疗手段。目前,虽然对人P2X7 受体蛋白的研究逐渐深入,但对人P2X7R 蛋白结构及功能的生物信息学分析研究的报道较少。本研究用生物信息学方法对P2X7R 蛋白结构进行预测分析,为研究及开发其功能提供资料,为疾病的临床诊疗提供新思路。
1 材料与方法
1.1 材料
登录NCBI 主页获取人和其他物种P2X7R 的氨基酸序列,包括人(CAA73360.1)、小家鼠(CAA08853.1)、褐家鼠(CAA65131.1)、锡金小鼠(XP_021042566.1)、倭黑猩猩(XP_003832417.1)、猕猴(XP_001092531.2)。
1.2 方法
以从NCBI 获得的氨基酸序列为材料,登录ProtParam 网站分析蛋白序列的氨基酸数,分子量理论等电点(PI)、半衰期、稳定性指数、脂肪族指数和总平均亲水性。利用TMHMM、ProtScale 及SignalP 5.0 Server 分别分析蛋白跨膜区域、亲水/疏水性和信号肽。利用MEGA-X 软件构建系统进化树。蛋白质二级、三级结构由Sopma、Swiss-Model 和Structural Analysis 和Verification Server 进行预测。利用String 分析蛋白质的相互作用。利用ABCpred预测人P2X7R 蛋白可能的B 细胞抗原表位。利用ProPred 软件预测候选Th 抗原表位。利用CTLPred 预 测 人P2X7R 蛋 白 的CTL 细 胞 抗 原 表 位,算法基于支持向量机法(Support vector machine,SVM)和人工神经网络法(Artificial neural network,ANN),两种方法联合预测具有较高的灵敏度和特异性。
2 结果
2.1 人P2X7R 蛋白的理化性质预测
利用ProtParam 对人P2X7R 蛋白进行序列分析,发现该受体蛋白由595 个氨基酸组成,负电荷残基数(Asp+Glu)为62,正电荷残基数(Arg+Lys)为75。其中,含量最多的氨基酸是亮氨酸,占8.1%,其次是丝氨酸、缬氨酸及精氨酸,分别占6.7%、6.6%及6.6%,甲硫氨酸的含量最少,仅占1.3%,吡咯赖氨酸及硒半胱氨酸含量均为0,结果如图1 所示。

图1 人P2X7R 蛋白氨基酸种类及含量Fig 1 Type and content of amino acid of human P2X7R
对6 个不同物种P2X7R 蛋白的理化性质进行预测,结果如表1,在这6 个不同物种中,P2X7R 基因编码的氨基酸个数均为595,相对分子质量非常接近,在68 300~68 700,各物种IP 8.30~8.90,说明P2X7R 蛋白是碱性蛋白;P2X7R 蛋白在6 种物种中的半衰期均为30 h,蛋白不稳定系数均大于40,推断这6 种物种中的P2X7R 蛋白是不稳定蛋白;各物种的P2X7R 蛋白的脂肪族指数72.37~76.94,总平均亲水性均为负值,说明这6 中物种P2X7R 蛋白均为亲水蛋白质。

表1 6 个不同物种P2X7R 蛋白的理化性质预测Tab 1 Prediction of physicochemical property of P2X7R protein of six different species
2.2 人P2X7R 蛋白跨膜域、亲水性/ 疏水性、信号肽分析
利用TMHMM 软件对人P2X7R 蛋白进行跨膜区分析,结果如图2 所示,人P2X7R 蛋白为两次跨膜蛋白质。登录ProtScale 在线软件分析人P2X7R蛋白亲水性/疏水性,结果见图3,得分最大处位于第39 个氨基酸,得分为2.600;最小位于第303 氨基酸处,得分为−2.600,且大部分氨基酸分值为负值,表明大部分氨基酸位点具有较强的亲水性,推测该蛋白为亲水性蛋白,这与ProtParam 结果一致。用SignalP 5.0 软件对人P2X7R 蛋白进行分析,显示信号肽的可能性为0.0021,未发现信号肽区域,信号肽是分泌蛋白的标志,故可推测该蛋白不属于分泌蛋白,见图4。
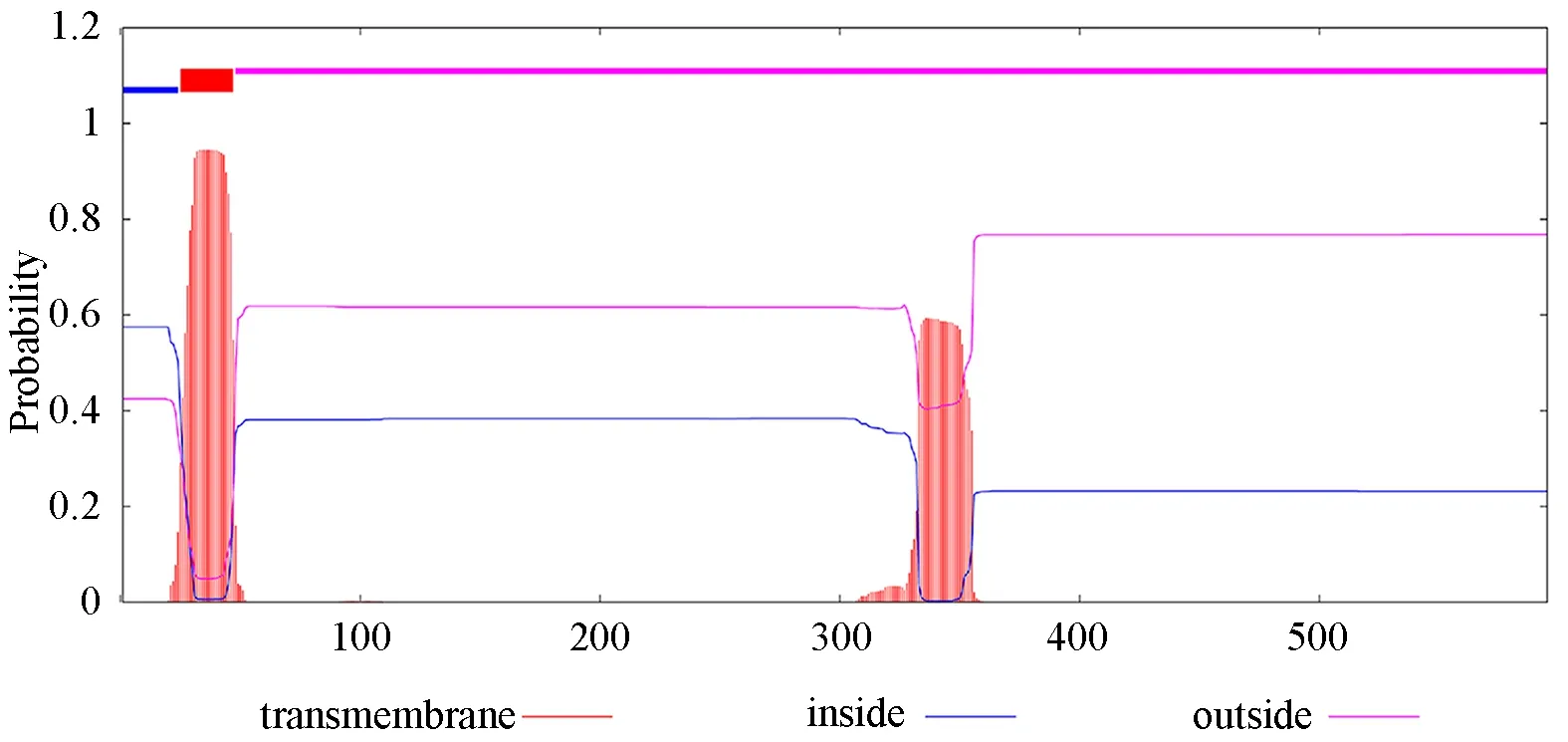
图2 人P2X7R 蛋白跨膜区域分析Fig 2 Transmembrane domain analysis of human P2X7R protein
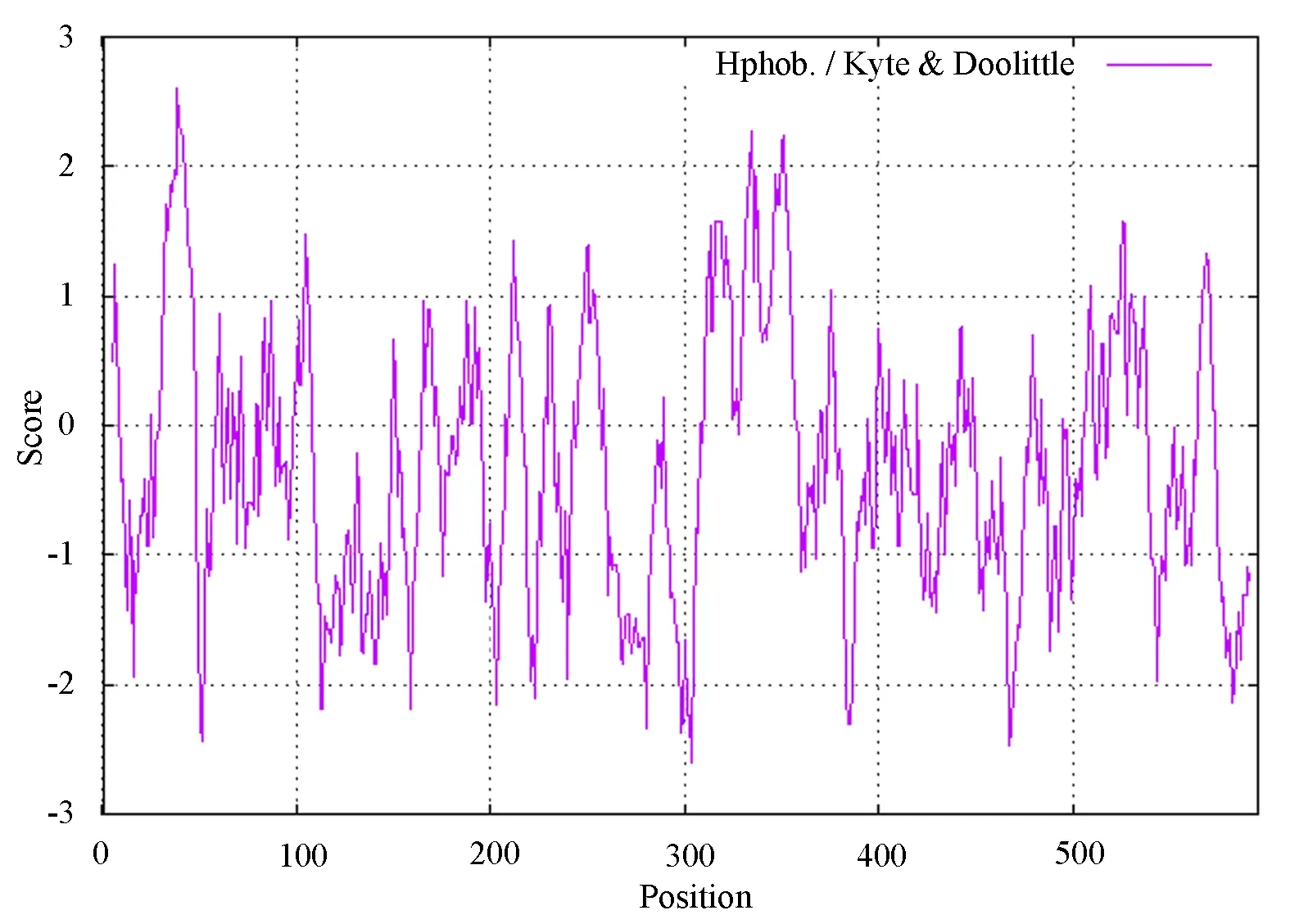
图3 人P2X7R 蛋白的亲水性/疏水性结果Fig 3 Hydrophilicity/hydrophobicity analysis of human P2X7R protein

图4 人P2X7R 蛋白的信号肽区域分析Fig 4 Signal peptide analysis of human P2X7R protein
2.3 人P2X7R 蛋白的同源性预测和系统进化分析
从NCBI 数据库中分别下载人、小家鼠、褐家鼠、锡金小鼠、倭黑猩猩、猕猴的氨基酸序列,与人的氨基酸序列,利用ClustalW 程序对序列进行比对,并将比对结果进行分析,使用MEGA-X 软件构建进化树,结果如图5、6 显示,6 个物种之间的氨基酸序列差别不大,且人与倭黑猩猩、猕猴的亲缘关系较近。

图5 P2X7R 氨基酸序列同源性分析Fig 5 Homology analysis of amino acid sequences of P2X7R
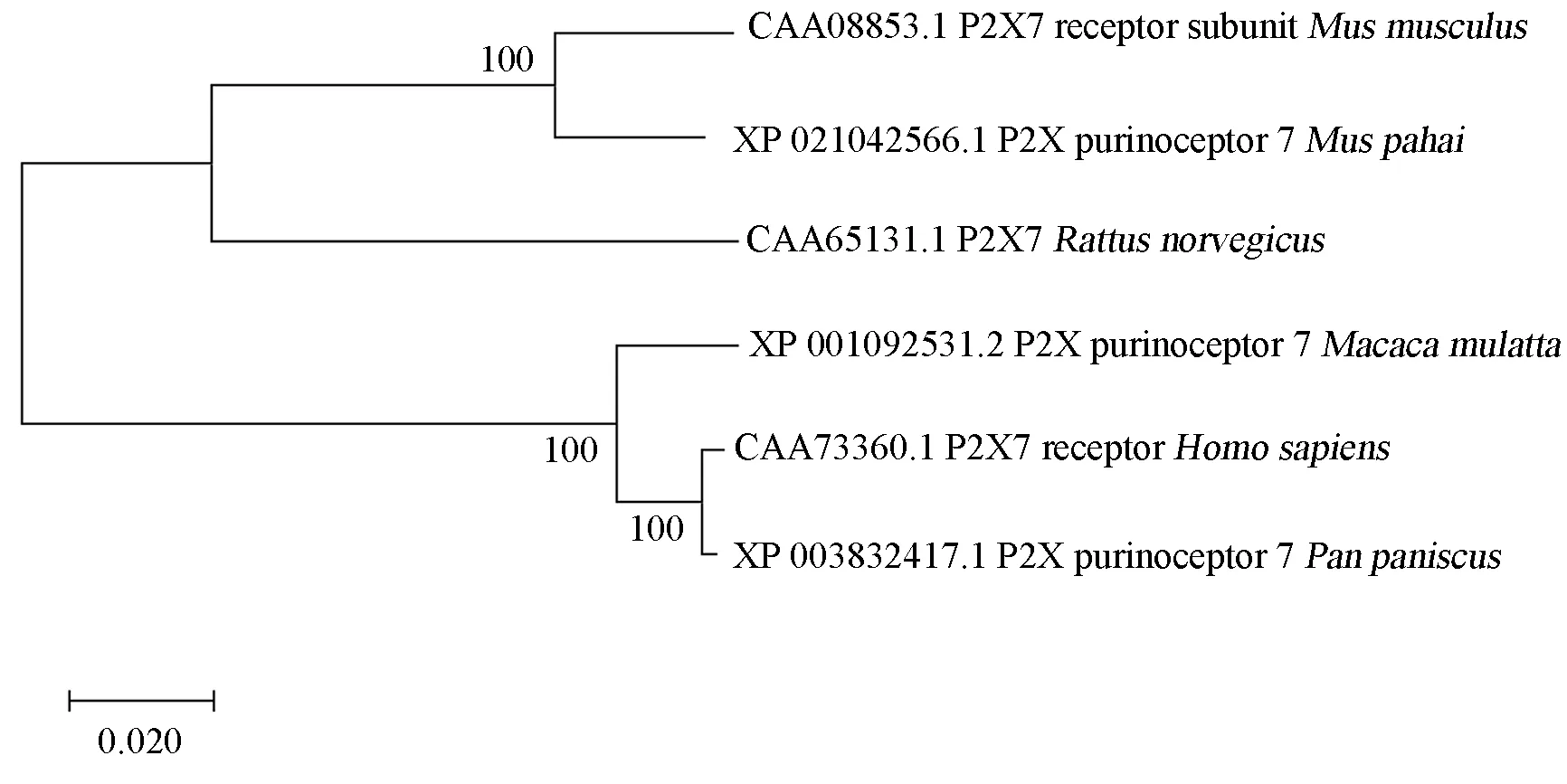
图6 P2X7R 蛋白系统进化树Fig 6 Phylogenetic tree of P2X7R protein
2.4 人P2X7R 蛋白二级结构预测
登录在线软件Sopma 对人P2X7R 蛋白进行二级结构预测,结果如图7。 人P2X7R 蛋白含26.39% α-螺旋、5.21% β-转角和48.40%无规则卷曲、20.00%延伸链。α-螺旋和β-转角是比较有序的蛋白二级结构,具有较高的稳定性。P2X7R 蛋白中α-螺旋与β-转角的总含量为31.60%,可推测该蛋白二级结构较为稳定,且该蛋白无规则卷曲含量较高,可能存在抗原表位。

图7 人P2X7R 蛋白二级结构预测Fig 7 Secondary structure prediction of human P2X7R protein
2.5 人P2X7R 蛋白三级结构预测
蛋白质的生物学功能在一定程度上与其空间结构有关,对蛋白质三级结构进行预测分析,能充分了解蛋白质的结构及功能之间的相关性。登录Swiss-Model 在线预测软件构建人P2X7R 蛋白的三级结构图,结构预测过程中所选用的蛋白质模型与人P2X7R 的序列相似度80.34%,覆盖率为100%,可靠性较高。对同源建模的相似性波形图进行分析,发现相似性波形图整体预测值较高且较为稳定,结果如图8。

图8 人P2X7R 蛋白三级结构预测及相似性波形图Fig 8 Tertiary structure prediction and similarity waveform of human P2X7R protein
为了进一步验证模型的可靠性,用拉曼图对模型氨基酸残基的合理性进行分析,使用网站Structural Analysis and Verification Server 对模型进行拉曼图分析,得到如图9 结果。拉曼图中90%以上氨基酸残基落在支持区内为高质量模型,预测结果显示,仅0.40%氨基酸残基在不允许区域内,90.90%氨基酸残基落在支持区内,这说明该预测模型中大部分氨基酸可形成合理的二面角,构成的蛋白结构较为稳定,合理性较高。因此,Swiss-Model 预测得到的人P2X7R 蛋白质的模型较为稳定可靠。
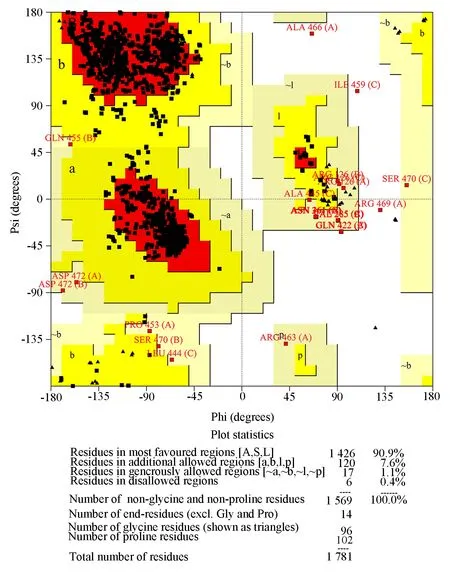
图9 人P2X7R 蛋白拉曼图分析Fig 9 Ramachandran plot analysis of human P2X7R protein
2.6 蛋白的相互作用分析
登录String 网站对人P2X7R 蛋白进行蛋白质相互作用预测,结果见图10。预测得到10 个与P2X7R 相互作用密切的蛋白及预测得分见表2。通过对与人P2X7R 蛋白相互作用最紧密的蛋白质进行得分分析可知,与人P2X7R 蛋白相互作用的蛋白主要为嘌呤受体、离子通道相关蛋白以及信号通路相关蛋白。研究显示,P2X7R 作为一种嘌呤受体可被ATP 激活,在ATP 作用下可形成非选择性离子通道,允许钙离子、钠离子流出以及钾离子流入,从而激活下游的信号通路[17,18]。

表2 与人P2X7R 相互作用的蛋白质Tab 2 Proteins interacting with the human P2X7R
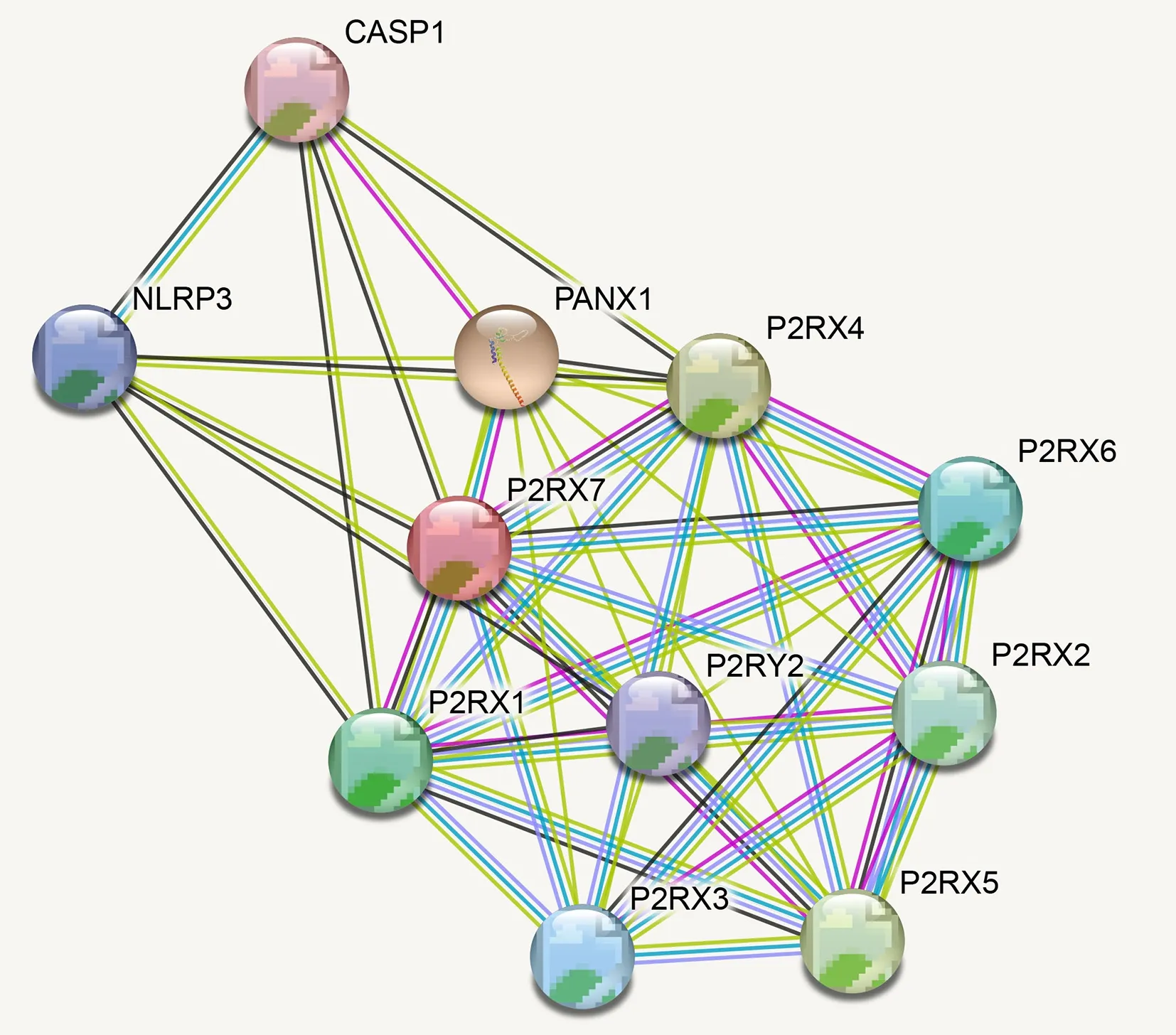
图10 人P2X7R 蛋白的相互作用预测Fig 10 Protein-protein interaction of human P2X7R protein
2.7 B 细胞抗原表位预测
利用ABCpred 软件预测人P2X7R 蛋白B 细胞抗原表位(长度:16 mer;阈值:0.9),经筛选和得分结果如表3。结果显示504~519,468~483,113~128,209~224 位氨基酸残基存在优势B 细胞抗原表位。

表3 人P2X7R 蛋白B 细胞抗原表位预测Tab 3 B cell epitope prediction of human P2X7R protein
2.8 Th、CTL 细胞抗原表位预测
使用ProPred 在线软件对人P2X7R 蛋白Th 细胞抗原表位进行分析,选择MHC-II 表型为HLADRB1*0101、*0301、*0401、*0701、*0801、*1101、*1301、*1501 七种中国人最常见的多肽类型进行分析,经筛选整合综合分析后,结果如表4 所示,发现333~341 位的VVYIGSTLS 是七种多肽类型共有序列,因此,VVYIGSTLS 可成为人P2X7R 的候选表位。
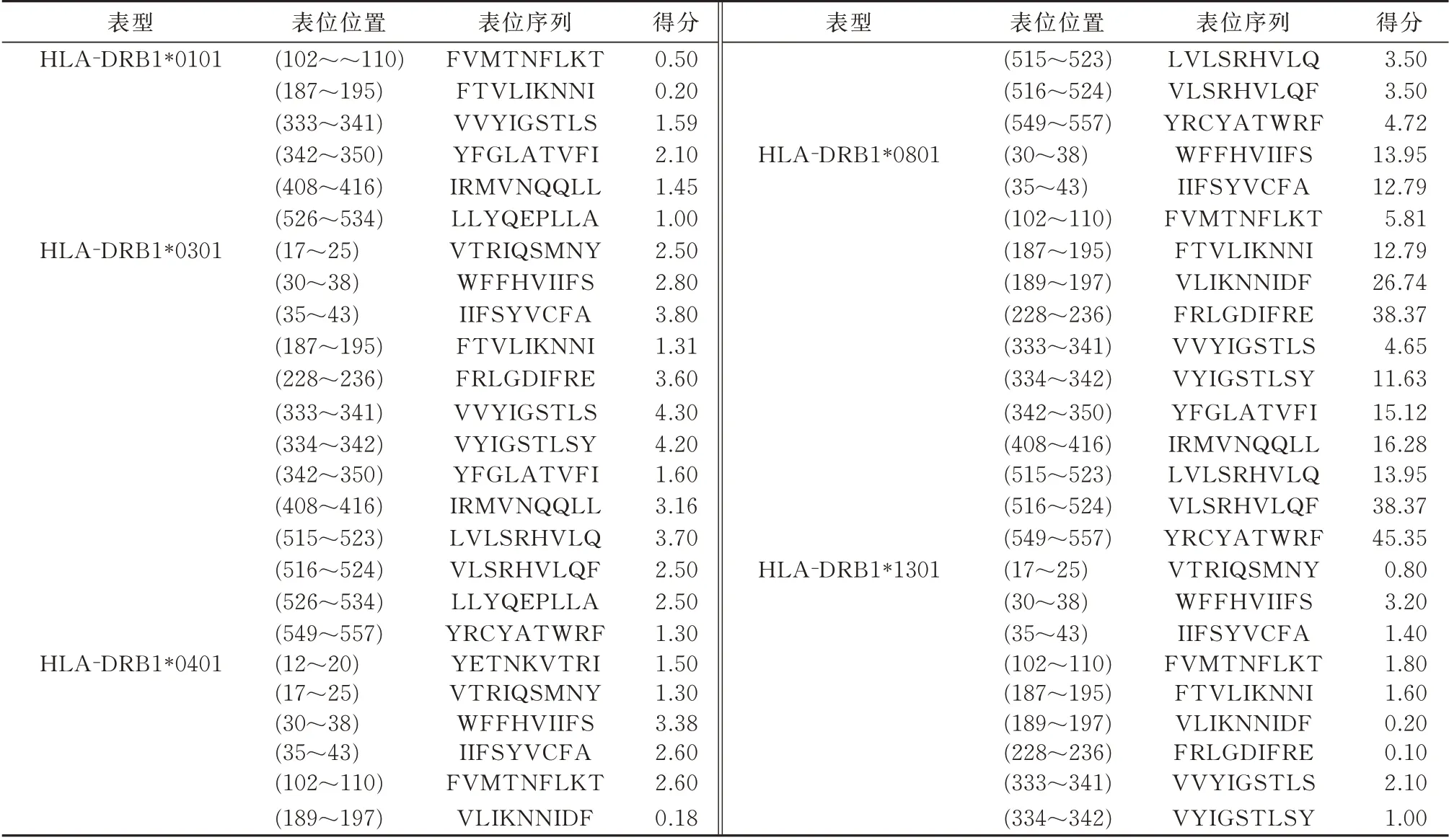
表4 人P2X7R 蛋白Th 细胞抗原表位预测Tab 4 Prediction of Th cell epitope of human P2X7R protein

续表
使用CTLpred 在线软件,采用结合ANN 和SVM 联合的方法预测出人P2X7R 蛋白的潜在CTL表位并对其进行打分(截断值为ANN:0.51,SVM:0.36),结果如表5 所示,综合得分最高的序列为270~278 位RPKYSFRRL,244~252 位DVAIQGGIM,288~296 位YPGYNFRYA。

表5 人P2X7R 蛋白CTL 抗原表位预测Tab 5 CTL epitope prediction of human P2X7R protein
3 讨论
P2X7R 是P2X 家族中最晚被克隆的,以ATP为配体,激活后可引起细胞膜发生去极化,形成非选择性离子通道,影响离子跨膜梯度。研究表明,P2X7R 参与人体内多种生理活动。Zhang 等[19]通过研究大肠癌患者,发现P2X7R 高表达的患者生存期会降低,且P2X7R 的表达与大肠癌转移成正比。Xia 等[20]通 过 使 用 激 动 剂ATP 及BzATP 激 活P2X7R,促进乳腺癌细胞的侵袭及转移;敲除P2X7R 后,癌细胞的侵袭及转移明显受到抑制。因此,P2X7R 有可能会成为乳腺癌治疗的一个潜在靶点。已有研究证明,胰腺导管腺癌细胞表达P2X7R,该受体调节癌细胞的增殖、死亡、迁移和侵袭,可能成为治疗胰腺导管腺癌的一个重要调控点,并为其它肿瘤的治疗提供重要的思路[21]。P2X7R 不仅参与肿瘤的发生、发展,还参与炎症性疾病的发生、发展,如系统性红斑狼疮、类风湿性关节炎、原发性干燥综合征等均涉及NLRP3 炎症体的活化[22-24]。研究证明P2X7R 和NLRP3 炎性体的激活在人类头颈部鳞癌的生存和侵袭中起重要作用[25],利用P2X7R 在疾病中的作用机制可以为治疗疾病以及药物的研发提供新的思路。生物信息学分析对于蛋白质结构及功能的阐明具有重要意义,可利用生物信息学分析软件对蛋白质之间的相互作用、调控及结构进行预测分析,能够更好的使人们了解蛋白质在体内的作用,因此,对P2X7R 进行结构分析有助于进一步了解其在疾病中发挥的作用。
本研究利用生物信息学对人P2X7R 蛋白的部分结构进行分析,通过Prot Param、TMHMM 软件分析,阐明了人P2X7R 结构的基本信息。理化性质分析可知该蛋白的等电点8.62,且正电荷残基数比负电荷残基数要多,可以与某些带有负电荷的基团结合,从而发挥功能。P2X7R 蛋白氨基酸组成中,亮氨酸、丝氨酸、缬氨酸及精氨酸所占比重较高,其中,亮氨酸可与缬氨酸可调节血糖浓度,而丝氨酸和精氨酸可参与免疫反应,提示P2X7R 蛋白在某些免疫性疾病及血糖引起的疾病中可发挥一定的效应。P2X7R 蛋白的半衰期长达30 h,提示该蛋白可作为抗原在体内发挥长久作用,从而提高宿主的免疫功能。蛋白质的二级结构及氨基酸亲水性参数与抗原表位的形成有关,Hopp 等[26]提出亲水性氨基酸残基可对抗原表位进行预测,且二级结构中无规卷曲多位于细胞表面,更易结合抗体,因此,更易形成抗原表位[27]。亲疏水性分析P2X7R 蛋白是一种亲水性蛋白,且二级结构中主要由无规则卷曲、α-螺旋、延伸链及β-转角等组成,无规卷曲占比例较高,结构较稳定且有利于形成抗原表位;通过SignalP5.0、TMHMM 软 件 分 析 表 明P2X7R 蛋 白 不 含信号肽,并具有2 个跨膜域,说明该蛋白质是膜相关蛋白并非分泌蛋白。三级结构预测模型经验证也具有较高的稳定性,可信度较高。通过分析蛋白互相作用显示人P2X7R 与炎症信号通路存在相关性。本研究中分别使用ABCpred、Propred、CTLpred 预测人P2X7R 蛋白的细胞抗原表位,最终获得优势B细胞、Th 细胞及CTL 细胞抗原表位,细胞抗原表位的预测对研发P2X7R 蛋白表位疫苗具有重要意义。本研究通过生物信息学的方法得到的人P2X7R 蛋白的预测结果具有可靠性,对后期研究人P2X7R 蛋白参与的生理功能和机制研究具有指导意义。

