佐剂性关节炎大鼠炎症极化、Notch 通路变化及其相关性分析
赵 磊,万 磊,刘 健,黄传兵,孙广瀚,马熙檬,朱子衡,李 舒,李方泽,刘天阳,刘 磊,李 明
(1.安徽中医药大学研究生院,安徽 合肥 230038;2.安徽中医药大学第一附属医院 风湿科,安徽 合肥 230031)
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性炎症性自身免疫性疾病,其特征是活化的促炎免疫细胞渗入关节,并伴有多种介质的过度产生,导致软骨破坏和骨侵蚀,是疼痛和生活质量损害的主要来源之一[1]。在参与RA 的炎性细胞中,巨噬细胞在组织重塑和损伤修复中起着至关重要的作用,通过改变代谢状态和功能,调节炎症和维持体内平衡[2]。各种已知或未知的微环境信号影响巨噬细胞,造成巨噬细胞极化成不同的表型、功能,即M1 型和M2 型巨噬细胞,就是巨噬细胞分泌炎症极化现象[3]。由M1 巨噬细胞产生的促炎症细胞因子和由M2 巨噬细胞产生的抗炎细胞因子之间的失衡是RA 进展的一个特征[4]。但关于RA 中巨噬细胞极化失衡的机制尚未完全阐明[5]。高度保守的Notch 信号已被认为是免疫系统中的一个重要角色,Notch 信号通路协调体内包括免疫在内的许多过程,相当多的文献已经证实了Notch 信号在免疫细胞发育和功能中的作用[6]。有报道显示Notch 信号通路在RA 发病机制中发挥着作用,并证实其与RA 的多种发病过程有关[7]。研究发现RA 炎症极化受Notch 信号通路调节,而Notch 通路参与RA 炎症反应主要与巨噬细胞的极化相关[8,9]。近年来,巨噬细胞在炎症中的作用逐渐被揭示,但Notch 信号在巨噬细胞免疫反应中的作用机制尚不清楚[10]。RA 的发生发展可能与Notch 信号通路的异常激活有关,因此,本实验通过观察佐剂关节炎(adjuvant arthritis,AA)大鼠外周血中M1 巨噬细胞主要标志物CD86、M2 巨噬细胞主要标志物CD206 及Notch通路相关因子表达的变化,探讨AA 大鼠炎症极化与Notch 通路之间的关联。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级SD 雄性大鼠12 只,体质量(190±20)g。由安徽医科大学实验动物中心提供,动物许可证号:Lscxk(皖)2017-001。本实验获得安徽中医药大学第一附属医院实验动物伦理委员会的批准,购买后大鼠均饲养于该医院实验动物中心,在符合大鼠喂养环境下适应性喂养1 周后进入实验。
1.1.2 其他试剂 CD86、CD206 购自天津三箭生物技术有限公司,货号分别为sc-20060、sc-58986。弗氏完全佐剂购自美国Sigma 公司。
1.2 方法
1.2.1 分组及关节炎模型复制 将12 只清洁级SD雄性大鼠适应性喂养1 周后,随机均分为正常组、模型,每组6 只。向模型组动物右后足跖皮内注射弗氏完全佐剂(0.1 mL/只)以致炎,复制成佐剂关节炎AA 大鼠模型[11]。
1.2.2 大鼠足跖肿胀度(E)、关节炎指数(AI)的测定 在造模前1 d、致炎后第12 天测量各组大鼠后足跖的容积,计算各组大鼠足跖肿胀度[12]。足跖肿胀度=(造模后足趾容积−造模前足趾容积)/造模前足趾容积。致炎后第12 天开始观察并记录全身病变,并计算关节炎指数。病变按5 级评分法评价。无红肿现象为0 分,小趾关节出现红肿为1 分,趾关节和足跖出现肿胀为2 分,踝关节以下的足爪发生肿胀为3 分,包括踝关节在内的全部足爪发生肿胀为4 分。
1.2.3 流式细胞术检测大鼠外周血炎症极化标志物CD86、CD206 的表达 大鼠新鲜血液100 μL,按每106个细胞/管分别加入抗鼠M1 型标志物(CD86-FITC)、M2 型标志物(CD206-FITC)(0.25 μg)/抗鼠。按说明书操作,上EPICS 型流式细胞仪检测。用flowJoV10 软件对流式细胞图像进行分析,作图。1.2.4 PCR 检测外周血Notch 信号通路相关因子的表达 根据GneBank 提供的mRNA 序列,使用Primer Premier 5 软件设计并分析引物,序列见表1。PCR 反应体系为50 μL,包括反转录产物3 μL,正、反向引物各1 μL 及GoTaqDNA 聚合酶混合液25 μL,水补足至50 μL。反应条件为95 ℃预变性5 min,然后进行35 个循环的反应[13,14]。

表1 Notch 受体及配体引物序列Tab 1 Primer sequence of Notch receptor and ligands
1.2.5 统计学处理 实验数据以±s表示,采用SPSS24 统计软件分析,组间比较采用独立样本t检验,相关性分析采用Spearman 分析,P<0.05 为差异有统计学意义。
2 结果
2.1 AA 大鼠E、AI 的变化
模型组大鼠均造模成功,在造模12 d 后,与正常组比较,模型组大鼠E、AI 显著高于正常组,差异有统计学意义(P<0.01),见图1、表2。
表2 两组大鼠足跖肿胀度和关节炎指数的比较(n=6,±s)Tab 2 Comparison of plantar swelling and arthritis index be⁃tween two groups of rats(n=6,±s)

表2 两组大鼠足跖肿胀度和关节炎指数的比较(n=6,±s)Tab 2 Comparison of plantar swelling and arthritis index be⁃tween two groups of rats(n=6,±s)
组别正常组模型组t P足趾肿胀度1.36±0.10 1.75±0.10−6.320<0.001关节炎指数0.00±0.00 3.25±0.99−8.087<0.001

图1 大鼠关节肿胀对比Fig 1 Comparison of joint swelling in rats
2.2 AA 大鼠外周血中炎症极化标志物的变化
与正常组相比,模型组大鼠外周血CD86 表达明显升高;CD206 表达降低,差异有统计学意义(P<0.05 或P<0.01),见表3 及图2、3。

图2 两组M1 标志物比较Fig 2 Comparison of M1 markers between the two groups
表3 两组大鼠M1、M2 标志物变化比较(n=6,±s)Tab 3 Comparison of the changes of M1 and M2 markers between the two groups of rats(n=6,±s)
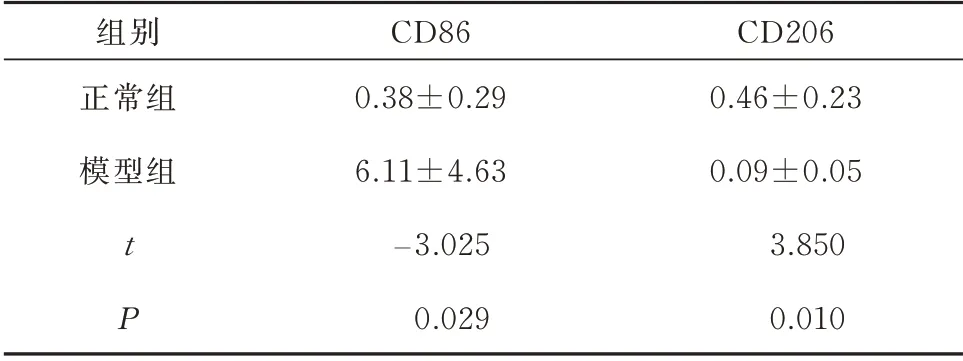
表3 两组大鼠M1、M2 标志物变化比较(n=6,±s)Tab 3 Comparison of the changes of M1 and M2 markers between the two groups of rats(n=6,±s)
组别正常组模型组t P CD86 0.38±0.29 6.11±4.63−3.025 0.029 CD206 0.46±0.23 0.09±0.05 3.850 0.010
2.3 AA 大鼠外周血中Notch 通路的变化
与正常组相比,模型组大鼠Notch2、Notch3、Notch4、Delta1 表达明显升高;Notch1、Jagged1、Jagged2 表达降低,差异有统计学意义(P<0.05 或P<0.01),见表4。
表4 各组大鼠外周血中Notch 受体及配体表达的比较(n=6,±s)Tab 4 Comparison of the expression of Notch receptors and ligands in peripheral blood of rats in each group(n=6,±s)

表4 各组大鼠外周血中Notch 受体及配体表达的比较(n=6,±s)Tab 4 Comparison of the expression of Notch receptors and ligands in peripheral blood of rats in each group(n=6,±s)
组别正常组Notch1 0.73±0.06 Notch2 0.39±0.02 Notch3 0.50±0.05 Notch4 0.38±0.05 Jagged1 0.76±0.10 Jagged2 0.67±0.05 Delta1 0.41±0.05模型组t P 0.40±0.04 11.387<0.001 0.72±0.08−10.108<0.001 0.57±0.03−3.196 0.010 0.56±0.03−7.301<0.001 0.35±0.03 9.365<0.001 0.40±0.01 12.413<0.001 0.77±0.06−11.309<0.001
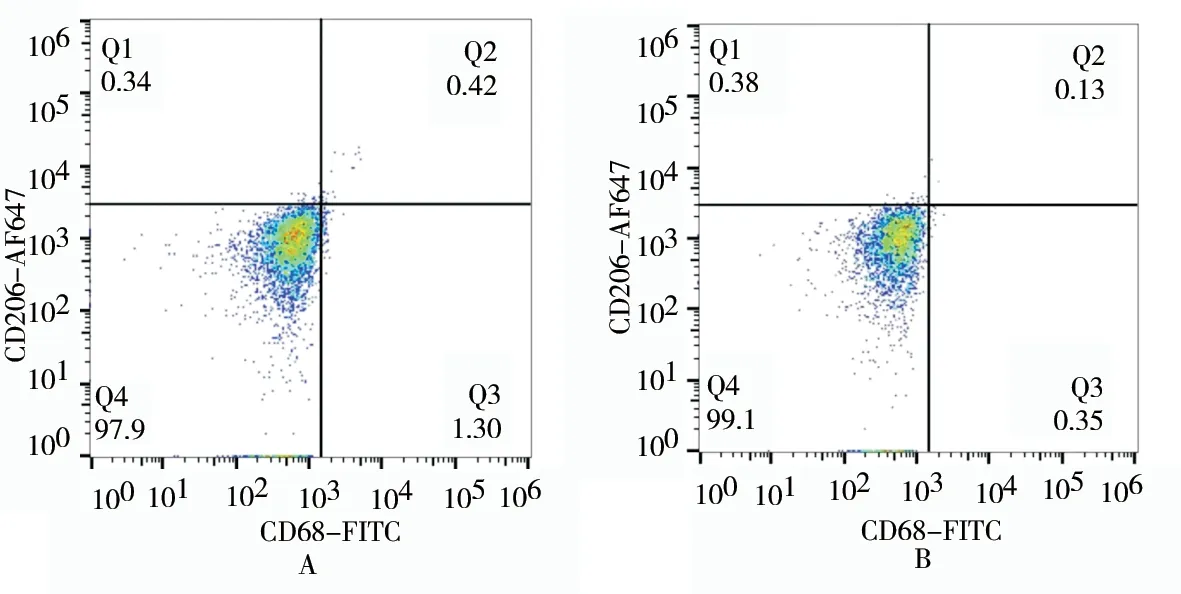
图3 两组M2 标志物比较Fig 3 Comparison of M2 markers between the two groups
2.4 AA 大鼠炎症极化标志物与Notch 信号通路的相关性分析
相关性分析显示,CD86、足趾肿胀度及关节炎指 数 与Notch1、Jagged1、Jagged2 呈 负 相 关(P<0.05),CD86、足趾肿胀度及关节炎指数与Notch2、Notch4、Delta1 呈 正 相 关(P<0.05 或P<0.01);CD206 与Notch1、Jagged1、Jagged2 呈正相关(P<0.01),CD206 与Notch2、Notch4、Delta1 呈 负 相 关(P<0.05 或P<0.01),见表5。

表5 CD86、CD206 与其他指标相关性分析Tab 5 Spearman analysis of the correlation between CD86,CD206 and other indicators
3 讨论
在RA 滑膜中发现大量活化的巨噬细胞是RA的早期标志,巨噬细胞表现出广泛的促炎、破坏性和重塑特性,这在RA 发病的急慢性阶段有重要贡献。极化后的M1 型巨噬细胞高表达CD86,主要分泌促炎细胞因子引起关节侵蚀,M2 型巨噬细胞高表达CD206,通过大量产生抗炎细胞因子促进血管生成、组织重建和修复,在炎症消退方面发挥重要作用。在RA 中,M1 巨噬细胞的比例高于M2 巨噬细胞,RA 炎症极化可分泌大量促炎性细胞因子、趋化因子,激活成纤维细胞和破骨细胞,加速机体炎症反应,造成关节破坏[15,16]。
RA 的发病机制涉及Notch 信号的激活,Notch信号通路包括4 种受体(Notch1-4)和5 种配体(Delta1、3、4 及Jagged1-2),由于Notch 受体及其配体在结构和亲和力方面的不同以及在发育过程中关于细胞类型和时间的独特表达特征,Notch 受体及其配体具有不同的功能差异[17]。Notch 受体与配体结合后,与下游靶基因转录因子CBF1/RBP-Jκ 结合,致巨噬细胞炎症极化向M1 型分化,诱导白细胞介素6、白细胞介素8、白细胞介素1β 炎细胞浸润,参与RA 炎症反应,最终导致滑膜炎症反应增加和骨破 坏[18]。本 研 究 发 现AA 大 鼠 外 周 血 中Notch2、Notch3、Notch4、Delta1 表达明显升高,Notch1、Jagged1、Jagged2 表 达 降 低。这 与Chiyoko 等[19]研 究 结果相似。有研究表明,Notch1 信号对破骨细胞分化有抑制作用,小鼠破骨细胞前体细胞中Notch1 的缺失促进了破骨细胞的分化,而Jagged1 的过表达抑制了破骨细胞的生成,提示Notch1、Jagged1 在破骨细胞生成中起抑制作用,能够延缓RA 的发生发展。Delta1 通过Notch2 发出信号来促进破骨细胞的生成,Notch3 可诱导成骨细胞和成骨细胞核因子κB受体活化因子配体的表达,活动期RA 患者辅助性T 细胞中Notch2、Notch3 和Notch4 的表达增加,诱导 破 骨 细 胞 分 化,从 而 促 进RA 的 发 生 发 展[20,21]。本研究结果显示,通过相关性分析发现炎症极化M1 标 志 物CD86 与Notch1、Jagged1、Jagged2 呈 负相关,与Notch2、Notch4、Delta1 呈正相关;M2 标志物CD206 与Notch1、Jagged1、Jagged2 呈正相关,与Notch2、Notch4、Delta1 呈负相关。研究结果表明,CD86 能促进AA 大鼠足趾肿胀度及关节炎指数,促进体内炎症反应,而CD206 则与之相反。说明Notch 信号通路及巨噬细胞炎症极化过程均参与了RA 发生发展的过程,Notch 信号通路不同受体和配体间发挥不同的作用,与炎症极化相互作用,调节体内炎症反应。
综上所述,Notch 信号通路可以通过调控巨噬细胞向M1 型极化,从而参与RA 发生发展的过程。
作者贡献度说明:
赵磊:进行试验、分析数据、撰写论文;万磊:设计试验,并对论文提出指导意见;李方泽协助手术操作及标本采集;刘健、黄传兵、刘天阳、刘磊、李明:参与实验内容及收集数据。

