屎肠球菌R40产胆盐水解酶发酵动力学及底物特异性分析
雷霜江,吕青遥,王文杰,杨 浩,孙博瑞,武雪梅,焦士蓉
(西华大学 食品与生物工程学院,四川 成都 610039)
胆固醇(cholesterol,CHOL)是一种27碳环戊烷多氢菲的衍生物,是构成细胞的关键成分且能转化为类固醇激素,并且作为合成维生素D3的原料及胆汁酸的前体物质,在人体中发挥着重要的作用[1]。随着经济发展,人民生活质量的提高,日常的饮食习惯向高热量高脂肪转化,不良的饮食习惯导致胆固醇摄入量急剧上升,从而引发胆结石、糖尿病、冠心病、动脉粥样硬化等慢性疾病[2-5]。膳食指南推荐,每人每日推荐摄入胆固醇200 mg。胆固醇摄入量过高,严重危害到人体健康,采取一定方法干预人体内胆固醇的代谢,从而维持体内的胆固醇平衡对身体健康至关重要[6-7]。
胆盐水解酶(bile salt hydrolase,BSH)是微生物生长过程中产生的一种蛋白质代谢产物,具有较强的降解胆固醇的能力[8]。乳酸菌是产生BSH的主要菌株,如植物乳杆菌(Lactobacillus plantarum)[9-11]、干酪乳杆菌(Lactobacillus casei)[12]和肠球菌属(Enterococcussp.)[13]。在人体中,胆盐约占胆汁有机成分的50%,结合胆盐根据氨基酸基团的不同和胆酸基团的羟基位置和数量不同主要分为[14]:9%牛磺胆盐(taurocholate,TCA)、9%牛磺脱氧胆盐(taurodeoxycholate,TDCA)、8%牛磺鹅脱氧胆盐(taurochenodesoxycholate,TCDCA)、26%甘氨胆盐(glycocholate,GCA)、22%甘氨脱氧胆盐(glycodeoxycholate,GDCA)、26%甘氨鹅脱氧胆盐(glycochenodesoxycholate,GCDCA)。研究表明,微生物产生的胆盐水解酶存在一定的底物特异性[15],不同种属的微生物在发酵过程中产生的胆盐水解酶的种类不同且特异性不同。
发酵动力学是描述微生物生长活动中菌体生长、底物消耗及产物形成之间内在关系规律的方法[16]。微生物的整个发酵过程可以分为延滞期、对数期、稳定期及死亡期,曲线呈典型S型。本实验使用Logistic模型进行描述菌体生长动力学;使用Leudeking-priet通用模型进行描述和计算产物生成动力学模型时,因产物的形成与菌体生长的关系不同,在计算模型参数时代入值有所差异[17]。底物消耗可根据底物消耗途径不同,及是否直接影响产物生成,选择不同的方程进行模拟,本实验选择Luedeking方程描述底物消耗过程。
本研究通过建立发酵动力学模型,观察在模拟人体胆盐条件下,屎肠球菌(Enterococcus faecium)R40的菌体生长与葡萄糖消耗及胆盐水解酶产生的内在关系,对其能否以活菌的形式在人体内发挥降胆固醇作用提供数据基础和参考,并根据不同胆盐设置不同培养基条件,通过降胆固醇过程的跟踪及分析,判断不同胆盐与屎肠球菌R40的生长、降胆固醇能力间的相互关系,观察屎肠球菌R40产生的胆盐水解酶是否具有一定的底物特异性,为更加高效利用屎肠球菌R40提供基础研究支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
屎肠球菌(Enterococcus faecium)R40:分离自发酵食品,保存于本实验室。
1.1.2 试剂
牛磺胆盐、牛磺脱氧胆盐、牛磺鹅脱氧胆盐、甘氨胆盐、甘氨脱氧胆盐、甘氨鹅脱氧胆盐(均为生化试剂):北京索莱宝科技有限公司;牛磺酸标准品、甘氨酸标准品(均为色谱纯):江苏艾康生物医药研发有限公司;三乙胺、乙腈(均为色谱纯):罗恩试剂有限公司;茚三酮(分析纯):成都市科龙化工试剂厂;牛血清蛋白(纯度>99%):北京奥博星生物技术有限责任公司。
1.1.3 培养基
MRS培养基:蛋白胨10.0 g,牛肉粉10.0 g,酵母浸粉5.0 g,柠檬酸氢二胺2.0 g,葡萄糖20.0 g,乙酸钠5.0 g,磷酸氢二钾2.0 g,硫酸镁0.58 g,硫酸锰0.25 g,吐温80 1.0 mL,蒸馏水1 000 mL,固体培养基中添加琼脂20 g,121 ℃高压蒸汽灭菌20 min。
MRS+胆固醇培养基:300 mL MRS液体培养基中加入1份胆固醇溶液(称取胆固醇0.12 g,加入0.6 mL吐温80、5 mL冰乙酸,振荡后超声,50 ℃条件下溶解,然后用0.4 μm过滤膜除菌),采用12 mL 6 mol/L氢氧化钠溶液调节pH至6.5左右,振荡摇匀后即得。
模拟人体胆盐培养基:根据人体中胆盐比例,在MRS+胆固醇培养基中加入总胆盐浓度为0.3%的结合胆盐。
1.2 仪器与设备
Acquity UPLC H-Class型超高效液相色谱(ultra-high performance liquid chromatography,UPLC)仪(配带紫外检测器):美国Waters公司;Hypersil ODS(C18)色谱柱(5 μm,4.6 mm×250 mm):岛津技弥(上海)商贸有限公司;Scientz-IID超声细胞破碎机:宁波新芝生物科技股份有限公司;I3X酶标仪:美谷分子仪器(上海)有限公司;Centrifuge 5804R冷冻离心机:德国Eppendorf公司;SPX-150B-Z生化培养箱:上海博迅实业有限公司医疗设备厂。
1.3 实验方法
1.3.1 屎肠球菌R40分批发酵动力学模型的建立及参数求解
将保存的屎肠球菌R40接种于MRS液体培养基中活化,37 ℃条件下培养48 h即得发酵种子液。将种子液按2%(V/V)的接种量接种于各个批次的模拟人体胆盐培养基中,37 ℃静置培养26 h,每隔2 h取出对应批次的样品,测定发酵液的菌体生物量、葡萄糖含量、胆盐水解酶活力,选择合适方程建立动力学模型并求解参数。
1.3.2 胆盐水解酶的底物特异性分析
以接菌后的MRS培养基、MRS+胆固醇培养基为对照,在MRS+胆固醇培养基中分别添加0.3%的TCA、TDCA、TCDCA、GCA、GDCA、GCDCA、模拟人体胆盐,并分别设定 为TCA 组、TDCA 组、TCDCA 组、GCA 组、GDCA 组、GCDCA组、模拟人体胆盐组,其中模拟人体胆盐组各种胆盐比例依照人体胆盐比例计算后添加。将活化好的菌株以1%(V/V)的接种量分别接种于以上培养基中,置于37 ℃培养箱中培养,每2 h取样,测定其生物量的变化情况,每组试验做3组平行并求均值。
1.3.3 分析检测
菌体生物量的测定[15]:取10 mL发酵液于离心管中,4 ℃、6 000 r/min离心20 min,取沉淀,用无菌生理盐水洗涤沉淀两次,经80~90 ℃烘干至质量恒定后称质量。
葡萄糖消耗量的测定:采用斐林试剂法[17]。
胆盐水解酶活力的测定:参考毕洁等[18-19]的方法。胆盐水解酶活力定义:每分钟底物释放1 μmol牛磺酸或甘氨酸的酶量为1个酶活力单位(U/mL)。
2 结果与分析
2.1 屎肠球菌R40分批发酵动力学模型的建立及动力学参数求解
屎肠球菌R40在模拟人体胆盐中的生长情况见图1。

图1 屎肠球菌R40的发酵动力学曲线Fig.1 Fermentation kinetic curve of Enterococcus faecium R40
2.1.1 菌体生长动力学模型的建立及参数求解
屎肠球菌R40细胞的生长变化可分为4个阶段:0~4 h为延滞期,4~10 h为对数生长期,10 h后进入稳定期。生长曲线为典型的S型曲线,故选择Logistic方程描述屎肠球菌R40在模拟人体胆盐条件下的生长规律。
对数生长期菌体细胞的增长速率表达式为:

式中:X为生物量,g/L;Xm为菌体能达到的最大生物量,g/L;t为时间,h;μm为最大比生长速率,h-1。
稳定期菌体生物量不再增加,故X=Xm=4.652 g/L,初始条件t=0,将其代入公式(1),整理后得公式(2),即屎肠球菌R40在对数生长期和稳定期的生长状态表达式为:


2.1.2 产物生成动力学模型的建立及参数求解
产物生成动力学模型通常采用Luedeking-Piret通用方程进行描述。基本表达式为公式(3):

式中:P为胆盐水解酶活性,U;t为时间,h;α为与菌体生长相关的合成酶常数;β为与菌体量相关的合成酶常数;X为菌体生物量,g/L。
由图1可知,胆盐水解酶的合成与菌体的生长关系为生长部分耦联型,即α、β均≠0。当菌体生长处于稳定期,则:

以t=0,P=0为初始条件,公式(1)积分变形后得:

将公式(4)代入公式(5)中,积分后得:
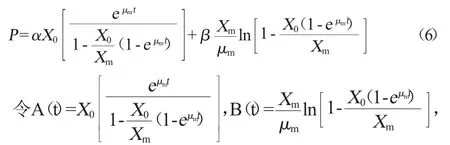
则公式(6)可写为:

由菌体生长稳定期的胆盐水解酶浓度P对发酵时间t作图,得到一条直线方程为y=0.152x+113.42,相关系数R2=0.913 85,故=0.032 7,将参数μm、X0、Xm、β代入公式(6),求得α=49.116;将确定值代入公式(6),得菌体产物生成动力学模型方程为:

2.1.3 底物消耗动力学模型的建立及参数求解
微生物发酵过程中,常通过三种途径消耗底物:细胞生长、维持细胞的生命活动、产生代谢产物时所利用。由图1可知,屎肠球菌R40并非直接利用葡萄糖产生胆盐水解酶,故可忽略底物消耗用于产生胆盐水解酶这一途径,采用Luedeking方程建立底物消耗动力学模型,其方程为:

式中:S为葡萄糖含量,g/L;t为时间,h;X为菌体生长量,g/L。
稳定期,X=Xm,代入公式(8)可得:

将公式(4)代入公式(9)并积分后,即可求得:

则公式(10)可简写为:

葡萄糖浓度与时间存在线性相关,求得方程为S=-0.071 6t+15.049,相关系数R2=0.911 0,求得=-0.071 6,θ=0.153 9,将求得参数代入公式(11)中,可求得ε=5.712 2,将上述所有参数代入公式(10),即可求得葡萄糖消耗动力学模型方程式为:
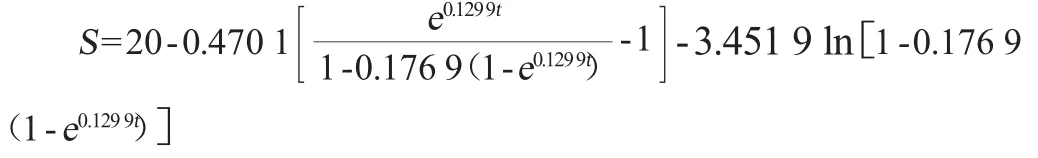
2.1.4 模型验证
为确定实验拟合模型的可靠性,对模型的预测值和试验值进行比对,结果见表1。由表1可知,模型预测值与试验结果值误差均小于10%,说明模型的预测值与试验结果拟合较好。
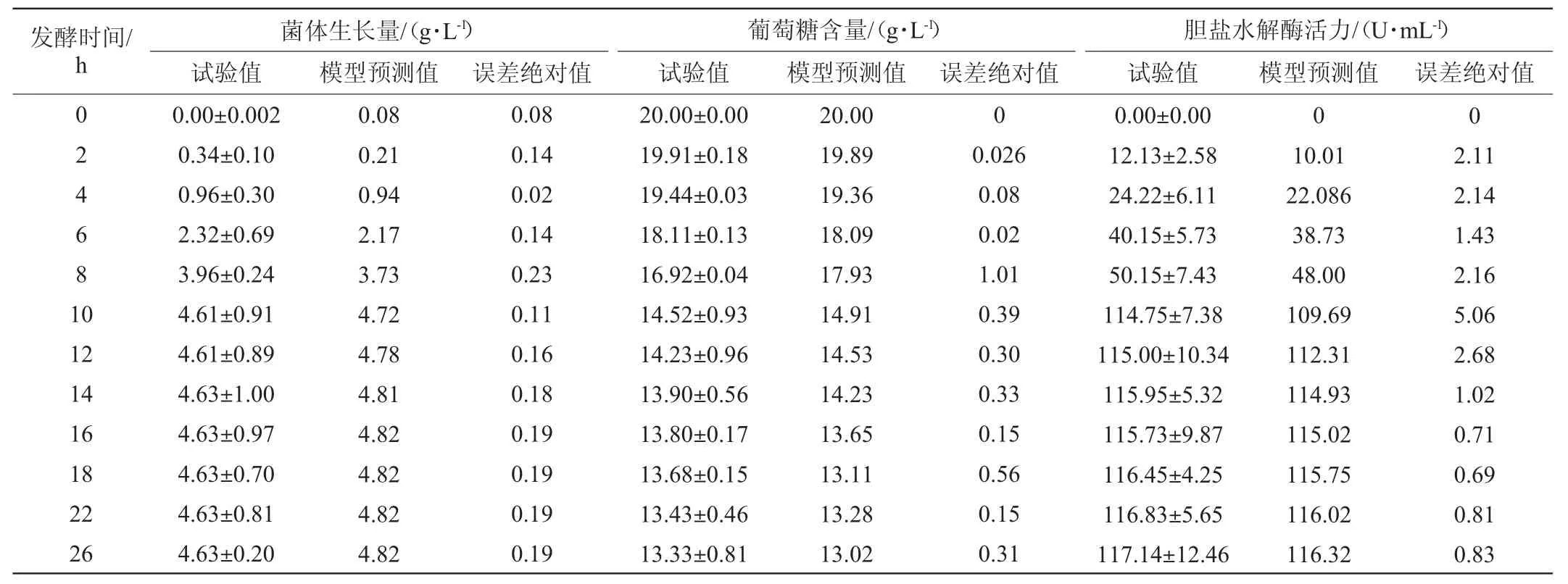
表1 屎肠球菌R40发酵动力学模型预测值与试验值比较结果Table 1 Comparison results of predicted and experimental values of Enterococcus faecium R40 fermentation kinetic model
2.2 不同胆盐对屎肠球菌R40生长的影响
屎肠球菌R40在不同胆盐条件下的生长情况见图2。

图2 屎肠球菌R40在不同胆盐条件下的生长曲线Fig.2 Growth curves of Enterococcus faecium R40 under different bile salt conditions
由图2可知,发酵种子液转入到实验组培养基中后,适应期极短,除GDCA、MRS+胆固醇、MRS组外,其他组屎肠球菌R40在发酵4 h后即可进入对数生长期,发酵8 h后进入稳定期,所有组别中的最大菌体生物量为4.764 g/L,发酵后期菌体开始自溶死亡,菌体生物量有缓慢下降的趋势。在胆盐和胆固醇同时存在的情况下,屎肠球菌R40的生长情况较好,说明在只有胆固醇存在的情况下,屎肠球菌R40不表现明显的胆固醇降解能力,且生长受到胆固醇分子的胁迫,生长能力相对较差,故推断胆盐的存在是乳酸菌降解胆固醇的必要条件[20]。李尧[21]研究了不同浓度的胆盐对乳酸菌降胆固醇能力的影响,结果表明,胆盐含量在0.3%~0.4%的条件下屎肠球菌R40对胆固醇降解能力相对较强。本实验证明,胆盐的存在一定程度上能够提高屎肠球菌R40对胆固醇的耐受能力。计算得屎肠球菌R40在不同胆盐中的代时,结果见表2。由表2可知,屎肠球菌R40在含有GCA和GDCA的条件下代时较短,说明其对GCA与GDCA的适应能力最好。

表2 屎肠球菌R40在不同胆盐条件下的代时Table 2 Generation of Enterococcus faecium R40 under different bile salt conditions
以MRS培养基和MRS+胆固醇培养基为对照,比较7种不同胆盐对屎肠球菌R40生长情况的影响,对9组实验组的最大生物量数据进行多重T检验-差异性分析,P值见表3。
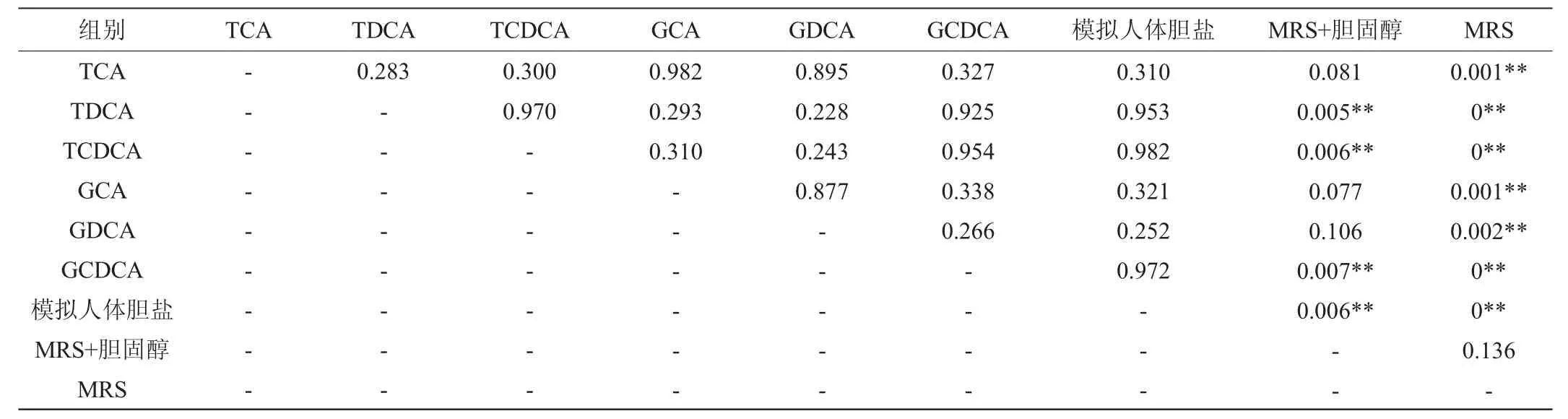
表3 不同胆盐对屎肠球菌R40生长能力影响的差异性分析Table 3 Difference analysis of effect of different bile salts on the growth ability of Enterococcus faecium R40
结合图2及表3可知,屎肠球菌R40对胆盐的识别具有一定差异性,其中GDCA对屎肠球菌R40的生长促进作用相对薄弱,GDCA的加入并未缩短菌株生长适应期,但在对数期生长更加稳健,最终的菌体生物量与MRS组相比有较大差距。GCA和TCA相对于MRS组,提前4 h进入对数期,其对屎肠球菌R40的生长的促进作用主要表现在对适应期的缩短,且最终的菌体生物量与MRS组接近。TDCA、TCDCA、GCDCA以及模拟人体胆盐组与MRS组相比,对屎肠球菌R40的生长均表现在缩短适应期和提高生长量两个方面,且4组组间不存在显著性差异(P>0.05)。
3 结论
屎肠球菌R40在37 ℃、模拟人体胆盐培养基下的菌体生长、胆盐水解酶生成及葡萄糖消耗的动力学模型相关系数均>0.9,拟合情况良好。将模型预测值与试验测量值进行对比验证,所得误差均<10%。表明可以通过建立发酵动力学模型对屎肠球菌R40产酶情况进行预测和描述。胆盐的添加有利于屎肠球菌R40发挥降胆固醇作用,使菌株提前4 h进入对数生长期,且提高了菌株R40的生物量。不同胆盐对菌株R40的影响存在差异性,甘氨酸脱氧胆盐虽能提高生物量,但未缩短适应期。牛磺酸胆盐和甘氨酸胆盐缩短了菌株R40的适应期,但对生物量并无显著影响,说明菌株R40产的胆盐水解酶具有一定的底物特异性。

