槲皮素对胃癌相关p53∕AMPK∕mTOR信号通路的影响
李欣,林明哲,赵久达
胃癌是常见的肿瘤之一,发病原因与不良习惯及细菌感染有关[1]。槲皮素(quercetin,QE)是一种天然黄酮类化合物,具有抗炎、抗癌、抗氧化等多种作用。研究显示,QE可呈时间和剂量依赖性地抑制人肺腺癌细胞的增殖,并可能通过上调P53蛋白表达来诱导肺腺癌细胞的凋亡[2]。另有研究显示,QE可以通过促进肿瘤细胞的自噬而起到抗癌作用[3]。然而,目前有关QE对胃癌细胞的作用机制并不十分明确。有研究显示,p53信号通路是抑癌通路,可以促进肿瘤细胞凋亡;腺苷酸激活蛋白激酶(AMPactivated protein kinase,AMPK)与细胞自噬有关,也是调控肿瘤细胞的信号通路;AMPK和哺乳动物雷帕霉素靶蛋白(mTOR)信号通路存在交叉作用,而mTOR也参与肿瘤细胞自噬过程[4]。目前,关于p53∕AMPK∕mTOR信号通路与胃癌关系的相关研究少见。本实验旨在探讨QE对p53∕AMPK∕mTOR信号通路的影响及其抗肿瘤作用机制,以期为胃癌治疗提供参考。
1 材料与方法
1.1 主要仪器与试剂 QE购自上海同田科技有限公司。酶标仪(型号:9602;上海名元科技有限公司),流式细胞仪(型号:S3e;美国Bio-Rad Laboratories公司),荧光定量PCR仪(型号:ABI6000;美国thermo公司),Western blot湿电转膜仪(型号:E-BLOTTER;美国Protein Simple公司),恒温培养箱(型号:QP-160;济南来宝医疗科技有限公司)。人体胃癌细胞SGC-7901(美国ATCC细胞库);DMEM培养基(上海哈灵生物有限公司);青∕链霉素(贵州赛兰博科技有限公司);MTT试剂盒(上海歌凡生物有限公司);自噬检测试剂盒、凋亡检测试剂盒(美国Sigma公司);SYBR Premix EX Taq试剂盒(武汉科昊佳生物科技有限公司);标准胎牛血清、一抗抗体P53、AMPK、mTOR、LC3Ⅰ和LC3Ⅱ及内参β-肌动蛋白(β-actin),二抗HRP-羊抗兔IgG(上海艾博抗有限公司)。
1.2 研究方法
1.2.1 细胞培养及分组 将胃癌细胞接种到制备好的培养基中,置于37℃、5%CO2温箱中培养。当胃癌原代细胞培养至第3代对数生长期时用于后续实验研究,期间各组细胞均以相同条件(37℃、5%CO2)培养。QE组以DMSO为溶剂,将QE配制成0.02、0.04、0.06及0.08 mmol∕L溶液对细胞进行干预,分别对应QEA、QEB、QEC、QED组;溶剂组加入等量不含QE的溶剂。
1.2.2 MTT实验检测细胞增殖水平 取第3代对数生长期的细胞,接种至6孔板,调整密度为2×104个∕mL,每孔100μL,在37℃温箱中培养。细胞完全贴壁后,按1.2.1分组处理细胞,每组设6个复孔,温箱培养12、24、48 h时移除孔板中的培养液,按照MTT说明书操作并检测波长490 nm处的光密度(OD490)值。计算各个时点各组胃癌细胞抑制率=(1-实验组OD∕对照组OD)×100%。
1.2.3 MDC染色法检测胃癌细胞自噬 按照1.2.1分组处理细胞后,将各组细胞培养48 h,按照自噬检测试剂盒说明书操作,并于荧光显微镜(×3000)下观察并拍照,计算积分光密度值(IOD),IOD=染色的像素点强度值累加值∕所选区域面积(A)。
1.2.4 双染法检测胃癌细胞凋亡率 取第3代对数生长期的细胞,接种于6孔板中,每孔约2×105个细胞。置于37℃、5%CO2的培养箱中,根据1.2.1将细胞分组处理,培养48 h,然后用0.25%胰酶消化细胞,1000 r∕min离心5 min,弃上清液。4℃预冷的70%乙醇固定,调整细胞浓度为1×106个∕mL,加入染色剂10 mL,置于4℃冰箱中染色30 min,流式细胞仪检测凋亡情况,细胞凋亡率(%)=凋亡细胞∕细胞总数×100%。
1.2.5 实时荧光定量聚合酶链反应(qPCR)检测p53、AMPK及mTOR的mRNA相对表达水平 采用Trizol提取细胞总RNA,逆转录试剂盒获得cDNA。反应体系20μL:SYBR Premix EX Taq试剂盒中的MonAmp SYBR预混液10μL,上下游引物各0.4μL,cDNA模板1μL,无核酸酶纯水8.2μL。反应条件:95℃2 min;95℃15 s,60℃45 s,45个循环;60℃45 s。U6mRNA水平作为内参对结果进行归一化。将配置好的反应体系放置在荧光定量PCR仪中进行反应。引物由上海生工合成。记录各孔Ct值,以2-ΔΔCt来计算mRNA相对表达水平。基因引物序列,见表1。

Tab.1 Primer sequences of related genes表1 相关基因引物序列
1.2.6 Western blot检测LC3Ⅱ∕LC3Ⅰ、P53、AMPK、mTOR蛋白表达情况 将胃癌细胞按1.2.1分组处理,培养48 h,收集各组细胞进行蛋白提取。将样品放在沸水中加热至蛋白完全变性,取出样品冷却至室温,取30μg进行电泳,湿转至聚偏二氟乙烯膜。常温下5%脱脂牛奶封闭1 h,轻轻摇动,加入一抗anti-P53、anti-AMPK、anti-mTOR、anti-LC3-Ⅰ及anti-LC3-Ⅱ(均1∶1000)于4℃孵育过夜,磷酸缓冲盐溶液(PBS)清洗3次,每次10 min,加入二抗(1∶2000)常温下孵育1 h,PBS清洗3次,每次10 min,化学发光法显影处理、拍照,以βactin作为内参蛋白。Image J(v1.7.0)软件对条带进行定量分析,蛋白相对表达量=目标蛋白灰度值∕参照蛋白灰度值。
1.3 统计学方法 采用SPSS 21.0软件进行数据分析。符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,组间多重比较用LSD-t法,组内各时间点比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 各组胃癌细胞抑制率比较 12、24及48 h时,QE对胃癌细胞的抑制率均呈浓度依赖性增高,且各组内随干预时间的延长抑制率亦逐渐增高(P<0.05),见表2。
2.2 各组细胞自噬和细胞凋亡率比较 随着QE浓度增加,胃癌细胞自噬程度和凋亡率均呈浓度依赖性增加(P<0.05),见表3,图1、2。
2.3 各组p53、AMPK及mTOR的mRNA相对表达水平比较 随着QE浓度增加,胃癌细胞中p53、AMPKmRNA相对表达水平均呈浓度依赖性增加,而mTORmRNA相对表达水平呈浓度依赖性降低(P<0.05),见表4。
Tab.2 Comparison of inhibition rates of gastric cancer cells between the four groups表2 各组胃癌细胞抑制率比较(n=6,%,±s)

Tab.2 Comparison of inhibition rates of gastric cancer cells between the four groups表2 各组胃癌细胞抑制率比较(n=6,%,±s)
*P<0.05,**P<0.01;a与QEA组比较,b与QEB组比较,c与QEC组比较,P<0.05;A与12 h比较,B与24 h比较,P<0.05
组别QEA组QEB组QEC组QED组F 12 h 9.511±1.48114.621±1.532a 26.032±2.951ab 39.861±3.423abc 174.881**24 h 14.782±1.344A 27.472±3.012aA 37.823±3.402abA 54.801±1.931abcA 179.793**48 h 17.584±1.541AB 42.074±2.452aAB 60.324±3.993abAB 70.474±1.933abcAB 462.472**F 13.424*257.004**254.853**142.361**
2.4 各组LC3Ⅱ∕LC3Ⅰ、P53、AMPK及mTOR的蛋白相对表达水平比较 随着QE浓度增加,胃癌细胞中LC3Ⅱ∕LC3Ⅰ、P53、AMPK相对表达水平均呈浓度依赖性增加,而mTOR相对表达水平呈浓度依赖性降低(P<0.05),见表5、图3。
Tab.3 Comparison the effects of autophagy and apoptosis rates of gastric cancer cells between the five groups表3 各组细胞自噬和细胞凋亡率的比较(n=6,±s)

Tab.3 Comparison the effects of autophagy and apoptosis rates of gastric cancer cells between the five groups表3 各组细胞自噬和细胞凋亡率的比较(n=6,±s)
**P<0.01;a与溶剂组比较,b与QEA组比较,c与QEB组比较,d与QEC组比较,均P<0.05;表4、5同
细胞凋亡率(%)2.642±0.3226.473±1.544a 13.413±2.273ab 23.293±3.694abc 41.685±3.415abcd 224.093**组别溶剂组QEA组QEB组QEC组QED组F细胞自噬(IOD)0.331±0.0510.532±0.083a 0.713±0.092ab 0.932±0.112abc 1.121±0.072abcd 83.652**

Fig.1 Comparison of autophagy in gastric cancer cells(MDC staining,×200)图1 胃癌细胞自噬比较(MDC染色,×200)

Fig.2 Effects of different concentrations of quercetin on cell apoptosis rate图2 不同浓度QE对细胞凋亡率的影响
Tab.4 mRNA relative expression levels of p53,AMPK and mTOR in each group表4 各组p53、AMPK及mTOR的mRNA相对表达水平(n=6,±s)
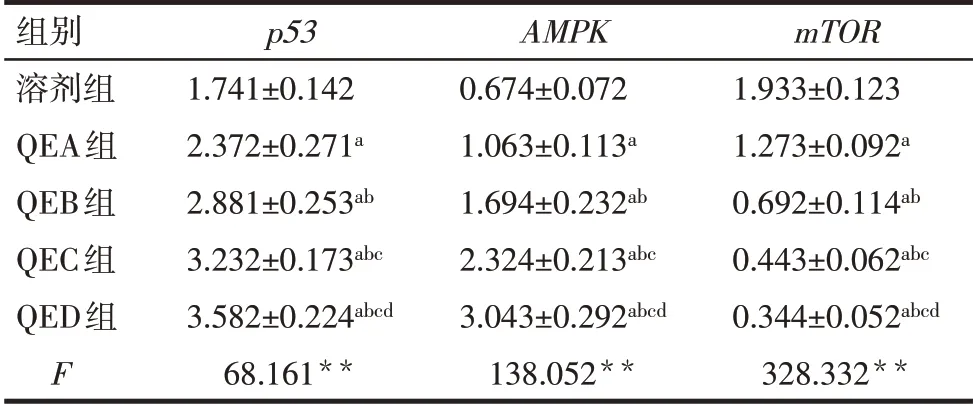
Tab.4 mRNA relative expression levels of p53,AMPK and mTOR in each group表4 各组p53、AMPK及mTOR的mRNA相对表达水平(n=6,±s)
组别溶剂组QEA组QEB组QEC组QED组F p53 1.741±0.1422.372±0.271a 2.881±0.253ab 3.232±0.173abc 3.582±0.224abcd 68.161**AMPK 0.674±0.0721.063±0.113a 1.694±0.232ab 2.324±0.213abc 3.043±0.292abcd 138.052**mTOR 1.933±0.1231.273±0.092a 0.692±0.114ab 0.443±0.062abc 0.344±0.052abcd 328.332**
Tab.5 Comparison of protein expression of LC3Ⅱ/LC3Ⅰand p53/AMPK/mTOR signaling pathway between the five groups表5 各组LC3Ⅱ/LC3Ⅰ和p53/AMPK/mTOR信号通路蛋白表达的比较 (n=6,±s)

Tab.5 Comparison of protein expression of LC3Ⅱ/LC3Ⅰand p53/AMPK/mTOR signaling pathway between the five groups表5 各组LC3Ⅱ/LC3Ⅰ和p53/AMPK/mTOR信号通路蛋白表达的比较 (n=6,±s)
组别溶剂组QEA组QEB组QEC组QED组F LC3Ⅱ∕LC3Ⅰ0.361±0.0411.872±0.131a 2.123±0.212ab 2.382±0.174abc 2.581±0.314abcd 728.532**P530.921±0.0421.312±0.061a 1.571±0.081ab 1.682±0.152abc 1.813±0.143abcd 69.124**AMPK 0.323±0.0330.532±0.043a 0.893±0.122ab 1.222±0.091abc 1.561±0.131abcd 183.954**mTOR 0.943±0.0630.693±0.041a 0.372±0.113ab 0.241±0.021abc 0.181±0.024abcd 165.932**

Fig.3 Comparison of LC3Ⅱ∕LC3Ⅰ,p53∕AMPK∕mTOR signaling pathway proteins图3 LC3Ⅱ∕LC3Ⅰ、p53∕AMPK∕mTOR信号通路蛋白比较
3 讨论
胃癌细胞的增殖、浸润和转移是大多数胃癌患者的主要死亡原因。有关QE对胃癌的抗肿瘤作用研究主要集中在对胃癌细胞生长、增殖及凋亡的影响及其可能作用机制[5],但目前关于其对肿瘤细胞自噬的研究较少。细胞的增殖、自噬和凋亡是非常重要的生理过程,正常情况下细胞的增殖会受到自身限制,自噬程度较低,细胞凋亡现象正常,三者共同调控细胞生理过程。然而,在肿瘤细胞中这些平衡会被打破,肿瘤细胞增殖速度异常增加,凋亡水平下降。
P53蛋白能够活化DNA修复蛋白,从而抑制肿瘤的发生[6]。研究显示,活化的DNA修复蛋白能接合于DNA,启动Bax、P21等多个基因表达,使p21蛋白与细胞周期蛋白依赖激酶(CDK2)形成复合体,从而促进肿瘤细胞凋亡[7]。P53也可以调节细胞自噬的发生。有研究发现,AMPK信号通路与mTOR通路存在交叉,mTOR含有2种复合体mTORC1和mTORC2;P53可以激活AMPK,活化的AMPK会使mTORC1的表达下调,同时会活化UNC-51样激酶1(ULK1),诱导肿瘤细胞自噬[8]。自噬主要功能是降解过大的细胞结构,并通过重复利用氨基酸来维持细胞功能,使细胞在饥饿条件下存活[9]。自噬开始后,ULK1磷酸化并激活磷脂酰肌醇-3-激酶(PI3K)复合物,在新生的自噬体膜上形成含有自噬相关蛋白(ATG)9的吞噬膜。在ATG4、ATG7和ATG3的活化作用下,LC3Ⅰ转化为LC3Ⅱ,LC3Ⅱ∕LC3Ⅰ比值的大小可估计自噬水平的高低[10]。本研究结果显示,随着QE浓度的增加和作用时间的延长,肿瘤细胞的抑制率均明显增加;胃癌细胞自噬程度和凋亡率亦随QE浓度增加而增加,表明QE浓度越高,细胞自噬和凋亡也越明显。既往研究认为,QE具有抗氧化作用,可影响体内金属离子(Zn2+、Fe2+等)平衡,调节代谢状态,并已在直肠癌、肺癌等肿瘤细胞中得到证实[11-12]。研究发现,QE可调控Wnt∕β-catenin、P38 AMPK等多个信号通路[13-14]。李蔚等[14]研究发现,QE可以通过Wnt∕β-catenin信号通路促进伊马替尼(IM)敏感细胞K562和耐药细胞K562R的凋亡。王象鹏等[15]研究发现,QE可以通过调控P38∕AMPK信号通路,降低骨关节细胞中炎性因子的表达。文兰香等[16]研究发现,QE可以通过AMPK∕mTOR通路影响细胞自噬。Siaw等[17]研究发现,QE可以活化mTOR,促进L1929纤维细胞的增殖。本研究结果显示,随着QE浓度增加,胃癌细胞中p53、AMPK mRNA和蛋白相对表达水平均呈浓度依赖性增加,而mTOR mRNA和蛋白相对表达水平呈浓度依赖性降低,表明QE可通过p53∕AMPK∕mTOR信号通路抑制细胞增殖,增强胃癌细胞自噬水平,诱导肿瘤细胞凋亡。另有动物实验研究亦显示,QE能够诱导胃癌细胞凋亡,抑制胃癌细胞的增殖,证实QE可通过抑制PI3K∕Akt通路诱导线粒体凋亡[18-19]。
综上所述,QE可通过激活p53∕AMPK∕mTOR信号通路,增强肿瘤细胞自噬水平,促进胃癌细胞凋亡。

