甲基转移酶3基因对前列腺癌细胞c-Myc、EGFR、Bcl-2表达的影响及其机制
李显永,赵晖,梁勇,程阳,韩登俊,官润云
1自贡市第四人民医院泌尿外科,四川自贡643000;2昆明医科大学第一附属医院泌尿外科
目前已经发现100多种真核生物RNA转录后修饰方式[1],其中N6-甲基腺苷(m6A)是真核生物RNA最普遍的内部修饰方式[2]。m6A是一种动态可逆的RNA甲基化修饰,与其相关的蛋白包括甲基转移酶复合体[甲基转移酶3(METTL3)、肾母细胞瘤1-相关蛋白(WTAP)、甲基转移酶14(METTL14)]、去甲基酶[肥胖相关基因(FTO)、B同源蛋白5],相应的阅读蛋白如YTH结构域包含蛋白等[3]。METTL3作为甲基转移酶复合体成员之一,现有研究认为其是惟一具备RNA m6A修饰催化活性的酶[4]。m6A修饰可从多方面影响mRNA的新陈代谢,如参与mRNA的半衰期调节、稳定性、翻译效率、剪接和出核等生物进程[3,5]。白血病、肺癌等肿瘤中相关肿瘤基因上存在大量m6A修饰,高丰度的m6A修饰将促进肿瘤的发生及进展[6-7]。前期研究表明,METTL3基因在雄激素非依赖性前列腺癌细胞系PC-3、DU145中呈高丰度表达,可增强前列腺癌细胞增殖、侵袭和克隆形成能力[8-10],然而具体分子机制尚不清楚。2019年2月—2020年1月,本研究拟通过RNA干扰技术沉默METTL3基因表达,观察雄激素非依赖性前列腺癌细胞PC-3、DU145中肿瘤相关蛋白c-Myc、EGFR、Bcl-2的表达变化,并探讨相应机制。现报告如下。
1 材料与方法
1.1 实验细胞与主要材料 PC-3、DU145细胞均购自中国科学院昆明动物研究所细胞库。F12培养基、胎牛血清购自美国Gibco公司。脂质体Lipofectamine2000试剂购自美国Invitrogen公司。实时荧光定量试剂、RIPA裂解液均购自Sangon公司。兔抗METTL3单克隆抗体、鼠抗m6A单克隆抗体、兔抗c-Myc单克隆抗体、兔抗Bcl-2单克隆抗体、兔抗EGFR单克隆抗体均购自英国Abcam公司。鼠抗GAPDH单克隆抗体购自美国Sigma公司。脱脂奶粉购自完达山有限公司。PVDF转移膜购自美国Millipore公司。带电尼龙膜购自生兴生物公司。
1.2 细胞分组及转染 人前列腺癌PC-3、DU145细胞用含10%胎牛血清的F12培养基置于培养箱(37 ℃、5%CO2饱和湿度)中常规培养,细胞达80%以上融合时进行传代培养,平均3 d传代1次。PC-3、DU145细胞按2×105/孔接种于6孔板,在37 ℃、5% CO2条件下培养24 h。将细胞分为空白对照组、阴性对照组和实验组。筛选针对METTL3基因的特异性siRNA片段和阴性对照siRNA片段[9]。METTL3 siRNA-1400上游序列为5′-GCUCAACAUACCCGUACUA-3′,下游序列为5′-UAGUACGGGUAUGUUGAGC-3′。阴性对照siRNA上游序列为5′-UUCUCCGAACGUGUCACGU-3′,下游序列为5′-ACGUGACACGUUCGGAGAA-3′。空白对照组不做特殊处理,阴性对照组转染阴性对照siRNA,实验组转染METTL3 siRNA-1400。于培养箱中温育6 h后,更换完全培养基继续培养。采用RT-PCR和Western blotting法检测转染效率[9],转染效率在80%以上。实验组METTL3 siRNA-1400片段有效抑制了METTL3基因表达,用于后续实验。
1.3 各组细胞中c-Myc、EGFR、Bcl-2蛋白检测 采用Western blotting法。转染48 h后,收集各组细胞样本后加入裂解液,裂解物高速离心,取上清,-80 ℃保存。取样本并加入5×SDS-PAGE上样缓冲液,加热后离心去不溶性沉淀。上样品行SDS-PAGE电泳,后使用湿转法进行转印,转膜后使用5%脱脂牛奶室温封闭1 h。加入稀释后的一抗(c-Myc 1∶1 000,Bcl-2 1∶1 000,EGFR 1∶1 000,内参GAPDH 1∶10 000),于4 ℃温育条件下过夜。加入稀释后的二抗,于室温条件下温育2 h。使用Gel-Pro Analyze图像软件行结果分析,以目的蛋白灰度值与GAPDH灰度值的比值表示目的蛋白相对表达量。
1.4 各组细胞总RNA m6A水平检测 采用Dolt blotting法。各组细胞样本RNA提取后,浓度稀释至20 ng/μL,于95 ℃条件下RNA变性,然后冰上冷却。将2.5 μL的RNA加置带电尼龙膜上,后于波长254 nm/312 nm紫外光照射30~60 s。TBST洗膜,封闭液封闭转印膜1 h,加入一抗(m6A 1∶1 000),4 ℃条件温育过夜。加入二抗(山羊抗IgG 1∶2 000),室温条件温育2 h。采用Super Signal West Pico Chemiluminent Substrates发光液和FR-1800全功能发光及荧光生物图像分析系统进行化学发光检测。采用Gel-Pro Analyzer软件处理并分析结果。

2 结果
2.1各组细胞中c-Myc、EGFR、Bcl-2蛋白表达比较 详见表1、表2和图1、图2。
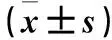
表1 各组PC-3细胞c-Myc、EGFR、Bcl-2蛋白表达比较
表2 各组DU145细胞c-Myc、EGFR、Bcl-2蛋白表达比较

图1 各组PC-3细胞c-Myc、EGFR、Bcl-2蛋白表达情况(Western blotting法)

图2 各组DU145细胞c-Myc、EGFR、Bcl-2蛋白表达情况(Western blotting法)
2.2 各组细胞总RNA m6A水平变化 PC-3细胞实验组、阴性对照组、空白对照组RNA m6A修饰水平分别为15 765.853±3 102.316、33 778.833±4 803.387、33 539.744±4 783.892,DU145细胞实验组、阴性对照组、空白对照组RNA m6A修饰水平分别为9 354.107±1 158.352、20 820.921±1 622.452、23 290.103±1 697.817,实验组RNA m6A修饰水平均低于空白对照组和阴性对照组(P均<0.01)。见图3。
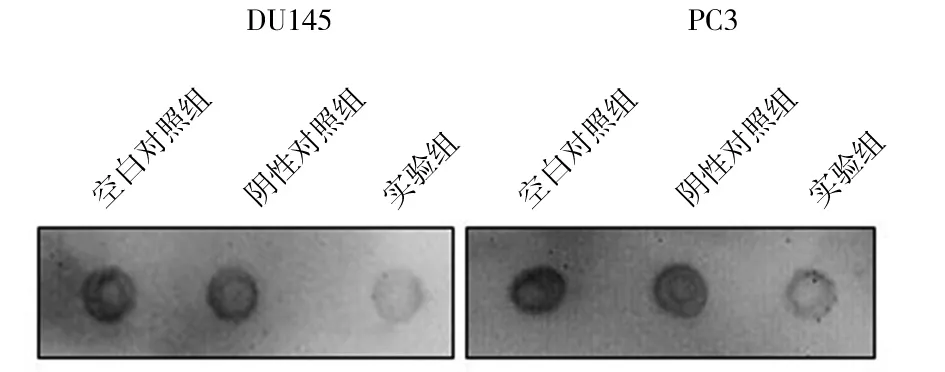
图3 各组PC-3、DU145细胞RNAm6A修饰水平检测结果(Dolt blotting法)
3 讨论
早期从宫颈癌HeLa细胞裂解液中分离出催化m6A修饰形成的两个复合物,分别为MT-A(200 kDa)和MT-B(800 kDa)。METTL3则是从MT-A复合物中鉴别出的一个70 kDa的蛋白[11]。很长一段时间以来,关于METTL3、m6A的研究缓慢,直到2011年去甲基转移酶FTO的发现,揭示了m6A是一种动态可逆的RNA修饰方式[12],随后其他m6A相关的酶相继发现,它们在多种肿瘤中发挥的作用也被揭示。CAI等[10]发现,沉默前列腺癌细胞系中的METTL3可导致肿瘤细胞增殖、存活、集落形成、侵袭能力下降。本课题组前期研究也得到相似结果,同时还发现高表达的METTL3与前列腺癌的发生发展及分化密切相关[8]。
为了探索METTL3基因在雄激素非依赖性前列腺癌中可能发挥的作用机制,本实验通过RNA干扰技术下调前列腺癌PC-3、DU145细胞中METTL3表达后,发现肿瘤相关蛋白c-Myc、EGFR、Bcl-2表达也显著下调。这提示下调METTL3基因将抑制前列腺癌肿瘤相关蛋白c-Myc、Bcl-2、EGFR的表达。c-Myc、EGFR、Bcl-2是与前列腺癌发生发展关系紧密的癌基因,在前列腺癌中发挥重要的肿瘤基因特性。原癌基因c-Myc参与细胞增殖和分化的调节,是众多肿瘤发生的基础,高表达的c-Myc与前列腺癌的复发及预后不良相关[13]。研究表明,高表达的EGFR接受EGF的刺激维持前列腺癌细胞生长,促进前列腺癌的骨转移[14]。还有研究显示,前列腺癌中抗细胞凋亡因子Bcl-2介导的信号通路是雄激素受体拮抗剂恩杂鲁胺耐药的机制之一[15]。由此推测,前列腺癌中高表达的METTL3可能促进了前列腺癌相关肿瘤蛋白的表达,参与了肿瘤的发生及进展。
近期研究表明,METTL3是甲基转移酶复合体中惟一具备独立催化活性的酶,可以接受S-腺苷基甲硫氨酸为m6A修饰形成提供甲基。而METTL14并不发挥实际的催化活性,可与METTL3相结合形成异质二聚体,参与METTL3活性位点的变构,并且促进与RNA底物结合的作用,提升催化效率。WTAP发挥调节亚基作用,招募甲基转移酶复合体在mRNA上的定位,促进m6A修饰形成。METTL3是m6A修饰形成至关重要的酶[4]。本实验在PC-3、DU145细胞中通过RNA干扰技术成功下调METTL3基因表达,进一步检测发现前列腺癌细胞总RNA的m6A修饰水平也相应下调,与以上基础研究结果相符。
有学者采用高通量测序发现,m6A峰主要分布在mRNA的5′非编码区(UTR)、3′非翻译区、内部外显子、翻译起始和终止密码子附近区域,对转录后基因的表达产生重要影响[7]。通常蛋白质的合成是在mRNA的5′端由起始因子eIF4F与7-甲基鸟嘌呤结合而启动翻译,但RYAN等[5]研究发现m6A修饰可以不依赖eIF4F的活性而促进mRNA的翻译,当消耗METTL3后将会选择性地抑制携带有5′UTR甲基化mRNA的翻译。关于白血病的研究发现,肿瘤基因c-Myc、Bcl-2、PTEN mRNA存在大量m6A修饰,敲低METTL3后mRNA的m6A修饰丰度降低,相应的肿瘤蛋白表达也下调,认为m6A促进了相关肿瘤基因的翻译[6]。乳腺癌相关研究也表明,METTL3可以通过靶向Bcl-2 mRNA的m6A修饰,调节肿瘤基因Bcl-2的表达[16]。关于肺癌的研究显示,miR-33a可以直接靶向METTL3 mRNA的3′UTR,抑制其表达,使METTL3下游的肿瘤基因EGFR、TAZ、MAPKAPK2和DNMT3A蛋白表达也相应下调[17]。LIN等[7]发现,肺癌细胞内肿瘤基因EGFR、TAZ、MAPKAPK2、DNMT3A mRNA的终止密码子附近存在一个或多个m6A峰,敲低METTL3后靶点基因mRNA的m6A修饰水平下降,相应的肿瘤蛋白表达也明显下调,但其mRNA的丰度并无明显变化,提示METTL3可能调控了mRNA的翻译进而影响肿瘤蛋白的表达。本研究在PC-3、DU145细胞中下调METTL3表达后,发现细胞RNA的m6A修饰水平下降,同时相关肿瘤蛋白c-Myc、EGFR、Bcl-2表达也显著下调。由此推测,前列腺癌细胞中高表达的METTL3可能通过m6A修饰途径促进了前列腺癌肿瘤相关基因的翻译,上调肿瘤蛋白的表达。
此外,CHOE等[18]后续研究发现,细胞质中的METTL3可以不依赖于自身的甲基转移酶活性及下游的m6A相关阅读蛋白而促进mRNA的翻译。METTL3蛋白分子的前200个氨基酸片段与翻译起始因子eIF3h相互作用,促使mRNA形成loop环,增加mRNA和核糖体再循环利用效率,从而提升肿瘤基因的翻译效率。由此可见,前列腺癌细胞中高表达的METTL3也可能独立于其甲基转移酶活性以及m6A相关阅读蛋白直接促进肿瘤相关基因的翻译。
综上,本研究结果表明,沉默雄激素非依赖性前列腺癌PC-3、DU145细胞METTL3基因后,将下调肿瘤相关蛋白c-Myc、EGFR、Bcl-2的表达,其机制可能与METTL3参与RNA的m6A修饰有关,其具体的翻译调控机制及对雄激素依赖性前列腺癌的影响还有待后续实验探索。

