免疫磁珠高通量自动净化-超高效液相色谱法测定粮食中玉米赤霉烯酮
陈金男,叶 金,*,郭旭光,李 丽,刘洪美,吴 宇,王松雪,*
(1.国家粮食和物资储备局科学研究院,粮油质量安全研究所,北京 102629;2.河南省口岸食品检验检测所,河南 郑州 450003)
玉米赤霉烯酮为首次从患有赤霉病的玉米中分离得到的镰刀菌代谢产物,广泛存在于霉变的玉米、高粱、小麦等粮食及其制品中,严重危害人类及动物的健康。玉米赤霉烯酮有强烈的生殖毒性和致畸作用,影响家畜的繁殖,给畜牧业造成很大的经济损失[1-4]。我国和欧盟对谷物中的玉米赤霉烯酮制定了相关限量标准[5-6]。GB 2761—2017《食品中真菌毒素限量》中食品(谷物及其制品)中的玉米赤霉烯酮限量为60 μg/kg[5]。李丹迪等[7]对山东省济南市区4 个不同地点随机采集的50 份即食谷物加工制品中玉米赤霉烯酮含量进行检测,76.0%的样本检出玉米赤霉烯酮阳性,其中8 份样品超过我国食品中规定限量,受污染样品的最大值为国家限量标准值的3.1 倍。陈皆全[8]在2017—2019年间对广西省百色市12 个县(市、区)随机抽取的186 份处于收获期的玉米中玉米赤霉烯酮含量进行检测,玉米赤霉烯酮检出率为45.16%,其中最高含量为4 221.0 μg/kg,超标率为22.04%,收获期玉米受污染较为严重。Golge等[9]从土耳其采集了240 份粮食样本,其中,4%的小麦、20%的玉米、55%的稻谷和4%的面粉中检测出玉米赤霉烯酮阳性,1 份稻谷样本超过欧盟对玉米赤霉烯酮的限量。因此,粮食及其制品中的玉米赤霉烯酮污染较为普遍,加强对粮食中玉米赤霉烯酮污染情况的监测至关重要。
样品前处理是粮食中玉米赤霉烯酮分析方法的重要步骤。前处理方法影响检测结果的准确性和精密度,是最耗时、容易出错的步骤。粮食中玉米赤霉烯酮的前处理方法主要有免疫亲和柱法[10-11]、固相萃取柱法[12-13]、QuEChERS(quick, easy, cheap, effective, rugged and safe)[14-15]法等,上述方法虽然能够有效提取粮食中的玉米赤霉烯酮,但是存在操作复杂、耗时长、成本高等缺点。免疫磁珠(immunomagnetic beads,IMBs)是新型磁性纳米粒子材料,具有超顺磁性、尺寸小及可进行多样化修饰等特点。近几年,基于免疫磁珠的净化方法由于灵敏度高、操作简单、耗时短、可批处理样品、人员要求低等优点,受到了广泛关注与研究[16-17]。免疫磁珠净化方法通过免疫磁珠上玉米赤霉烯酮抗体特异性的亲和作用将玉米赤霉烯酮从样品稀释液中识别和富集出来,清洗杂质,再利用有机试剂破坏免疫磁珠上抗体的空间结构,从免疫磁珠上释放玉米赤霉烯酮,便于后续的分析检测。孙毅蒙等[18]以金属有机框架为基础,制备出Fe3O4@AMP&ZnCl2·ZEA单抗磁珠用于玉米中玉米赤霉烯酮的检测。制备磁珠的玉米赤霉烯酮毒素负载量为3 μg/100 mg。对玉米粉进行3 个水平的添加回收率实验,回收率在84.61%~90.00%之间,相对标准偏差为4.86%~9.44%。刘玉梅等[19]通过玉米赤霉烯酮与对苯二胺反应,制备玉米赤霉烯酮免疫磁珠分离富集试剂盒,试剂盒对样品中玉米赤霉烯酮的捕获量为50 ng/mL。在捕获量范围内的添加回收率为65.4%~93.8%,且对与玉米赤霉烯酮结构或功能相似的竞争药物无交叉反应,具有较高的特异性。上述免疫磁珠净化方法虽然能够满足粮食中玉米赤霉烯酮的分离与纯化,但是步骤仍较为复杂,需手动进行,且净化时间较长。因此,采用自动化、高通量的前处理方法具有重要意义[20-22]。本方法开发的自动净化、高通量前处理方法能有效减少前处理时间,提高效率,且避免人为因素影响实验结果,可提高粮食中玉米赤霉烯酮常规检测的准确性、便捷性和重复性。
目前常规高效液相色谱法多用于检测粮食中玉米赤霉烯酮,但该方法分析速度慢、溶剂耗费多、灵敏度低。为建立一种高效、灵敏的快速定量分析方法,本实验采用超高效液相色谱(ultra-high performance liquid chromatography,UPLC)检测粮食中的玉米赤霉烯酮。相比于高效液相色谱,UPLC具有进样量小、分离度高、灵敏度高、分析速度快等优点,是近年来用于微量快速分析的热门方法[23-26]。
本实验结合免疫磁珠高通量自动净化的前处理方法,基于UPLC分离技术,建立一种操作简单、快速准确、成本低的检测方法,以期满足粮食中玉米赤霉烯酮高通量、自动化、高准确性和高灵敏度的检测需求。
1 材料与方法
1.1 材料与试剂
玉米赤霉烯酮甲醇溶液(GBW(E)100301)、玉米全粉呕吐毒素、玉米赤霉烯酮成分标准物质(GBW(E)100383)、国家有证标准物质全麦粉玉米赤霉烯酮成分标准物质(GBW(E)100384)、玉米全粉玉米赤霉烯酮成分标准物质(GBW(E)100385)、糙米粉玉米赤霉烯酮质控样品(TOXIN-JTZK-015)、全麦粉玉米赤霉烯酮质控样品(TOXIN-JTZK-003)、全麦粉玉米赤霉烯酮质控样品(TOXIN-JTZK-030)、全麦粉空白(TOXIN-JTZK-006)、玉米全粉空白(TOXINJTZK-005) 国家粮食和物资储备局科学研究院;粮食中玉米赤霉烯酮免疫磁珠试剂盒 北京东孚久恒仪器技术有限公司;玉米赤霉烯酮免疫亲和柱 北京华安麦科生物技术有限公司;甲醇、乙腈(均为色谱纯) 美国Fisher公司;桶装水 中国屈臣氏(香港)有限公司;0.2 μm PTFE膜针头过滤器 美国PALL公司;高纯氮北京千禧京城气体有限公司;移液枪(100~1 000 μL)德国Eppendorf公司。
1.2 仪器与设备
Acquity UPLC仪、Acquity荧光检测器 美国Waters公司;JJHZ10真菌毒素全自动净化仪 北京东孚久恒仪器技术有限公司;5810R台式高速冷冻离心机 德国Eppendorf公司;MTV-100多管旋涡混合仪 杭州奥盛仪器有限公司;电子天平 赛多利斯科学仪器有限公司;N-EVAP112快速溶剂吹干器 美国Organomation公司。
1.3 方法
1.3.1 标准溶液配制
用移液枪准确吸取一定体积的玉米赤霉烯酮甲醇标准溶液,用甲醇-水(1∶1,V/V)稀释成5、10、20、50、100、200、500 ng/mL的标准工作液于2 mL进样瓶中,涡旋混匀后,室温保存以备检测。
1.3.2 样品前处理
粮食样品经过粉碎(90%通过20 目筛)混匀后,准确称取(5.00±0.01)g于50 mL离心管中,加入15 mL提取液,充分振荡20 min,室温、7 000 r/min离心5 min。吸取1 mL上清液加入到试剂盒样品孔中,将试剂盒放置到真菌毒素全自动净化仪中,启动玉米赤霉烯酮净化程序。净化结束后,及时吸取洗脱孔0.4 mL洗脱液,50 ℃氮吹至干,用0.4 mL流动相进行复溶,涡旋30 s溶解残留物,用0.22 μm有机滤膜过滤后收集在进样瓶中,室温保存以备检测。
1.3.3 免疫磁珠高通量自动净化及UPLC检测流程
免疫磁珠高通量自动净化-UPLC检测流程如图1所示。粮食样品经过提取后,吸取上清液加入试剂盒稀释孔中,随即将试剂盒放入真菌毒素全自动净化仪中,启动净化程序,自动完成样品的稀释、毒素富集、杂质清洗和目标物的洗脱等流程。净化结束后准确吸取洗脱液进行氮吹、复溶和过滤,即可上机检测。每个样品的磁珠使用量为1 mg,含有抗体约0.4 mg。

图1 免疫磁珠高通量自动净化-UPLC检测流程图Fig.1 Flow chart of high-throughput automatic purification based on immunomagnetic beads coupled with UPLC
1.3.4 仪器条件
真菌毒素全自动净化仪净化程序:磁珠转移到样品孔,混合5 min,磁吸7.5 min;磁珠转移到清洗孔(2 个),每个清洗孔清洗1 min,磁吸1 min;磁珠转移到洗脱孔,洗脱1 min,磁吸1 min后将磁珠转移到磁珠回收孔,净化结束。单个样品中玉米赤霉烯酮的自动净化时间为26 min。
UPLC条件:色谱柱为BEH-C18柱(100 mm×2.1 mm,1.7 μm);柱温40 ℃,样品温度10 ℃;进样量10 μL。流动相:水-乙腈(45∶55,V/V)溶液,等度洗脱,流速0.2 mL/min。荧光检测波长:激发波长303 nm,发射波长440 nm。
1.3.5 分析方法的验证
对免疫磁珠高通量自动净化-UPLC方法进行加标回收率、重复性、稳定性、线性范围、检出限(limit of detection,LOD)和定量限(limit of quantitation,LOQ)测定。LOD和LOQ采用逐级稀释法得到,峰响应值RSN=3时确定LOD,RSN=10时确定LOQ。对粮食阴性样品(小麦、玉米)进行3 个不同添加量水平(低、中、高)基质加标回收率的测定。基质加标后在室温25 ℃放置过夜,以蒸发加入标准溶液中的有机溶剂。除基质加标回收率的研究,还通过检测国家有证标准物质或质控样品评估该方法的准确性和精密性。在60 μg/kg加标量测定重复性,重复测定4 d,考察该方法的稳定性。采用t检验和Bland-Altman法对免疫磁珠和免疫亲和柱净化法之间的差异进行分析。
1.4 数据分析
所有数据均使用Microsoft Excel 2016软件计算,并使用OriginPro 8.5软件绘图。
2 结果与分析
2.1 免疫磁珠与玉米赤霉烯酮反应时间的优化
将免疫磁珠与玉米赤霉烯酮标准溶液(添加量60 μg/kg)反应,分别考察不同反应时间(2、5、8、12 min)下磁珠与玉米赤霉烯酮的结合效率(图2)。反应5 min后磁珠吸附玉米赤霉烯酮的回收率可达99.36%。反应时间超过5 min后,回收率未明显提高。因此,在免疫磁珠自动净化过程中,免疫磁珠与玉米赤霉烯酮反应5 min即可达到预期效果。
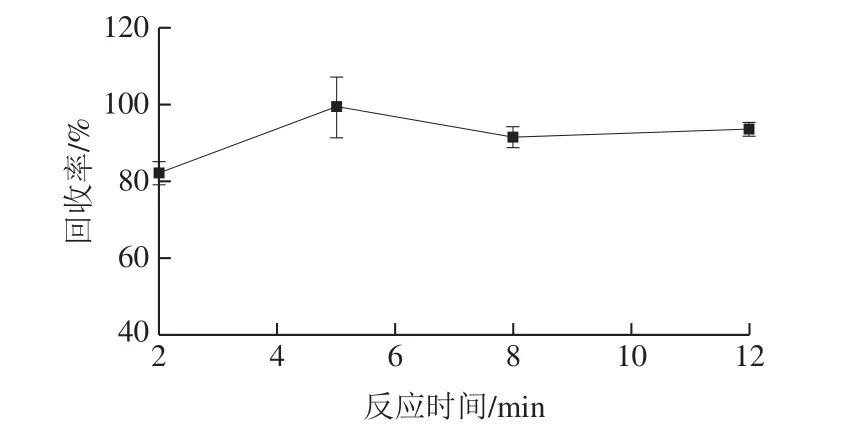
图2 免疫磁珠与玉米赤霉烯酮反应时间的优化(n=3)Fig.2 Optimization of reaction time between immunomagnetic beads and zearalenone (n = 3)
2.2 样品提取液的优化
在全麦粉和玉米全粉阴性样品中加入玉米赤霉烯酮标准溶液(添加量60 μg/kg),加标回收率如图3所示。70%甲醇-水、90%乙腈-水和70%乙腈-水3 种提取液的加标回收率在合理范围内,但是70%甲醇-水对小麦和玉米基质的提取效果相对较差。当免疫磁珠从提取稀释液中识别和富集玉米赤霉烯酮时,较大比例的有机试剂会对免疫磁珠上的抗体产生破坏作用。采用不同体积分数的乙腈(0%、5%、10%、15%、20%、30%)作为提取稀释液进行测定,将免疫磁珠与玉米赤霉烯酮标准溶液(添加量60 μg/kg)反应测定其加标回收率,结果如图4所示。当提取稀释液中乙腈体积分数达到30%时,玉米赤霉烯酮的加标回收率明显下降,仅为65.1%。因此,为保证抗体不被破坏,本方法采用有机试剂相对含量较低的70%乙腈-水作为提取液。
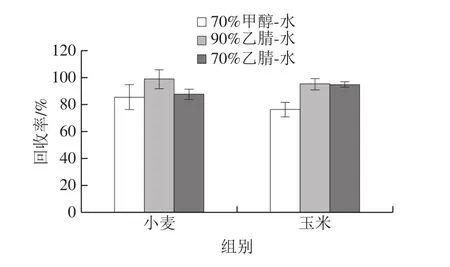
图3 不同提取液对粮食阴性样品加标回收效果的影响Fig.3 Effects of different extraction solvents on recoveries of spiked grain matrices
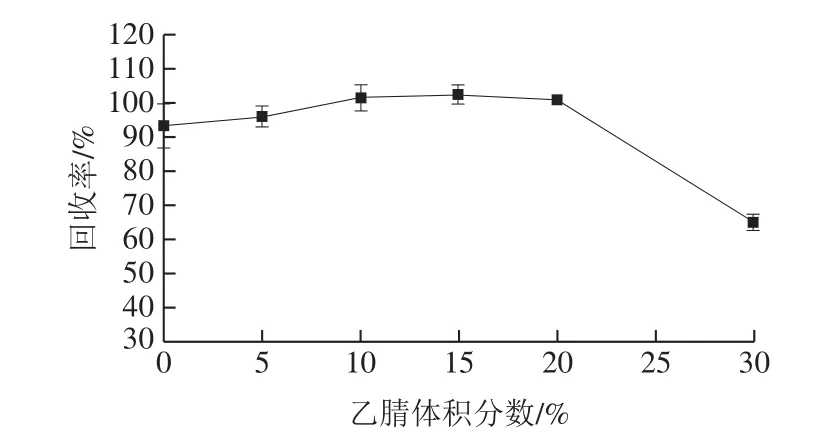
图4 乙腈体积分数对免疫磁珠回收率的影响(n=2)Fig.4 Effect of acetonitrile concentration on recoveries of zearalenone (n = 2)
2.3 免疫磁珠对不同粮食基质净化效果的优化
如图5所示,经过免疫磁珠净化后小麦、玉米等粮食基质的UPLC图均较为干净,目标峰附近没有干扰物,因此本方法的杂质净化效果良好。
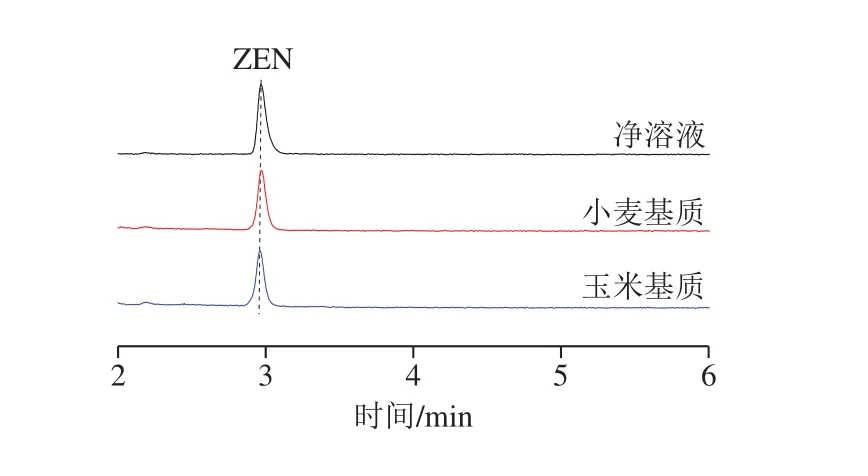
图5 2种粮食基质玉米赤霉烯酮免疫磁珠净化的UPLC图Fig.5 UPLC profiles of zearalenone purified with immunomagnetic beads from two grain matrices
2.4 分析方法的验证
2.4.1 方法的线性范围、LOD和LOQ
在5~500 ng/mL范围内制备了一系列标准溶液建立标准曲线。以峰面积(Y)与标准溶液质量浓度(X)绘制标准曲线,得到回归方程Y=727.11X+2 151.76,R2=0.999 98,其具有良好的线性,LOD为3.5 μg/kg,LOQ为12.0 μg/kg,均低于我国谷物及其制品中玉米赤霉烯酮的限量[5],可满足日常检测要求。
2.4.2 方法的准确度和精密度
为考察该方法的准确度和精密度,对玉米全粉和全麦粉阴性样品添加30、60、120 μg/kg的玉米赤霉烯酮进行含量和加标回收率测定,结果见表1。玉米和小麦进行低、中、高3 个水平的加标回收率在99.04%~109.26%之间,变异系数不大于6.88%。选用玉米全粉、全麦粉、糙米粉、小麦粉等粮食基质中玉米赤霉烯酮成分的国家有证标准物质或质控样品验证该方法的准确性,检测结果如表2所示,测定值在标准值及其扩展不确定度范围内,变异系数不大于3.54%,检测结果较理想。
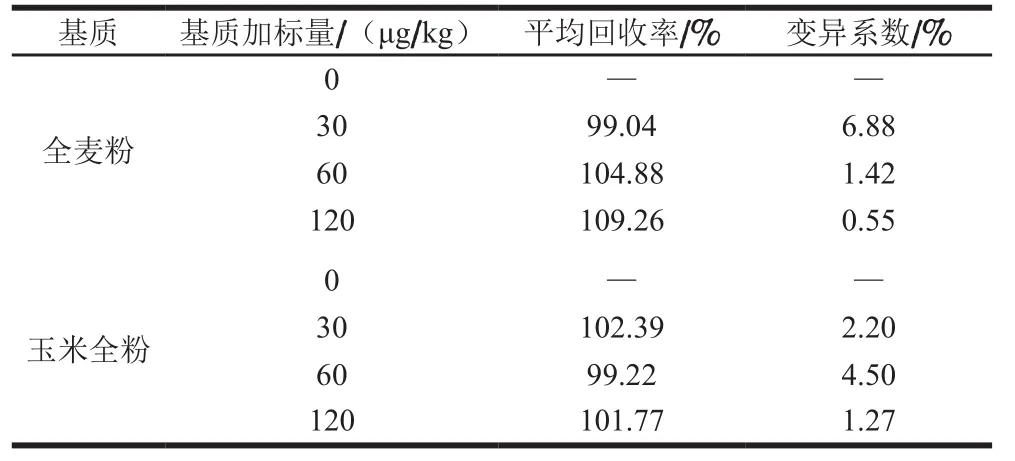
表1 玉米赤霉烯酮免疫磁珠净化的加标回收率和变异系数(n=3)Table 1 Spiked recoveries and coefficients of variation of zearalenone with immunomagnetic bead purification (n = 3)

表2 不同粮食基质玉米赤霉烯酮成分标准物质和质控样品检测结果(n =2)Table 2 Results of zearalenone determination in reference materials and quality control samples for different grain matrices (n = 2)
2.4.3 日间精密度考察
采用免疫磁珠自动净化方法检测连续4 d的加标回收率,结果见表3。本净化方法连续4 d的加标回收率平均在101.63%~103.01%之间,日间精密度在4.88%~5.72%之间,重复性良好。

表3 本方法日间精密度Table 3 Intraday precision of the method%
2.4.4 免疫亲和柱净化法(国标法)和免疫磁珠自动净化法的评测
本实验分别采用免疫亲和柱净化法(国标法)和全自动净化仪-免疫磁珠净化试剂盒对采集于全国不同地区新收获的小麦、玉米、糙米共22 个阳性样品进行测定。采用配对t检验,评价2 种净化方法测定结果的一致性。如表4所示,通过t检验可知,td值(1.46)小于理论t0.05(21)值(2.08),P>0.05,2 种净化方法的测定结果无显著差异。
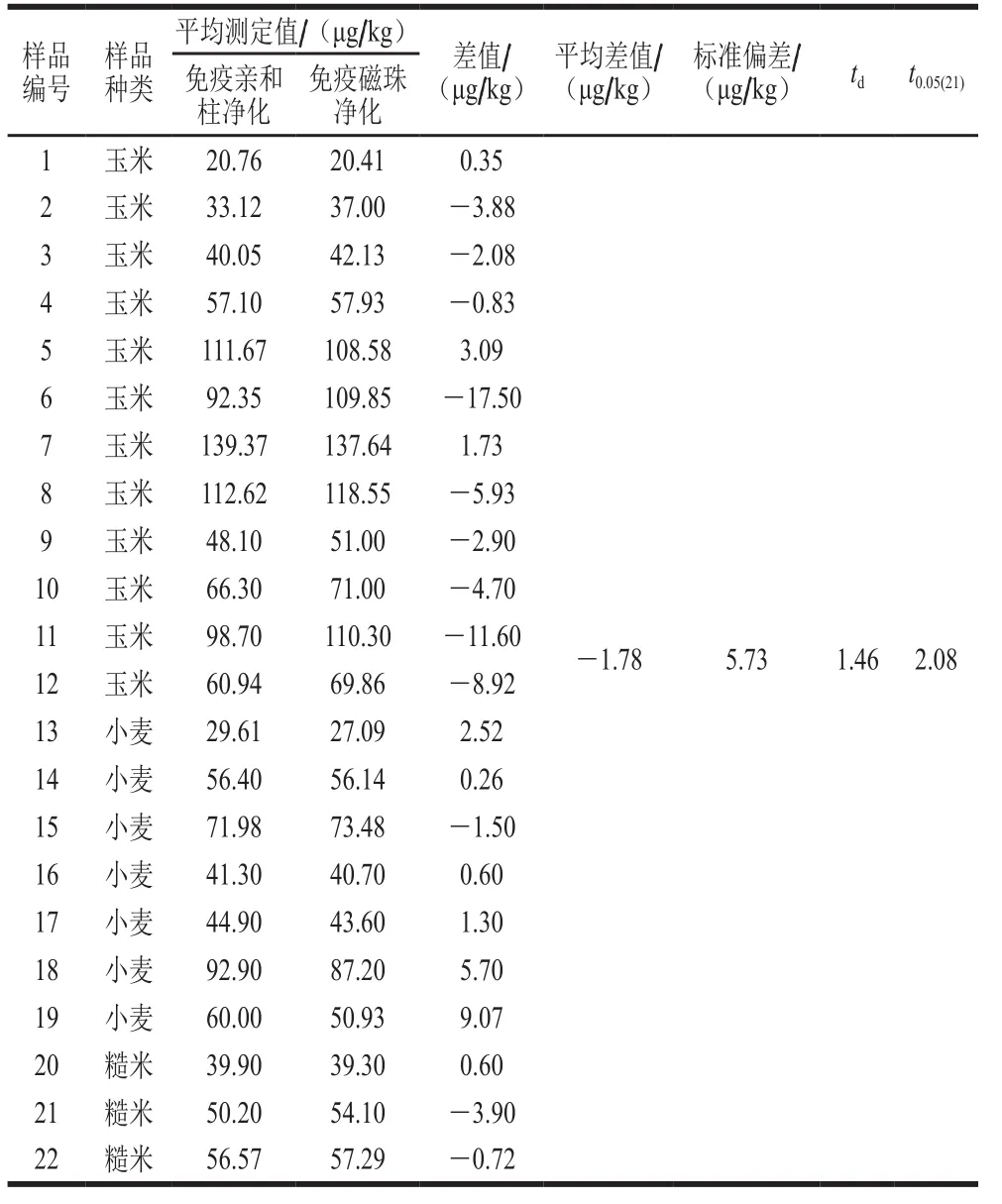
表4 免疫亲和柱和免疫磁珠净化测定结果(n=2)Table 4 Results of zearalenone determination in freshly harvested wheat, corn and brown rice samples by purification using immunoaffinitycolumn and immunomagnetic beads (n = 2)
采用Bland-Altman法对2 种净化方法之间的差异进行分析,结果如图6所示,免疫磁珠净化方法与免疫亲和柱法效果一致[27-29]。有4.5%(1/22)的点在95%一致性界限之外。在一致性界限范围以内,免疫亲和柱净化法和免疫磁珠净化法的测定值相比,差值的绝对值最大为17.5 μg/kg,差值平均值为-1.8 μg/kg。这2 种净化方法的差异在可接受范围内,因此可以认为这2 种方法的净化效果具有较好的一致性,在净化和富集粮食中玉米赤霉烯酮时,可以互相代替使用。另外,使用免疫磁珠净化粮食中玉米赤霉烯酮的成本更低,每个样品检测成本约是免疫亲和柱法的二分之一。
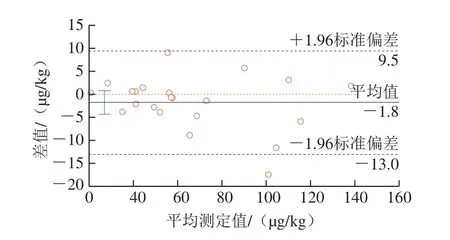
图6 2种净化方法Bland-Altman差值法分析图Fig.6 Bland-Altman plot showing good agreement between two purification methods
3 结 论
本研究建立了粮食中玉米赤霉烯酮免疫磁珠高通量自动净化-UPLC的检测方法,并对全麦粉和玉米全粉阴性样品添加不同量的玉米赤霉烯酮,检测其加标回收率,同时使用国家有证标准物质和质控样品对本方法进行了验证。相比于目前广泛使用的免疫亲和柱净化方法,本方法具有操作简单、自动化、高通量和成本低等优点。采用配对t检验和Bland-Altman法分析,结果表明免疫磁珠净化与免疫亲和柱净化方法效果一致。UPLC分析方法的LOD、LOQ满足粮食中玉米赤霉烯酮日常检测需求。
免疫磁珠净化方法配套使用的真菌毒素全自动净化仪可同时净化10~24 个样品,平均每个样品的净化时间约为2~3 min,可有效减少对操作人员的操作要求,实现高通量、自动化提取粮食中玉米赤霉烯酮;UPLC分析方法的准确度和精密度较高,为高效检测粮食中玉米赤霉烯酮提供参考。

