铁及其化合物测试题
■中学生数理化试题研究中心
1.下列关于铁的氧化物叙述正确的是( )。
A.铁在氧气中充分燃烧,火星四射,生成铁的三种氧化物的混合物
B.铁锈的主要成分为Fe2O3,是一种油漆的原料
C.Fe3O4俗称磁性氧化铁,是磁铁矿的主要成分,是由FeO 与Fe2O3组成的混合物
D.Fe3O4与稀盐酸反应的离子方程式为Fe3O4+8H+Fe2++Fe3++4H2O
2.下列有关钢铁腐蚀与防护的说法正确的是( )。
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面钝化或钢材镀铝后,能防止钢铁腐蚀
C.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
D.在海轮外壳连接锌块保护外壳不受腐蚀是采用了外加电源的阴极保护法
3.把22.4g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.3 molNO2和0.2molNO,下列说法正确的是( )。
A.反应后生成的盐只有Fe(NO3)3
B.反应后生成的盐只有Fe(NO3)2
C.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1∶3
D.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为3∶1
4.证明某溶液中只含有Fe2+而不含Fe3+的实验方法是( )。
A.先滴加氯水,再滴加KSCN 溶液后显红色
B.先滴加KSCN 溶液,不显红色,再滴加氯水后显红色
C.滴加NaOH 溶液,先产生白色沉淀,后变灰色,最后呈红褐色
D.只 需 滴 加KSCN 溶 液
5.用FeCl3溶液腐蚀印刷电路板上的铜,向所得的溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是( )。
A.若无固体剩余,则溶液中一定有Fe3+
B.若有固体存在,则溶液中一定有Fe2+
C.若溶液中有Cu2+,则一定没有固体析出
D.若溶液中有Fe2+,则一定有Cu析出
6.mgFe、Fe3O4、Fe2O3的混合物用足量H2还原,固体质量减少4.8g;若将等质量的混合物加入足量稀硝酸中,产生标况下NO气体2.24L。mg该混合物中铁原子的物质的量为( )。
A.0.1mol B.0.2mol
C.0.3mol D.0.4mol
7.如图1 所示的钢铁腐蚀中,下列说法正确的是( )。

图1
A.碳表面发生氧化反应
B.钢铁被腐蚀的最终产物为FeO
C.生活中钢铁制品的腐蚀以图①所示为主
D.图②中,正极反应式为O2+4e-+2H2O4OH-
8.为了除去FeCl3溶液中混有的少量FeCl2,其方法是向此溶液中( )。
A.加入Fe粉 B.加入Cu
C.滴加氯水 D.滴加稀硝酸
9.等质量的下列物质与足量稀硝酸反应,放出NO 物质的量最多的是( )。
A.FeO B.Fe2O3
C.FeSO4D.Fe3O4
10.将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+溶度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )。
A.2∶3 B.3∶2
C.1∶2 D.1∶1
11.某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a,将其全部投入50mLbmol·L-1的硝酸溶液中,加热使其充分反应(假设NO 是唯一的还原产物)。下列说法正确的是( )。
A.若金属有剩余,再向溶液中滴入硫酸,金属不会溶解
B.若金属全部溶解,则溶液中一定含有Fe3+
C.若金属全部溶解,且产生336mL气体(标准状况),则b=0.3

12.工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10 分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____。
(2)另称取铁钉6.0g放入15.0mL 浓硫酸中,加热,充分反应后得到溶液X 并收集到气体Y。
某同学认为X 中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,应选用____(填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
13.硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下。
步骤1:将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2:向处理过的铁屑中加入过量的3mol·L-1H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3:向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有_____(填仪器编号)。
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研钵 ⑥玻璃棒 ⑦酒精灯
(2)在步骤2中所加的硫酸必须过量,其原因是_____。
(3)在步骤3 中,“一系列操作”依次为_____、____和过滤。
(4)本实验制备的硫酸亚铁铵晶体常含有Fe3+杂质。检验Fe3+常用的试剂是_____,可以观察到的现象是____。
14.铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水,但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
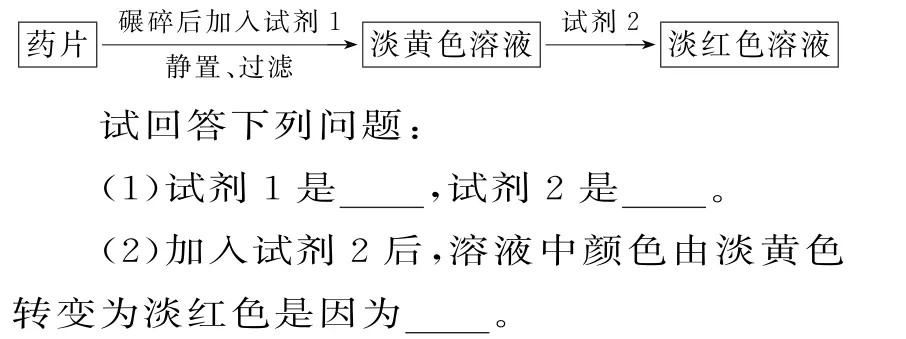
参考答案
1.B 2.B 3.C 4.B 5.B 6.C 7.D 8.C 9.A 10.A 11.D
12.(1)铁钉表面被钝化 (2)d 13.(1)②④⑤ (2)使铁全部溶解并防止Fe2+水解 (3)加热浓缩 冷却结晶(4)KSCN溶液 溶液变红色
14.(1)稀盐酸 KSCN 溶液 (2)少量的Fe2+转化为Fe3+

