戈舍瑞林联合腹腔镜治疗卵巢型子宫内膜异位症的临床价值
李祖萍 罗兢蓉
子宫内膜异位症好发于育龄期妇女,是临床上导致不孕、月经紊乱以及痛经的主要疾病[1]。卵巢型子宫内膜异位症则属于相对常见类型,被认为是引起不孕症的独立危险因素[2]。以往针对卵巢型子宫内膜异位症治疗多以腹腔镜下手术切除为主,但该治疗方法仅对肉眼可见病灶进行清查,对于微小尤其是肉眼无法企及者,难以达到治疗目的,且术后可能出现的盆腔黏连而影响术后妊娠率[3]。以往研究[4]已经证实,子宫内膜在月经周期中的生理变化与卵巢分泌的相关激素之间存在相关性,主要受雌激素所调控。戈舍瑞林具有促进黄体生成素释放的作用,长时间使用对调节垂体功能,抑制黄体生成激素生成、降低雌激素对子宫内膜异位症病灶的刺激作用有一定价值,进而对控制疾病严重程度,预防疾病再发有积极意义。为此本研究主要探讨腹腔镜手术后应用戈舍瑞林治疗的临床价值,现报告如下:
1 资料与方法
1.1 一般资料
选择2018年4月—2019年10月本院收治的卵巢型子宫内膜异位症患者80例为研究对象,入组前签署同意书并申报医院伦理委员会批准。纳入标准:已婚、合并不孕症、临床表现存在月经不规则和闭经、长期慢性腹痛。排除标准:合并恶性肿瘤病变、合并精神疾病、既往型卵巢相关手术、入组前30 d使用激素治疗、拒绝手术治疗、对拟定应用药物过敏等。按照随机数字表法分为两组,各40例。观察组:年龄25~38岁,平均(28.1±2.5)岁,子宫内膜异位症病程1~8年,平均(5.5±0.4)年,不孕时间2~13年,平均(5.1±0.4)年;对照组:年龄26~40岁,平均(28.5±2.6)岁,子宫内膜异位症病程1~7年,平均(5.6±0.5)年,不孕时间2~12年,平均(5.0±0.5)年。两组年龄、病程、不孕时间等一般资料比较差异无统计学意义(P>0.05)。
1.2 方法
对照组在全身麻醉下实施腹腔镜手术干预,手术时机为月经周期干净后5 d,以脐缘下弧形切口及双侧麦氏点建立人工气腹,于腹腔镜下彻底清除肉眼可见子宫内膜异位症病灶,并对存在的腹腔、盆腔黏连进行充分松解,随后应用穿刺吸引器对卵巢囊肿中囊液行负压抽吸并彻底剥离卵巢囊肿囊壁。针对合并输卵管阻塞则同期行输卵管疏通治疗;观察组则于对照组基础上给予戈舍瑞林(阿斯利康公司,批准文号H20100314,批号201803052,3.6 mg/支),给药时机为术后7 d,腹壁皮下注射给药,每次3.6 mg,每间隔4周给药1次,连续给药3次为1治疗周期。
1.3 观察指标
比较两组干预前后抗苗勒管激素水平,比较两组干预后卵巢超声指标,分析随访期间疼痛NRS评分[5]变化情况,随访1年,比较两组受孕情况。
1.4 评定标准
抗苗勒管激素(AMH,酶联免疫吸附法,成年人正常参考值2.0~6.8 μg/mL);卵巢超声指标包括排卵期窦卵泡数(average antral follicle count,AFC)、卵巢基质动脉搏动指数(pulsatility index,PI)和卵巢动脉阻力指数(resistance index,RI);疼痛评分通过疼痛数字评分进行评估,总分最高10分为最剧烈疼痛,最低0分为无痛。
1.5 统计学处理
使用SPSS 20.0进行,计量资料以(x-±s)表示,两组间均数的比较使用t检验,计数资料表示为(n,%),比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组干预前后抗苗勒管激素水平比较
干预前两组抗苗勒管激素水平比较差异无统计学意义(P>0.05),干预1年后,两组抗苗勒管激素水平均显著高于干预前(P<0.0 5),且观察组抗苗勒管激素水平高于对照组(P<0.05)。见表1。
2.2 两组干预前后卵巢超声指标比较
干预1年后,观察组卵巢超声指标中AFC水平高于对照组(P<0.05),PI和RI均显著小于对照组(P<0.05)。见表2。
2.3 随访期间疼痛NRS评分变化情况
干预前两组疼痛NRS评分比较差异无统计学意义(P>0.05),干预3个月后和干预1年后,两组疼痛NRS评分均低于干预前(P<0.05),且干预3个月后和干预1年后,观察组疼痛NRS评分低于对照组(P<0.05)。见表3。
2.4 两组干预1年后受孕情况比较
观察组自然受孕例数为30例(75.0%),对照组自然受孕例数为21例(52.5%),观察组自然受孕比例显著高于对照组(χ2=4.381,P=0.036<0.05)。
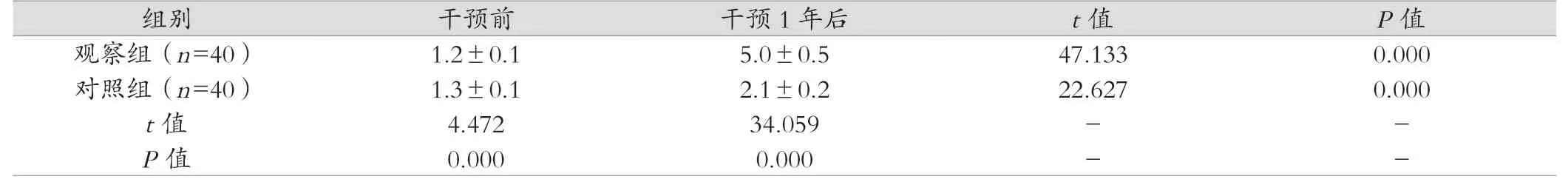
表1 两组干预前后抗苗勒管激素水平比较(x- ±s)
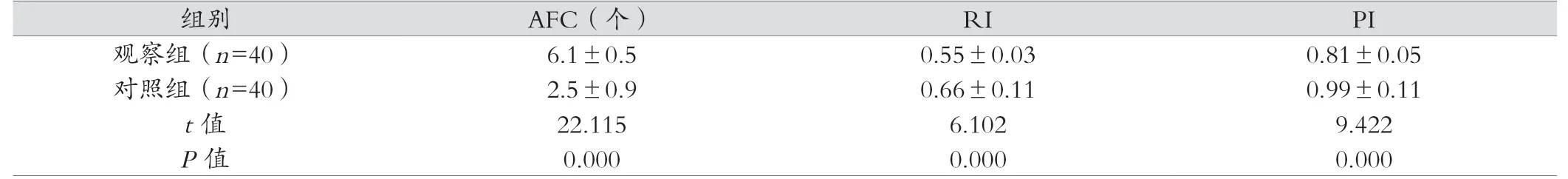
表2 两组干预后卵巢超声指标比较(x- ±s)
表3 随访期间疼痛NRS评分变化情况(分, ±s)

表3 随访期间疼痛NRS评分变化情况(分, ±s)
组别 干预前 干预3个月后 干预1年后观察组(n=40) 5.2±0.3 2.3±0.2 1.1±0.1对照组(n=40) 5.3±0.3 3.5±0.3 3.1±0.2 t值 1.491 21.049 56.569 P值 0.140 0.000 0.000
3 讨论
子宫内膜异位症为妇科较为常见疾病,当前治疗多以腹腔镜下微创手术干预为主[6]。其具有手术出血少、创伤小、术后恢复快等优点,还可同期进行腹腔、盆腔黏连松解,在显著缓解患者疼痛改善月经周期同时,还能针对不孕原因进行处理[7]。以往研究提示[8],异位的子宫内膜主要是因卵巢分泌激素的异常所致,常导致腹、盆腔的纤维组织增生、黏连等,随着病程的延长而形成实质性瘢痕和(或)囊肿,生物学特征有一定的浸润与增生性生长特征。对于卵巢型子宫内膜异位症者其盆腔黏连相对严重,病灶组织与周围正常组织存在分界不清,单纯腹腔镜手术清除难以对病灶进行彻底清除,术后易复发,如手术强行分离则可能加重肠黏连与盆腔黏连发生[9]。戈舍瑞林为人工合成促黄体生成素类药物,具有半衰期长,给药后维持时间长等优点,皮下注射后能长时间释放激素类似物,进而提高体内黄体生成激素的水平,抑制雌激素功能,已广泛应用于体内激素分泌异常相关疾病的治疗[10]。
本研究针对卵巢型子宫内膜异位症,观察组在对照组实施腹腔镜手术治疗基础上,皮下注射戈舍瑞林,比较两组干预前后抗苗勒管激素水平发现,干预1年后观察组抗苗勒管激素水平高于对照组。说明针对卵巢型子宫内膜异位症,在实施腹腔镜手术治疗后规律应用戈舍瑞林,能更有效的调节抗苗勒管激素水平,促进机体正常内分泌功能的建立。另外比较两组干预前后卵巢超声指标发现,干预1年后观察组卵巢超声指标中AFC水平高于对照组,PI和RI均显著小于对照组。说明卵巢型子宫内膜异位症,在实施腹腔镜手术治疗后规律应用戈舍瑞林,对促进卵巢功能的恢复有积极意义。同时统计随访期间疼痛NRS评分变化情况发现,干预后3个月和干预后1年,观察组疼痛NRS评分低于对照组。说明针对卵巢型子宫内膜异位症,在实施腹腔镜手术治疗后规律应用戈舍瑞林,能有效的缓解患者疼痛,改善其临床症状。最后统计两组干预1年后受孕情况发现,观察组自然受孕比例显著高于对照组。说明卵巢型子宫内膜异位症,在实施腹腔镜手术治疗后规律应用戈舍瑞林,对促进自然分娩有重要价值。
本研究观察组使用的戈舍瑞林,为人工合成的促黄体生成素释放激素类似物,具有调节卵巢激素水平,抑制雌激素分泌,延长子宫内膜异位症患者子宫内膜组织长时间休眠的作用[11]。联合腹腔镜治疗卵巢型子宫内膜异位症,可有效的抑制垂体合成黄体生成素和卵泡生成素水平[12],进而抑制卵巢分泌雌激素[13],促进异位子宫内膜萎缩并退化[14],对于腹腔镜手术后无法肉眼所及病灶进行有效的治疗,进而降低术后复发率[15]。同时皮下注射戈舍瑞林其生物利用度较高,半衰期长,一般推荐每间隔28 d皮下注射1次,在确保血药浓度同时比较药物蓄积[16-19]。
综上所述:针对卵巢型子宫内膜异位症,应用戈舍瑞林联合腹腔镜治疗,能有效的调节卵巢功能,缓解疼痛症状,提高自然妊娠几率。

