红豆杉提取物维康醇对膀胱癌T24细胞增殖抑制的实验研究
刘宏伟 左 玲 柳建军 许志坚 桂志明
1.广东医科大学附属医院泌尿外科,广东 湛江524001;2.广东医科大学附属第二医院中医科,广东 湛江 524003
红豆杉又名紫杉、赤柏松。辛、甘,大温,归胃、肝经。红豆杉的根、茎、叶都可以入药,具有利尿消肿、通经止痛的作用。《本草纲目》记载红豆杉具有治疗伤寒、霍乱、排毒等功效。红豆杉是世界上公认的濒临灭绝的天然珍稀抗癌中药,具有解毒散结之疗效,在1992年被FDA批准用于治疗晚期肺癌、卵巢癌、子宫癌等[1]。药理研究[2]表明红豆杉具有诱导癌细胞凋亡、抑制肿瘤细胞增殖和转移、抑制血管生成、影响癌细胞代谢周期、逆转肿瘤多耐药性等抗癌药理作用,其提取物紫杉醇对晚期乳腺癌、卵巢癌、消化道肿瘤、非小细胞肺癌等有明显疗效,总有效率高达75%以上,对膀胱癌也有较好的疗效[3-5]。维康醇(Alteronol)是从云南红豆杉树皮中分离提取出微生物菌诱变株,对其菌丝体进行特殊发酵、纯化而获取的一种新型单体化合物,其分子式为C20H14O6,分子量为350.3,是维泰醇(Alternol,C20H16O6,分子量为352.3)的同型异构体[6],与临床上常用抗肿瘤药物紫杉醇的来源相同[7]。
研究[6,8]表明维泰醇类化合物能够抑制多种肿瘤细胞的增殖,但对维康醇的研究不多。维康醇不仅可以抑制白血病HL-60细胞[9]、肝癌细胞[10]的增殖,而且可以诱导肺癌及前列腺癌细胞的凋亡[11-12]。目前维康醇对膀胱癌细胞的作用未明,本研究拟探讨维康醇对膀胱癌细胞增殖、周期的影响及可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 细胞 人膀胱癌T24细胞购自中国科学院上海细胞库。
1.1.2 药物、试剂及仪器 维康醇(汕头市双骏生物科技有限公司);RPMI-1640培养基、胎牛血清购自Gibco公司;青霉素/链霉素、MTS、Propidium Iodide、RNase A购自Sigma公司;细胞培养箱购自BINDER公司;SPARK 10 M酶标仪(TECAN公司);流式细胞仪(美国BD公司);QuantstudioTMDX system实时荧光定量 PCR仪(Applied Biosystems公司)。
1.2 方法
1.2.1 细胞培养 用含10%胎牛血清、1%青霉素/链霉素的RPMI-1640培养液将T24细胞制备成细胞悬液,置于37 ℃、含5% CO2的细胞培养箱中进行培养,每1~2天换液,取对数生长期细胞用于实验研究。
1.2.2 MTS法检测维康醇对T24细胞增殖的影响将T24细胞铺于24孔板,24 h后分别用不同浓度的维康醇(4、8、12、16 μmol/L)进行处理,对照组用等体积RPMI-1640培养基替代,48 h后收集上述五组细胞,重悬细胞并计数,以1×103个/孔接种于 96 孔板中,每个孔 200 μL,放在37 ℃、5% CO2的细胞培养箱培养24 h,然后向每个孔加入 20 μL MTS 溶液,置于细胞培养箱中孵育 2 h,选取 492 nm 波长,在酶标仪上测定OD值,重复三次,计算细胞增殖抑制率。细胞增殖抑制率=(Atreat-Ablank)/(Acontrol-Ablank)×100%。
1.2.3 流式细胞术检测细胞周期 收集经维康醇处理24 h后的T24细胞于离心管中,离心去培养液,加入3 mL预冷的70%乙醇,用枪头吹打使细胞分散,置于4 ℃冰箱过夜,然后离心去乙醇,用PBS洗涤2次,加入0.05 mg/mL的Propidium Iodide和0.5 mg/mL的RNase A,避光下染色 30 min,上流式细胞仪检测细胞周期比例。
1.2.4 实施荧光定量PCR 收集经维康醇不同处理组的T24细胞,RNAiso提取总RNA,按照逆转录试剂盒说明书进行逆转录反应,37 ℃ 15 min,85 ℃ 5 s,4 ℃保存。将cDNA稀释10倍,按 10 uL 反应体系采用两步法进行PCR扩增。所用引物如下:CyclinD1-F:GCATGTTCGTGGCCTCTAAG,CyclinD1-R:CGTGTTTGCGGATGATCTGT;CDK4-F: AGTGTGAGAGTCCCCAATGG;CDK4-R: CCTTGATCTCCCGGTCAGTT;p21-F: TGCCCAAGCTC TACCTTC C,p21-R: CAGGTCCACATGGTCTTCCT;GAPDH-F:GGAGCGAGATCCCT CCAAAAT;GAPDH-R:GGCTGTTGTCATACTTCTCATGG。反应条件:95 ℃变性15 s,60 ℃退火/延伸40 s,共40个循环。采用2-ΔΔCt统计分析。
1.2.5 Western blot 用12 μmol/L的维康醇孵育T24细胞,48 h后弃培养基,PBS清洗一次,加入RIPA裂解液,收集对照组和处理组蛋白,BCA法测定蛋白浓度,按比例加入loadingbuffer,98 ℃ 5 min 进行蛋白变性。每孔加入30 μg蛋白进行电泳,浓缩胶设置80 V,分离胶设定100 V,电泳 90 min。然后采用PVDF膜进行转膜,250 mA,2 h。5%脱脂奶粉封闭1 h,分别孵育Cyclin D1、CDK4、p21兔多克隆抗体(1∶1000,proteintech公司)及GAPDH鼠单克隆抗体(1∶10000,ABclonal公司),4 ℃过夜。TBST洗膜,室温下孵育二抗1 h,洗膜后加入化学发光液曝光拍照。

2 结果
2.1 维康醇呈浓度依赖性抑制膀胱癌细胞增殖 以不同浓度的维康醇(4、8、12、16 μmol/L)处理膀胱癌T24细胞48 h,细胞增殖抑制率逐渐增加,分别为9.33%、16.26%、50.56%和61.03%。不同浓度维康醇组OD值与对照组相比,差异均具有统计学意义。见表1。

表1 不同浓度维康醇对膀胱癌T24细胞增殖的影响
2.2 维康醇呈时间依赖性抑制膀胱癌细胞增殖 以12 μmol/L的维康醇作用于膀胱癌T24细胞,分别作用24、48、72、96 h,MTS结果显示随着时间的延长,维康醇对T24细胞的抑制率逐渐增加,维康醇处理96 h后,细胞的抑制率达74.30%,说明维康醇抑制T24细胞增殖存在时间依赖性。见表2。
2.3 维康醇对膀胱癌细胞周期及相关蛋白的影响 流式细胞术测定细胞周期结果显示,当以12 μmol/L的维康醇处理T24细胞24 h后,G1期比例由38.77%升至52.01%,S期比例由47.30%降至38.11%,G2期比例稍有下降(图1A),进一步对周期相关蛋白基因进行qRT-PCR和western blot检测,结果显示,与对照组相比,维康醇作用的T24细胞中CDK4和Cyclin D1的mRNA和蛋白水平显著降低,p21的mRNA和蛋白水平明显上调(图1B、1C)。

表2 不同作用时间维康醇对膀胱癌T24细胞增殖的影响
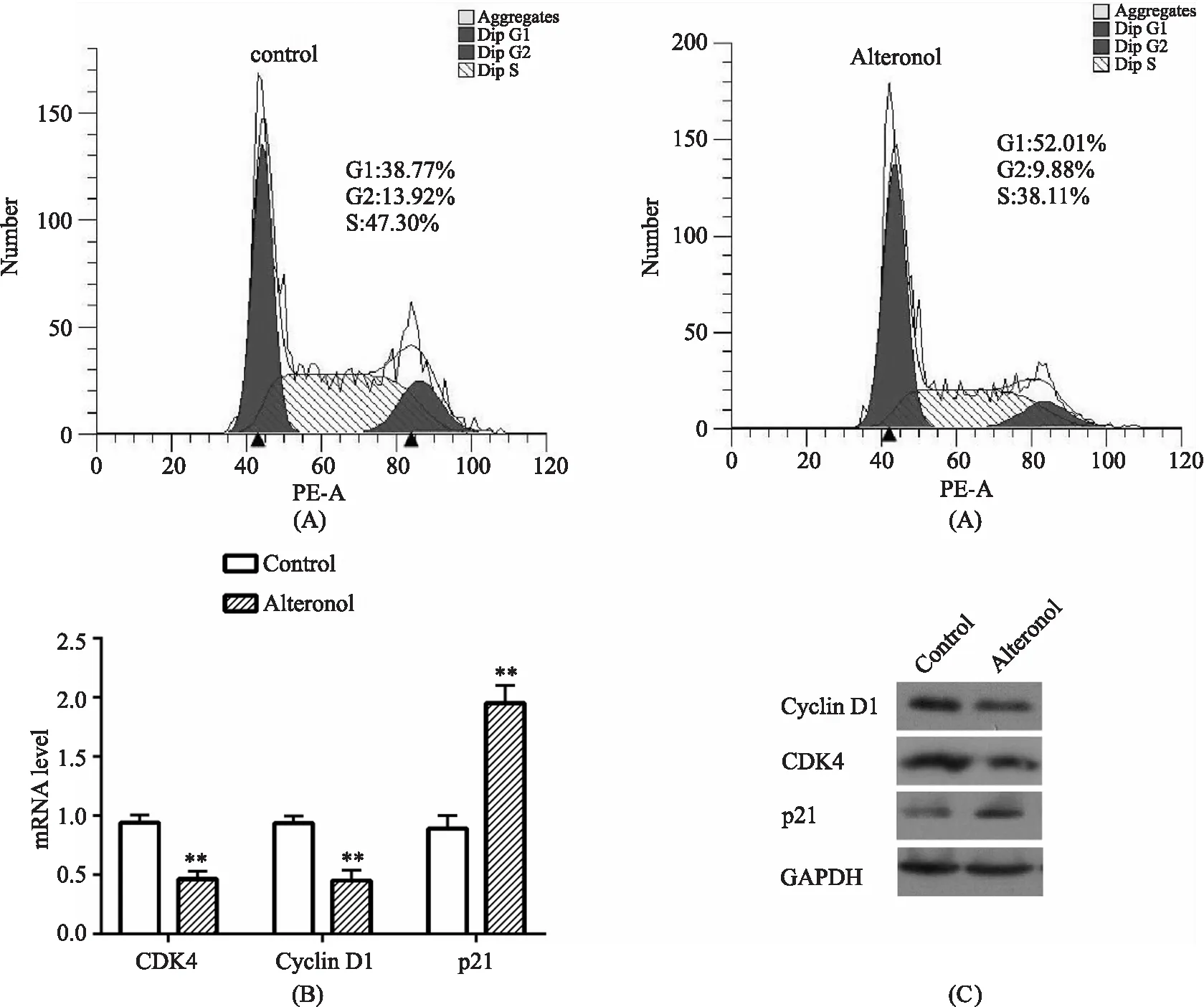
A.维康醇处理T24后细胞周期改变;B.维康醇处理T24后Cyclin D1、CDK4、p21 mRNA 水平变化(**P<0.01);C.维康醇处理T24后Cyclin D1、CDK4、p21 蛋白水平变化图1 维康醇对细胞周期及周期蛋白表达水平的影响
3 讨论
维康醇是从云南昆明红豆杉树皮中提取、合成的一种新型单体化合物。研究[13]表明,维康醇可通过引起细胞周期阻滞、抑制细胞增殖、诱导细胞凋亡等发挥其抗癌作用。如维康醇可能通过线粒体调控的内源通路诱导肺癌A549细胞的凋亡[11],通过下调细胞周期蛋白CyclinD1和细胞周期蛋白依赖性激酶的底物磷酸化的Rb蛋白表达抑制白血病HL-60的增殖[9]。维康醇还可以抑制Akt/mTOR和TGFβ/Smad3通路,与自噬抑制剂3-MA联合应用不仅能显著抑制黑色素瘤的生长,而且能抑制肿瘤的侵袭和迁移[14]。维康醇和阿霉素联合应用可显著抑制乳腺癌4T1细胞周期相关蛋白CDC2和Cyclin B1的表达水平[15],诱导细胞周期阻滞于G2/M期,从而抑制细胞增殖[16]。维康醇诱导前列腺癌细胞死亡的方式主要为时间依赖性的晚期凋亡,其效果优于传统化疗药物伊立替康(CPT-11)、多西他赛及紫杉醇[12]。本研究采用不同浓度的维康醇干预膀胱癌T24细胞,结果表明维康醇显著抑制细胞增殖,存在时间和剂量依赖性,说明维康醇亦对膀胱癌发挥一定的抗癌作用。
G1/S期和G2/M期是细胞周期的两个关键限制点,其中G1/S期在启动细胞周期过程中发挥关键作用。为了探讨维康醇抑制膀胱癌增殖的作用机制,进一步检测了其对细胞周期的影响,结果显示维康醇处理后T24细胞的G1期比例明显增加,S期比例明显下降,与既往研究结果一致。刘亮亮等[9]研究发现以1.6 μg/mL维康醇孵育白血病HL-60细胞24 h后,细胞的G1期比例由34.9%增加至53.0%,S期比例由54.4%减少至32.9%。在G1/S限制点,CyclinD1、CyclinE分别与CDK4、CDK2形成激酶复合物,促进细胞周期G1/S转化,促进细胞异常增殖、恶变。HeLa细胞经维康醇处理后,Cyclin D1和CDK4蛋白水平显著下降[17]。本研究同样表明,维康醇处理膀胱癌细胞24 h后 Cyclin D1和CDK4表达明显下调,p21表达上调,说明维康醇可能通过下调Cyclin D1和CDK4表达,上调p21表达,使T24细胞在G1期受阻,进而抑制膀胱癌细胞的增殖。
诱导细胞凋亡是抗肿瘤药物研发的作用机制之一,目前研究报道大多数肿瘤细胞经维康醇处理后出现了凋亡现象,如30 μmol/L维康醇作用于HepG2细胞48 h后,细胞凋亡率显著升高[10]。唐宇哲等通过维康醇孵育前列腺癌PC3细胞12 h,PC3晚期细胞凋亡率达14.8%±1.2%,明显高于正常前列腺细胞株BPH1的6.8%±1.1%[12],但经维康醇处理的前列腺癌细胞株DU145和白血病HL-60的凋亡比例较低,均低于10%[9, 12]。维康醇是否也诱导膀胱癌细胞凋亡有待进一步研究。
综上所述,维康醇能够抑制膀胱癌T24细胞的增殖,其可能与下调Cyclin D1和CDK4表达,上调p21表达,导致细胞G1期阻滞有关,但其深入机制有待后续进一步研究。

