基于P38 MAPK信号通路探讨艾灸督脉对APP/PS1双转基因AD小鼠自噬水平的研究*
吴洋洋,朱才丰,宋小鸽,王 玲,王雪伟,葛宏慧,贾玉梅
(1.安徽中医药大学,安徽 合肥 230038;2.安徽中医药大学第二附属医院,安徽 合肥 230061;3.安徽中医药大学针灸经络研究所,安徽 合肥 230038)
随着当前中国经济水平的提高,人口老龄化问题越来越显著,阿尔茨海默病(Alzheimer’s disease,AD)即老年痴呆,是中枢神经系统中常见的退行性疾病,主要症状为认知和记忆功能减退,伴有或者不伴有行为障碍和精神症状,继恶性肿瘤和心脑血管疾病后的第三位重要慢性非传染性疾病,并严重危害人类生活和健康[1]。有报告显示[2-3],中国标化痴呆患病率2014年比2011年增长6.39%,而全球约有3 650万患者(中国约600万),且后期将超过2 000万。因此,AD危害患者身心健康并给家庭的生活带来压力。目前没有具体药物或者其他非药物方法可以治愈AD,其病理生理机制较为复杂,主要是淀粉样蛋白(Amyloid β-peptide,Aβ)毒性[4]和tau蛋白异常学说[5]。Aβ毒性形成的斑块(Aβ plaques,Aβs)可使大脑神经元丢失,这与Aβ1-42的沉积物密切相关,AD患者有认知和学习记忆障碍[6]。经发现[7],自噬对机体异常沉积的蛋白有降解和清除的作用,细胞自噬也可降解Aβ1-42的沉积物。
经前期课题研究表明[8-10],艾灸“百会”“大椎”“风府”穴对早期AD认知(轻度)障碍有较好的临床治疗效果,同时艾灸督脉加速细胞自噬并清除Aβ1-42蛋白异常沉积。那么,艾灸督脉“百会”“大椎”“风府”穴治疗AD的作用机制是否与激活信号通路清除Aβ聚集相关?本研究通过观察艾灸督脉对APPswe/PS1de9(APP/PS1)双转基因AD小鼠脑区Aβ1-42 蛋白表达,发现加速细胞自噬的作用机制可能与抑制P38 MAPK(Mitogen-activated protein kinase,MAPK)信号通路的异常激活有关。
1 材料与方法
1.1 实验动物与分组
1.1.1 实验动物 本实验选用雄性APP/PS1双转基因AD小鼠和同龄同条件雄性野鼠型C57BL/6J小鼠,该小鼠源于第四军医大学实验动物中心[许可证:SCXK(军)2012-0007],体质量(36±4)g,SPF级。在安徽中医药大学科学实验中心清洁级动物房饲养,饲养1个月于昼夜明暗交替12 h/12 h,分笼喂养并保持恒定的湿度和温度。
1.1.2 实验分组 实验选取48只雄性APP/PS1双转基因AD小鼠并随机分为模型组、艾灸组、西药Ⅰ组和西药Ⅱ组,每组各12只;12只对照组为健康野生型雄性C57BL/6J小鼠。在实验过程中遵守科技部制定的《关于善待实验动物的指导性意见》,程序要遵守安徽中医药大学伦理委员会的规定,尽可能使所有动物避免不必要伤害和痛苦。
1.2 主要试剂与仪器
EPS300型电泳仪(意大利SCOTSMAN);VE-180型电泳槽、VE-186型转膜仪(上海民仪);高速台式冷冻离心机(安徽嘉文);亚光 YB-7B 石蜡包埋机(泰维);北京中杉DAB显色剂、ZLI-9062 PBS和EDTA抗原修复液(ZLI-9067);苏木素(BA-4021珠海贝索生物);RIPA 细胞裂解液;Western blot一抗二抗去除液;β-actin一抗;ZB-2301二抗辣根酶标记山羊抗兔IgG(H+L);DP-801形态学显微图像分析系统。
雷帕霉素、3-甲基腺嘌呤(3-MA,美国,货号:M9281,批号:124M4071V);βAmyloid 1-42(CT)抗体(上海博研);p38 MAPK单克隆抗体、磷酸化P38MAPK单克隆抗体(美国Cell Signaling);p38MAPK、Bcl-2及BCA蛋白浓度测定试剂盒(P0012S);PVDF 膜;超敏ECL发光试剂盒(美国);LeicaRM2135自动切片机(德国);高级荧光显微镜和Olympus BX51光学显微镜(日本 Olympus);JEM1230型透射电镜(日本)。
1.3 治疗方法
1.3.1 对照组、模型组 均饲养周期相同只在鼠板上固定不做处理。
1.3.2 艾灸组 操作前将APP/PS1双转基因AD小鼠(在清醒状态下)固定于鼠板上,参考《实验针灸学》[11]并按照小鼠骨骼与体型取“百会”“大椎”“风府”。实按灸“百会”,放置已制备好的附子饼(适量黄酒和附子粉按1:1比例调制,其直径2.0 cm、厚度 4~6 mm、每块10 g,最后用消毒针具刺数个小孔),点燃艾条将灸火直接实按于附子饼上反复灸20 min;清艾条采用雀啄灸法悬于“风府”“大椎”穴上方灸至20 min。
1.3.3 西药Ⅰ组 将自噬药物雷帕霉素腹腔注射到AD转基因小鼠来达到诱导自噬目的,2 mg·kg-1·d-1。
1.3.4 西药Ⅱ组 艾灸加腹腔注射抑制自噬药物3-MA(400 nmol/μL)1.5 mg·kg-1·d-1。
以上各组治疗均每天1次并持续2 周(每周休息 1 d)。
1.4 观察指标与检测方法
1.4.1 免疫组织化学法检测小鼠大脑皮质和海马区Aβ1-42蛋白表达 治疗后各组取5只小鼠腹腔注射麻醉0.3%戊巴比妥钠(30 mg/kg),固定手术台仰卧并暴露胸腹部,经常规消毒、开胸、心脏灌流、断头及冰盘上开颅取材。按照固定、脱水、透明、浸蜡和包埋流程,取小鼠大脑皮质和海马组织并制成石蜡块,使其连续冠状位切片(厚度4 μm),每组小鼠均切3~6张切片,通过免疫组化染色选取每张切片3~5个视野(在显微镜下),免疫阳性表达以棕黄色沉积物为主,测定阳性表达平均光密度是通过DP-801形态学显微图像分析系统。
1.4.2 透射电镜观察各组小鼠大脑海马区超微结构 治疗后各组取2只小鼠腹腔注射麻醉0.3%戊巴比妥钠(30 mg/kg),经断头、开颅取材分离数块海马组织,进行漂洗、锇酸固定、脱水和包埋后做超薄切片(厚度约60 nm),每组小鼠切3~6张切片,经双重染色后观察神经细胞结构、自噬体、自噬溶酶体及其形态,摄片后选取每张切片5个视野(以上均在电镜下完成)。
1.4.3 Western blot法检测各组小鼠海马区组织p38 MAPK、Bcl-2及Beclin-1蛋白表达 治疗后各组取5只小鼠腹腔注射麻醉0.3%戊巴比妥钠(30 mg/kg),经断头、开颅取材并于冰箱保存(-80 ℃)后取出海马组织,检测时加入RIPA裂解缓冲液经研磨均匀后在冰上静置30 min,取上层清液(4 ℃)下12 000 r/min离心15 min后提取组织总蛋白样品,蛋白浓度进行测定(BCA蛋白定量测定试剂盒)。5×SDS-PAGE蛋白上样缓冲液和蛋白样品(1∶4比例混合)于100 ℃水浴锅加热10 min使变为变性蛋白。SDS-PAGE电泳经转膜、5 min漂洗和2 h5%脱脂奶粉室温封闭处理,分别加相应抗体,4 ℃孵育过夜。洗膜后加二抗并室温2 h孵育,将其PVDF膜放于图像扫描仪上以显色液覆盖PVDF膜并避光配制显色液,使其反应1 min。经X线胶片显像并扫描。分析光片中条带灰度值(ImageJ软件)。
1.5 统计学处理
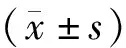
2 结果
2.1 各组小鼠大脑皮质和海马区Aβ1-42蛋白表达比较
模型组与对照组相比其小鼠脑部Aβ1-42蛋白表达阳性升高(P<0.05);艾灸组、西药Ⅰ组、西药Ⅱ组与模型组相比其小鼠脑部Aβ1-42蛋白表达阳性下降(P<0.05);西药Ⅰ组与艾灸组相比其小鼠脑部Aβ1-42蛋白表达差异无统计学意义(P>0.05),而西药Ⅱ组小鼠脑部Aβ1-42蛋白表达阳性增多(P<0.05);西药Ⅱ组与西药Ⅰ组相比其小鼠脑部Aβ1-42蛋白表达阳性也增多(P<0.05)。见图1、表1。
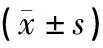
表1 各组小鼠皮质和海马区Aβ1-42蛋白表达比较

注:a为对照组,b为模型组,c为艾灸组,d为西药Ⅰ组,e为西药Ⅱ组。红色箭头表示免疫阳性表达。
2.2 各组小鼠大脑海马区超微结构比较
对照组见核膜完整、染色质结构清晰,细胞器、自噬泡以及溶酶体清晰排列。模型组海马区见神经元变形、萎缩或不规则,自噬泡减少,核膜结构模糊、染色质高度凝聚。艾灸组海马区有部分神经元变形、萎缩和不规则,自噬泡增多,细胞器丰富,核膜较光整。西药Ⅰ组自噬泡增多,神经元变形,核膜欠光整,染色质欠均匀。西药Ⅱ组偶见少量自噬泡和较多变形神经元,粗糙的细胞核膜且结构模糊。见图2。

注:柠檬酸铅、醋酸铀双重染色,红色箭头表示自噬泡,黑色箭头表示溶酶体。
2.3 各组小鼠海马区组织p38MAPK、Bcl-2及Beclin-1蛋白表达比较
模型组较对照组而言,其小鼠海马组织p38 MAPK、Bcl-2蛋白表达均显著升高(P<0.05),Beclin-1蛋白表达下降(P<0.05)。艾灸组、西药Ⅰ组、西药Ⅱ组分别与模型组相比,其小鼠p38MAPK、Bcl-2蛋白表达均明显下降(P<0.05),但Beclin-1蛋白表达上升(P<0.05)。西药Ⅰ组与艾灸组相比,其小鼠p38MAPK、Bcl-2蛋白表达微升高(P<0.05),而Beclin-1蛋白表达微下降(P<0.05);西药Ⅱ组与艾灸组相比,其小鼠p38MAPK、Bcl-2蛋白表达显著升高(P<0.05),而Beclin-1蛋白表达显著下降(P<0.05)。西药Ⅱ组与西药Ⅰ组相比,其小鼠p38MAPK、Bcl-2蛋白表达显著升高(P<0.05),Beclin-1蛋白表达显著下降(P<0.05)。见图3、表2。

注:a为对照组,b为模型组,c为艾灸组,d为西药Ⅰ组,e为西药Ⅱ组。
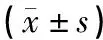
表2 各组小鼠海马组织p38MAPK、Bcl-2及Beclin-1蛋白表达检测结果
3 讨论
研究发现[12-13],Aβ聚集形成的老年斑是AD病理产物之一,以Aβ1-42清除机制异常较常见,使集聚有毒的Aβ诱发神经毒性。因此,抑制Aβ聚集是治疗AD主要因素。实验动物选用可靠的6月龄APP/PS1转基因AD小鼠模型,该过程中见大小不一、数量较多老年斑沉淀[14]。
本研究经透射电镜技术观察小鼠大脑海马区的超微结构发现,对照组见核膜光滑完整、清晰的细胞器、自噬泡以及溶酶体;模型组海马脑区见神经元变形、萎缩或不规则,自噬泡减少,染色体高度凝聚,即Aβ毒性可造成海马脑区神经元损伤;艾灸组和西药Ⅰ组小鼠海马脑区均见神经元变形、萎缩、不规则,自噬泡增多,即艾灸与药物雷帕霉素皆可诱导自噬;西药Ⅱ组小鼠海马脑区偶见少量自噬泡和较多变形神经元,核膜结构模糊,即艾灸增强自噬作用被3-甲基腺嘌呤所抑制。
双转基因AD小鼠脑组织有较多老年斑使Aβ异常聚集来激活补体,神经胶质细胞异常活化产生的毒性可致小鼠脑内细胞凋亡。经艾灸治疗后,艾灸可减少小鼠脑组织的老年斑明显减少,抑制异常活化神经细胞、减轻神经毒性和大脑神经元细胞凋亡。经雷帕霉素诱导自噬药物治疗后,其作用效果与艾灸一致,均可见小鼠脑组织老年斑减少。艾灸加雷帕霉素诱导自噬药物可减少双转基因AD小鼠脑部皮质和海马区老年斑的面积和减轻 Aβ毒性对神经元的损害,这可能与雷帕霉素增强细胞自噬作用相关;而艾灸加3-MA抑制自噬药物可增加双转基因AD小鼠脑部皮质和海马区老年斑的面积和Aβ沉淀明显聚集。
近年来,相关研究表明[15],P38 MAPK信号通路异常激活与神经细胞自噬有关,是AD发生的重要机制之一。本研究发现APP/PS1双转基因AD小鼠大脑海马区p38MAPK、Bcl-2蛋白表达上升,但Beclin-1蛋白表达下降,可见P38 MAPK信号通路失调与神经细胞自噬有关。经发现C-Jun氨基末端激酶(C-Jun N-terminal ki-nase,JNK)属于第3类丝裂原磷酸化蛋白激酶家族(Mitogen-activated protein kinase,MAPK)[16],能磷酸化Bcl-2 Ser70位点诱导Bcl-2与Beclin1复合物解离引起自噬激活,Beclin-1经过低亲和力结合Bcl-2/XL BH3结合沟相互作用影响自噬[17]。研究显示[18],AD患者脑组织中可见编码Beclin-1蛋白中基因含量减少,Beclin-1基因转录减少和蛋白表达丢失可使自噬水平及活性降低、自噬体形成的减少,致使Aβ蛋白异常沉积。抑制P38 MAPK通路可激活海马区自噬并降解细胞器减轻病理改变来保护脑组织[19]。
本课题通过抑制P38 MAPK通路使磷酸化Bcl-2激活自噬来调控自噬蛋白Beclin-1活性导致自噬体形成增多及Aβ蛋白异常沉积减少。艾灸督脉和雷帕霉素治疗后,可见小鼠大脑海马区p38MAPK、Bcl-2蛋白表达下降,而Beclin-1蛋白表达上升,说明自噬作用增强;而艾灸加3-MA抑制自噬药物治疗后见小鼠大脑海马区p38MAPK、Bcl-2蛋白表达升高,而Beclin-1蛋白表达下降,说明自噬被抑制。因此,艾灸加雷帕霉素抑制P38 MAPK通路以增强AD双转基因小鼠细胞自噬水平。
AD应属中医“痴呆”的范围,中医认为因年老体衰、禀赋不足导致神机失常、脑髓空虚和气血运行迟缓而发病[20]。本实验选取“百会”“大椎”和“风府”3穴,艾灸刺激督脉使经气传达脑内、振奋阳气、调节机体并达到开窍醒脑的功能。《本草纲目》曰:“脑为元神之府”[21],《灵枢·营气》曰:“上额,循巅,下项中,循脊入骶,是督脉也”[22],《素问·骨空论》曰:“督脉者,……;上额交巅上,入络脑,还出别下项”[23],表明病位在脑,而督脉与大脑密切相关。蔡圣朝教授是国家级名老中医,师承全国名老中医周楣声,蔡教授强调“神-脑-督脉-肾-任脉”轴,认为督脉上犯于脑,内联心、肾,并且相通于任脉,共同起元神之府作用[24]。2011年蔡教授首提“通脉温阳灸”[25-26](施灸部位:督脉大椎穴至腰俞穴及膀胱经)并坚持“温阳补肾”,肾虚为本,阳虚为根,痰瘀痹阻为标。
综上所述,细胞自噬异常途径与APP/PS1转基因AD小鼠脑区Aβ1-42 蛋白表达升高有关,艾灸督脉抑制P38 MAPK通路异常激活以增强自噬水平加速清除Aβ异常沉积,其机制可能与艾灸治疗AD有关。由于AD病理改变因素较为复杂,艾灸督脉是否对其他因素也有相同的治疗效果,其机制还需后期进一步研究。

