钙铝类水滑石超稳矿化Cd2+的动力学和热力学研究
刘 湉,张剑宇,张旭钏,陈 馨,陶然婷,雷晓东
(1. 北京化工大学 化工资源有效利用国家重点实验室,北京 100029;2. 江苏隆昌化工有限公司,江苏 南通 226532;3. 甘肃西部凹凸棒石应用研究院,甘肃 白银 730900)
Cd为强毒性重金属元素[1-2],释放到水体和土壤中难以被微生物降解,从而形成持久性污染[3-4]。因此,降低环境中Cd2+的毒性对人类健康具有重要意义[5-7]。
钙铝类水滑石(CaAl-LDH)是具有超分子插层结构的无机功能化合物,主体层板由Ca2+和Al3+组成,结构类似于水镁石,由金属氧键构成八面体共用棱边而生成主体层板[8-10],结构通式为,其 中,An-代表层间阴离子,可以采用钙盐为原料进行合成。层间存在多种客体组元,且具有可交换性,层板电荷呈正电性,结构中存在多种化学键[11-13],可以络合、矿化重金属离子;CaAl-LDH通过同晶取代去除Cd2+,生成硝酸根插层的LDH(Cd4Al2(OH)12(NO3)2·3H2O),为处理Cd污染废水提供了新的参考[10]。超稳矿化就是矿化剂可以通过同晶取代或共沉淀的方式将重金属离子锚定在晶格中,生成更加稳定的结构,使其难以游离。基于LDHs热力学稳定性的差异及离子半径匹配原则,可将Cd2+锚定在CaAl-LDH层板的晶格中形成了原位超稳矿化结构[14]。在Cd污染土壤的原位修复中,CaAl-LDH能快速降低土壤中Cd的生物有效性,解决常规钝化剂所面临的选择性低和易脱附导致的二次污染等问题,极具实用性[14],也为青海盐湖的优势钙盐资源高值化与大规模应用奠定了基础。解决了CaAl-LDH在重金属污染水体治理和土壤修复中的工程问题,因此,需深入了解该超稳矿化过程的动力学和热力学过程。
本工作通过水热法制备了硫酸根插层的钙铝水滑石(CaAl-SO4-LDH),采用XRD,FTIR,SEM,ICP-OES等方法对制备的CaAl-SO4-LDH进行表征,利用CaAl-SO4-LDH对水中Cd2+超稳矿化的动力学和热力学过程进行剖析,进一步确定CdAl-LDH的形成及超稳矿化过程快速、长效的原因。
1 实验部分
1.1 试剂
硝酸镉:分析纯,北京化工厂;氧化钙:分析纯,天津市福晨化学试剂厂;三铝水石:分析纯,万新威纳材料科技(山东)有限公司;硫酸钙:分析纯,国药集团化学试剂有限公司。
1.2 仪器
YZPR-100(M)微型高压反应釜:上海岩征仪器有限公司;HJ-6A型多头数显磁力搅拌器:上海振荣科学仪器有限公司;D8 Advance型X射线粉末衍射仪:日本岛津仪器公司;Vector 22 型红外光谱仪:德国布鲁克仪器公司;S-4700型扫描电子显微镜:日本日立公司;iCAP 7000型电感耦合等离子体发射光谱仪:赛默飞世尔科技(中国)有限公司。
1.3 CaAl-SO4-LDH的制备
采用水热法[15-16]制备CaAl-SO4-LDH:将氧化钙在温度为900 ℃的马弗炉内煅烧3 h并冷却,称取2.92 g加入到50 mL煮沸过的去离子水中,充分搅拌。再加入2.23 g的三铝水石和2.36 g的硫酸钙,然后倒入煮沸过的去离子水至混合液体积为100 mL,磁力搅拌10 min,使反应物混合均匀。将反应混合物加入到100 mL带搅拌的不锈钢反应釜中,设置搅拌速率为400 r/min,在120 ℃下反应10 h后,通入循环水进行冷却,冷却过程中继续搅拌至室温。反应结束后,将所得浆料在离心机中离心5 min,倒掉上层清液,固体部分于65 ℃的烘箱中干燥16 h,得白色固体,研磨所得粉末即为CaAl-SO4-LDH。
1.4 矿化动力学实验
配制质量浓度分别为50,100,150 mg/L的Cd(NO3)2溶液,量取50 mL的Cd2+溶液于50 mL锥形瓶中,加入10 mg 的CaAl-SO4-LDH,在室温、150 r/min搅拌速率下恒温振荡,每隔一段时间用2.5 mL的针管抽取一定量的上层清液并通过0.22 μm滤膜过滤,采用ICP-OES测定上层清液中Cd2+的含量。采用式(1)~(2)计算矿化过程中CaAl-SO4-LDH对Cd2+的去除率(Rc)和矿化容量(qe)。

1.5 超稳矿化热力学实验
配 制 质 量 浓 度 为100 mg/L的Cd(NO3)2溶液,量取50 mL Cd2+溶液于50 mL锥形瓶中,加入10 mg的CaAl-SO4-LDH于恒温振荡器中,设置25,35,45 ℃三个温度,在150 r/min搅拌速率下振荡3 h,用针管抽取一定量上层清液并采用0.22 μm滤膜过滤,采用ICP-OES测定上层清液中Cd2+的含量。
2 结果与讨论
2.1 CaAl-SO4-LDH表征结果
对制备的CaAl-SO4-LDH进行XRD,FTIR,SEM表征,结果见图1。从图1a可看出,CaAl-SO4-LDH在2θ=9.85°,19.82°,31.40°处出现了层状材料的特征衍射峰,与CaAl-SO4-LDH的标准图谱(JPCDS 50-1607)一致,表明所制备的材料为硫酸根插层的CaAl-LDH,且没有明显的杂质峰。从图1b可看出,在1 105 cm-1处出现了S—O的伸缩振动峰,表明层间阴离子为,和XRD表征结果一致。3 400~3 600 cm-1处的伸缩振动吸收峰归属于类水滑石层板上的羟基和层间水分子中的羟基,3 000 cm-1处的弱、尖吸收峰是层间水和阴离子的氢键作用[18]。水分子的弯曲振动出现在1 650 cm-1处。从图1c和d可以看出,CaAl-SO4-LDH呈现出规则的正六边形片状结构。
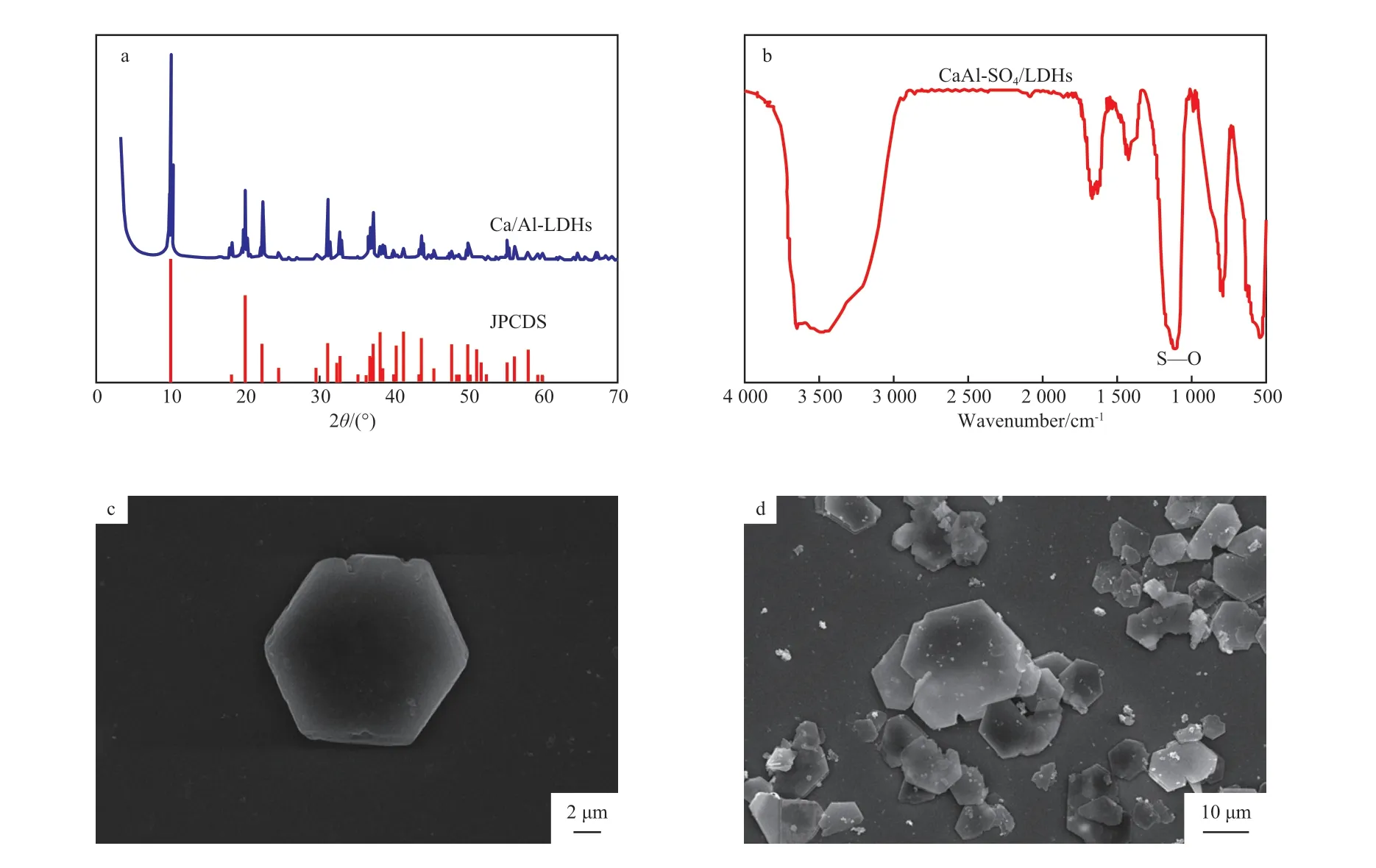
图1 CaAl-SO4-LDH的XRD谱图(a)、FTIR谱图(b)和SEM照片(c,d)Fig.1 XRD patterns(a),FTIR spectrum(b),SEM images(c,d) of CaAl-SO4-LDH.
ICP-OES测定试样中各元素的含量,其中,Ca含量为28.76 mg/L,Al含量8.442 mg/L,S含量为4.678 mg/L,Ca和Al的摩尔比为3.41∶1.00。
2.2 矿化动力学实验结果
采用动力学方程拟合可以反映出在超稳矿化过程中CaAl-SO4-LDH对Cd2+矿化速率的快慢。目前,最常用的动力学方程主要有准一级动力学方程和准二级动力学方程[19]。方程见式(3)~(4)。
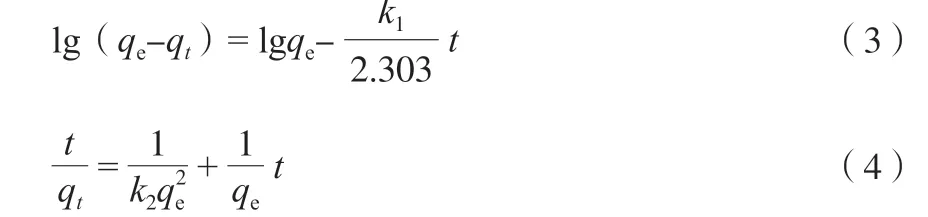
用准一级动力学方程和准二级动力学方程对不同初始质量浓度下的矿化动力学数据进行拟合,拟合结果见表1。
由表1可知,由准一级动力学模型拟合出的直线的相关系数均较低,拟合结果较差,矿化过程不符合准一级动力学模型。当Cd2+溶液的初始质量浓度分别为50,100,150 mg/L时,准二级动力学模型拟合出的直线的相关系数大于准一级动力学,分别为0.998 1,0.974 8,0.934 8,表明准二级动力学模型的拟合效果更好,更适于描述CaAl-SO4-LDH与Cd2+形成超稳矿化过程(SSMS)。当Cd2+溶液的初始质量浓度分别为50,100,150 mg/L时,由准二级动力学方程所得到的理论矿化容量分别为232.60,497.5,595.2 mg/L,与对应初始质量浓度下的实际矿化容量225.6,432.3,516.8 mg/L接近。因此,相较于准一级动力学模型,CaAl-SO4-LDH对Cd2+的超稳矿化过程更符合准二级动力学模型。表明在LDH层板上发生了同晶取代,Ca—O键断裂生成新的Cd—O键,该过程以化学作用力为主[20],能够快速进行,20 min内即可达到去除平衡,实现了对Cd2+的超稳矿化,且矿化性能和矿化容量要优于大部分矿化材料,如高岭土、凹凸棒等。
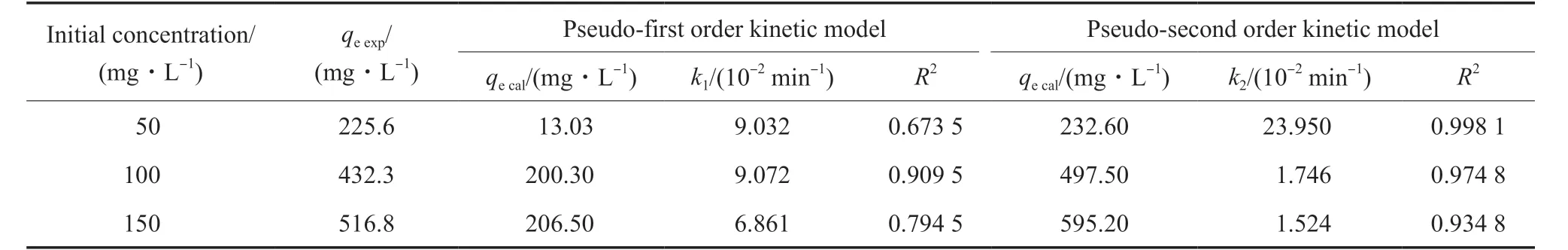
表1 准一级和准二级动力学模型参数Table 1 Parameters of pseudo-first order model and pseudo-second order model
动力学方程除了常见的准一级和准二级动力学模型外,还有另外一些常用的动力学模型[21-22]。为了更全面地探究CaAl-SO4-LDH对Cd2+的矿化过程,采用这些常见的动力学方程进行拟合,由于这些常见动力学模型拟合出的直线的相关系数均在0.36~0.72之间,均不能很好地描述CaAl-SO4-LDH与Cd2+形成SSMS的过程。
2.3 超稳矿化热力学
2.3.1 等温线
常见的等温线方程主要有Langmuir等温方程和Freundlich等温方程,分别描述了单层吸附和多层吸附过程[23],方程见式(5)和式(6)。

恒温下,矿化容量随着吸附质浓度的增大而增大。采用Langmuir和Freundlich等温模型对不同温度下CaAl-SO4-LDH矿化Cd2+的数据进行拟合,结果见表2。从表2可看出,采用Langmuir等温模型拟合出的不同温度下的相关系数分别为0.982 5,0.986 1,0.982 4,而采用Freundlich等温模型拟合出的相关系数分别为0.554 6,0.551 3,0.628 7,Langmuir等温模型的拟合结果要优于Freundlich等温模型,表明该SSMS过程更符合Langmuir等温模型[24],因此矿化过程是以单分子层主导的。经Langmuir等温吸附模型得出的理论矿化容量与实际矿化容量比较接近,在25,35,45 ℃三个温度下的最大矿化容量分别为483.1,531.9,534.8 mg/L,表明随着温度的升高,矿化容量也增加,说明温度是影响SSMS形成过程的一个重要因素。结合本团队前期工作[14],在该矿化过程中Cd2+取代了LDHs层板上的Ca2+,发生了旧化学键的断裂和新化学键的生成,属于优先型化学过程[25],通过同晶取代生成CdAl-LDH,实现了对Cd2+的超稳矿化。
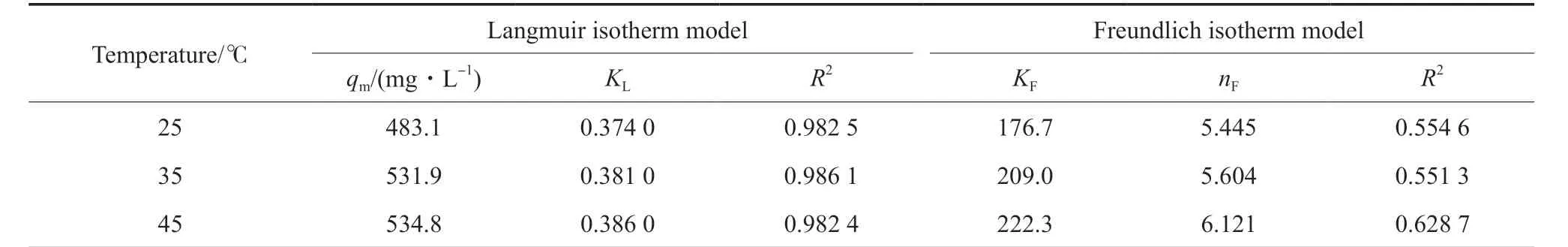
表2 Langmuir和Freundlich等温模型参数Table 2 Parameters of Langmuir and Freundlich isotherm model
2.3.2 超稳矿化热力学参数
通过计算热力学参数可以了解矿化过程的自发性[26-27],热力学函数见式(7)~(8)。CaAl-SO4-LDH对Cd2+的SSMS过程中吉布斯自由能、焓和熵的变化见表3。从表3可看出,不同温度下得到的吉布斯自由能分别为-36.33,-37.60,-38.85 kJ/mol,均小于0,且随温度的上升而下降,表明SSMS形成过程是一个自发过程。SSMS过程的焓变大于0,表明此过程为吸热过程。同时SSMS过程中熵为正值,表明为熵增过程,即自由度增加[28]。
表3 CaAl-SO4-LDH与Cd2+形成SSMS过程中吉布斯自由能、焓和熵的变化Table 3 Changes of Gibbs free energy(ΔG),enthalpy(ΔH ) and entropy(ΔS ) during the formation of ultra-stable mineralization process between CaAl-SO4-LDH and Cd2+
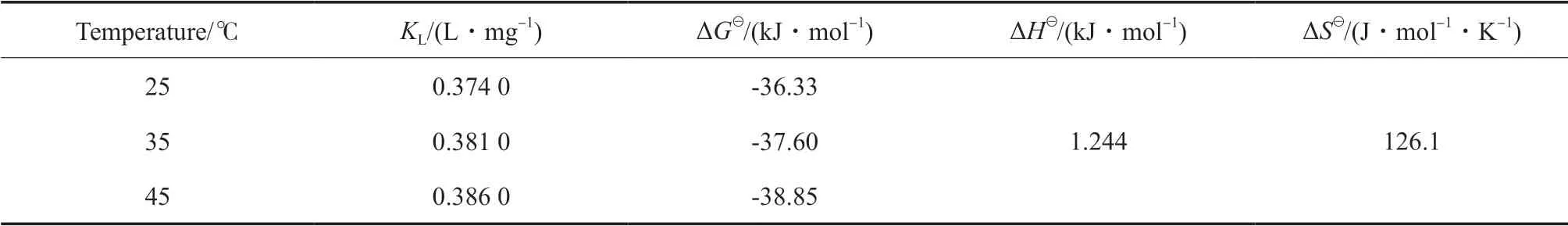
表3 CaAl-SO4-LDH与Cd2+形成SSMS过程中吉布斯自由能、焓和熵的变化Table 3 Changes of Gibbs free energy(ΔG),enthalpy(ΔH ) and entropy(ΔS ) during the formation of ultra-stable mineralization process between CaAl-SO4-LDH and Cd2+
Temperature/℃ KL/(L·mg-1) ΔG /(kJ·mol-1) ΔH /(kJ·mol-1) ΔS /(J·mol-1·K-1)25 0.374 0 -36.33 1.244 126.1 35 0.381 0 -37.60 45 0.386 0 -38.85

3 结论
1)CaAl-SO4-LDH对Cd2+的SSMS符合准二级动力学过程,说明该矿化过程是以化学作用为主,在CaAl-LDH层板上发生了同晶取代。使LDHs层板上生成新的Cd—O键。
2)Langmuir等温模型对SSMS形成过程具有良好的拟合效果,该过程以单分子层矿化为主导,具有长效性,并进一步证实了该矿化过程中Cd2+取代LDHs层板上的Ca2+,通过同晶取代生成了CdAl-LDH,实现了对Cd2+的超稳矿化。
3)CaAl-SO4-LDH对Cd2+的SSMS是一个可自发进行的吸热反应,升高温度有利于SSMS形成过程的进行。



