CYP19A1(rs1870050)基因多态性和前列腺癌临床病理特征的相关性分析
潘 剑,韦 煜,叶定伟,朱 耀
(复旦大学附属肿瘤医院泌尿外科,复旦大学上海医学院肿瘤学系,上海 200032)
在过去的60多年中,雄激素剥夺疗法(androgen-deprivation therapy,ADT)一直是前列腺癌最有效和应用最广泛的全身治疗方法[1]。ADT疗效与其剥夺肿瘤雄激素的能力有关,因此雄激素代谢通路的相关基因是影响疗效的潜在因素。
CYP19A1编码的芳香化酶能将雄烯二酮和睾酮分别催化为雌酮和雌二醇[2]。CYP19A1基因多态性与男性的性激素水平(包括血清睾酮)相关[3-4]。一些研究报道了CYP19A1基因多态性与ADT疗效[2,4-6]和前列腺癌发病风险之间的相关性[7-8]。ROSS等[6]证实CYP19A1 (rs1870050)位点的多态性可以预测作为ADT疗效的预后标志物[9]。然而,有研究报道CYP19A1 (rs1870050)基因位点的变异对高加索人和亚洲人的预后有着相反的影响[2],这引发了其对不同人种预后具体影响的争议。此外,TSUCHIYA等[5]发现若CYP19A1基因中四核苷酸重复数目的增加与转移性前列腺癌患者的总生存期(overall survival,OS)降低相关(41个月vs.61个月)。这提示CYP19A1基因多态性可能与患者的转移状态相关。
以往的研究并没有报道不同人种CYP19A1基因多态性的变异频率,为阐明CYP19A1基因多态性对转移状态的具体影响以及人种因素对基因变异频率的影响,本研究分析了临床病理指标与CYP19A1基因多态性的相关性,还有中国前列腺癌患者与其他人种中基因变异频率的差异。
1 资料与方法
1.1 研究对象选取2014至2019年在复旦大学附属肿瘤医院确诊的182例前列腺癌患者为研究对象,所有患者均经病理活检确诊为前列腺腺泡腺癌,排除病理组织呈现神经内分泌分化或者具有其他非腺癌特征者。根据美国癌症联合会(American Joint Committee on Cancer,AJCC)TNM分期法确定患者临床分期,同时收集确诊年龄、确诊时前列腺特异抗原(prostate specific antigen,PSA)、转移负荷(根据CHAARTED试验的定义,将高转移负荷定义为存在内脏转移,或骨转移灶≥4个且存在至少一个骨盆或脊柱之外的转移灶)、Gleason评分等临床资料。入组前患者均已被告知研究风险,并均已签署风险告知书与知情同意书,本研究已获得本院伦理道德委员会批准。
1.2 基因测序按标准操作流程,采用试剂盒从患者身上采集血液并提取DNA,使用琼脂糖凝胶电泳法检验DNA的质量。采用酶标仪检测DNA的浓度和纯度,定量标化至5 ng/μL,于4 ℃下分装备用,并采用TaqMan探针法进行基因分型,探针与引物均来源于ABI公司。试验扩增的条件为:使DNA在98 ℃的温度下进行变性,持续15 s;退火步骤在52 ℃下进行,持续20 s;扩增持续20 s,在68 ℃下进行,所有过程共38个循环。将携带变异等位基因(AC或CC)的患者归为变异组,将不携带变异等位基因(AA)的患者归为正常组。
1.3 文献的纳入计算机分别检索中文数据库和英文数据库,包括Embase、WanFang Data、CBM、Ovid Medline、PubMed、CNKI、EMbase、Web of Science,检索基于各个人种发表的涉及CYP19A1(rs1870050)基因的研究,检索时间设置为2000年1月至2021年2月。在检索过程中,英文数据库和中文数据库的检索均采用自由词与主题词相结合的形式,中文检索词包含CYP19A1、rs1870050、基因多态性、前列腺癌/肿瘤等;英文检索词包含CYP19A1、rs1870050、polymorphism、prostate neoplasm/carcinoma/cancer等。排除标准:无各基因型的具体数量;涉及的数据并非首次报道;基因频率的描述对象不是人类。
1.4 统计学方法采用Hardy-Weinberg平衡检验评估整体样本的群体代表性。分类变量、Gleason评分、转移负荷、临床病理分期、基因型用χ2检验或者Fisher确切检验法,数值变量(确诊时年龄)采用非配对的t检验,P<0.05为差异有统计学意义。所有统计分析采使用R studio完成。
2 结 果
2.1 患者的一般资料正常组的平均确诊年龄为(65.3±7.6)岁,变异组的为(65.8±8.1)岁;正常组82例,变异组100例,变异频率54.9%(100/182)。经分析发现,CYP19A1 (rs1870050)基因型与患者的转移负荷相关,携带变异等位基因的患者中高转移负荷患者占比多(P=0.03)转移负荷可以预测患者的基因型类型;而CYP19A1 (rs1870050)基因型与确诊时年龄、Gleason评分、M1状态、确诊时PSA无关(表1)。
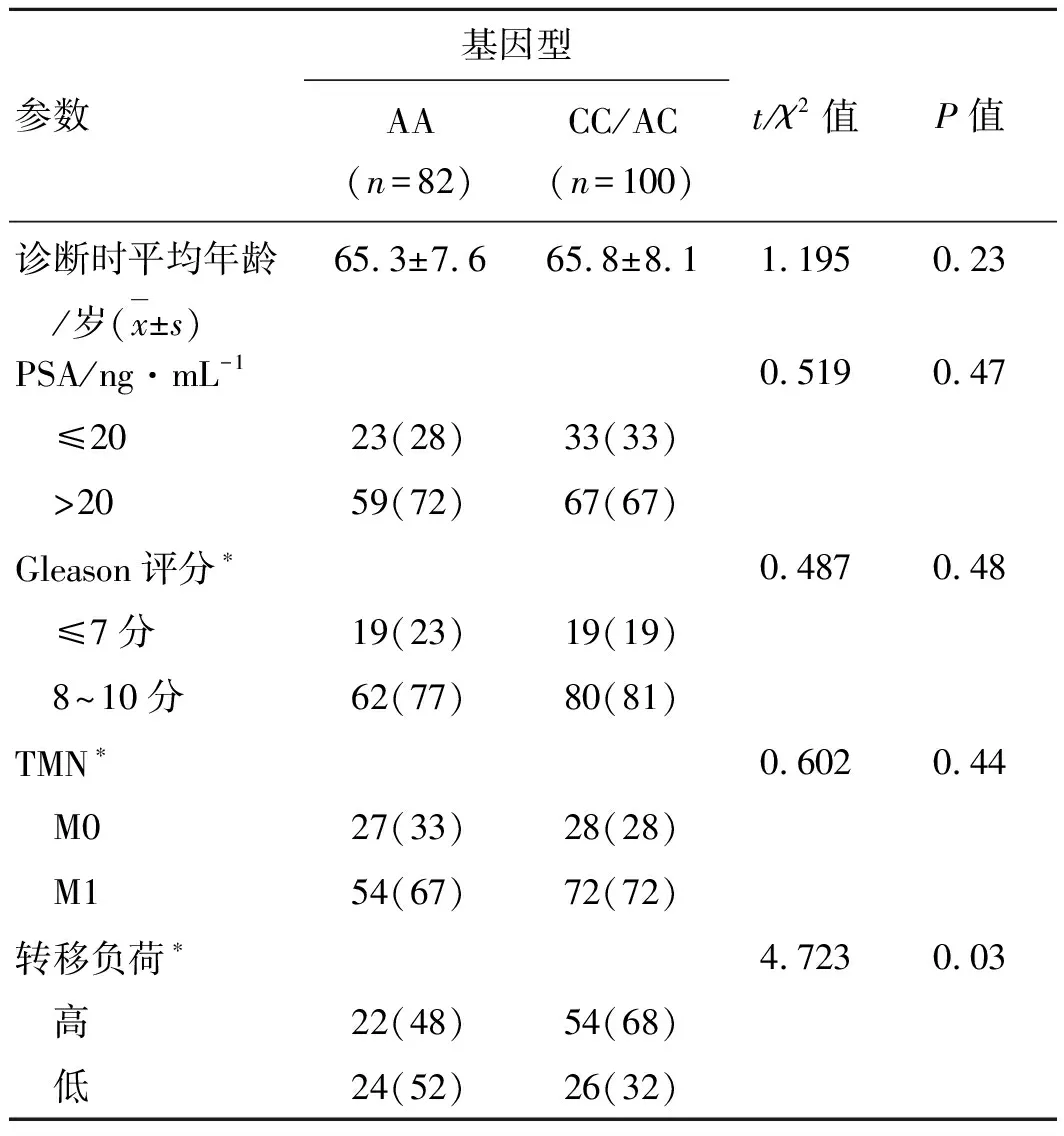
表1 研究对象的临床信息 [例(%)]
2.2 文献对比结果经逐层筛选,最终纳入英文文献2篇,1篇的研究对象为高加索人[6],另1篇的研究对象为日本人[19],纳入总样本量为600例;无中文文献符合入选要求。关于纳入研究的基本特征,高加索人中变异组的占比为13.1%(68/520),日本人中变异组的占比为35%(28/80)(表2)。为对比东亚人群与北美人群CYP19A1 (rs1870050)基因型频率差异,整合本中心队列与日本队列,经分析发现:基因变异频率最高的为中国人群(54.9%),其次为日本人和高加索人;中国和日本的变异频率为48.9%,显著高于高加索人的变异频率13.1%(P<0.001),详见表3;中国人的变异频率也显著高于美国人与日本人(P<0.01,图1)。
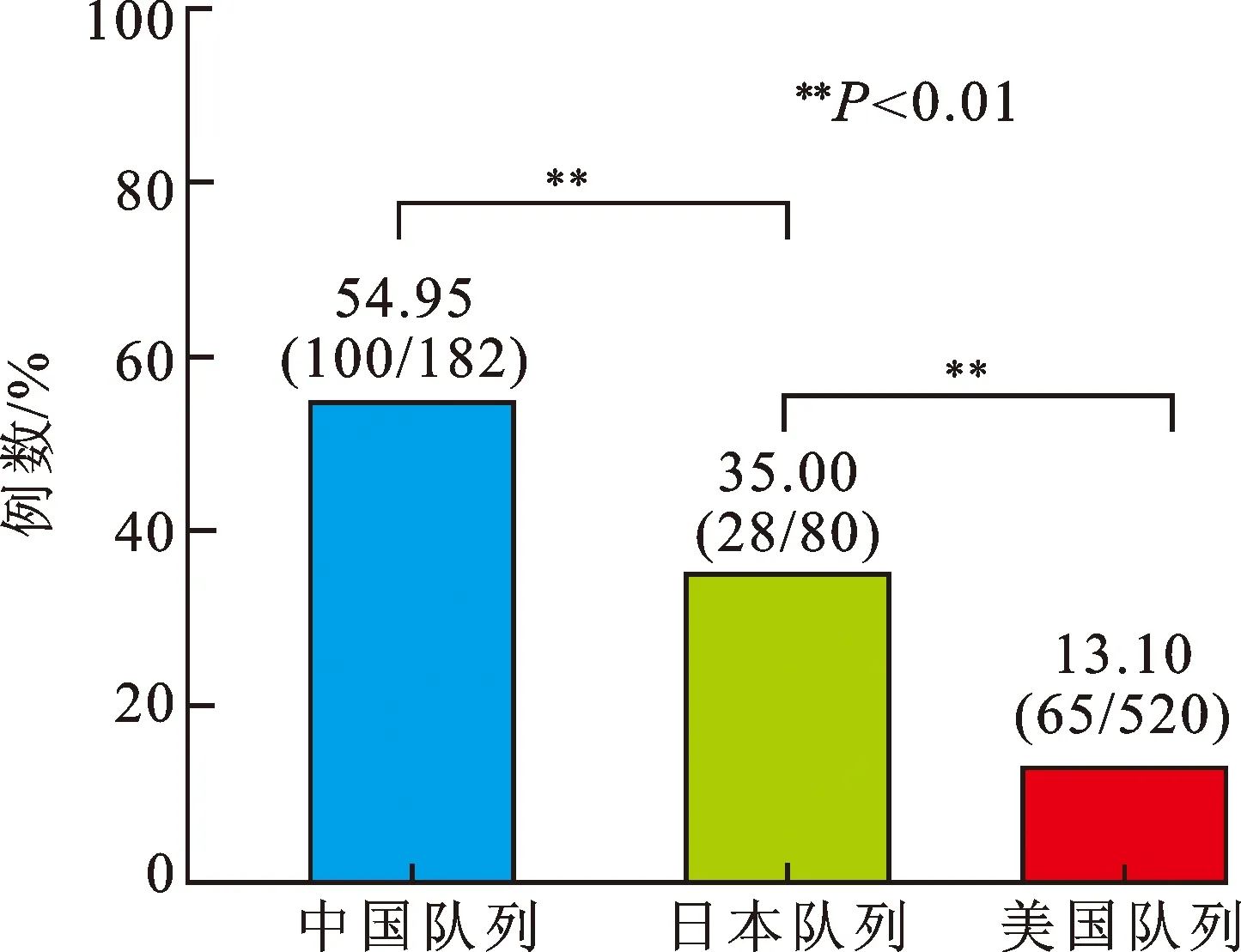
图1 三国队列中CYP19A1基因的变异频率对比

表2 纳入研究的基本特征
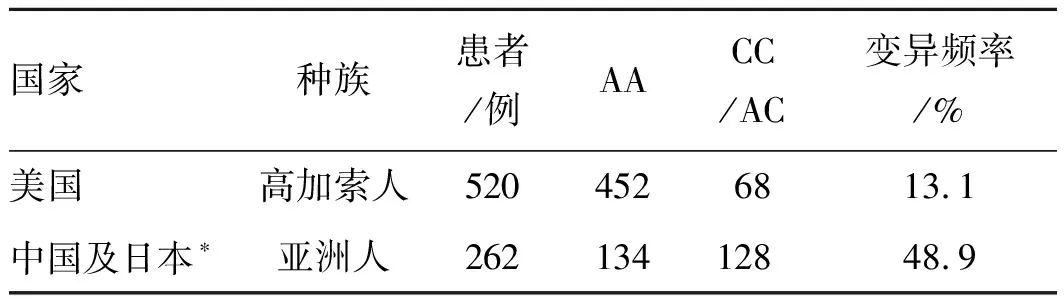
表3 美国和东亚CYP19A1基因的各基因型分布
3 讨 论
本研究通过分析病理指标与位点多样性之间的关联性,发现携带变异等位基因的患者在发生远处转移后,高转移负荷的占比显著增高,这提示变异的等位基因可能会导致前列腺癌侵袭性的增强。同时,本研究对比了不同人种携带变异等位基因的频率,发现亚洲人群的CYP19A1(rs1870050)基因位点变异频率较北美人群高,这可能部分解释了CYP19A1(rs1870050) 基因在不同人种内对预测治疗疗效作用相反的现象。
理论上,对芳香化酶的抑制可增加雄激素浓度而最终削弱ADT对前列腺癌的抑制作用。有研究提示[10],芳香化酶的低表达与经根治性切除术患者的较差预后有关。此外,一些临床试验并未报道芳香化酶抑制剂针对晚期前列腺癌和CRPC治疗效果[11-13],这与体外实验的结果一致[14]。在ADT期间,对雄激素的充分抑制是ADT获得良好治疗效果的关键[15-16]。CYP17抑制剂醋酸阿比特龙可显著降低转移性激素敏感性前列腺癌患者的雄激素水平,提高患者的OS[17-18]。
有报道称CYP19A1基因的单核苷酸多态性(single nucleotide polymorphism,SNPs)与包括血清睾酮在内的性激素水平相关[3-4],但不包括对rs1870050的分析。而之后SHIOTA等[19]的研究则揭示了CYP19A1基因多态性对ADT期间血清睾酮水平和预后的影响,发现ADT期间不同的血清睾酮水平取决于CYP19A1(rs1870050)的遗传变异,携带该变异等位基因会使得芳香化酶的活性变高,最终导致血清睾酮水平的降低。虽然CYP19A1基因变异(rs1870050)影响芳香化酶活性的具体机制尚不清楚,但rs1870050位于CYP19A1基因功能启动子附近的5-UTR区,位点的变异可能会影响CYP19A1基因的表达,需要进行位点多态性在不同人种及ADT期间患者血清雄激素水平与ADT疗效相关性的验证研究,以及进一步的生物学机制研究。
一些研究也提示了CYP19A1的遗传变异与前列腺癌发病风险之间的关系[2],但结果并不一致。此外,全基因组关联研究未能表明CYP19A1基因多态性与前列腺癌易感性之间存在显著关联。与血清睾酮水平的结果一致,SHIOTA等[19]的研究发现,携带CYP19A1(rs1870050)基因变异等位基因的初诊转移性前列腺癌患者在接受ADT时,进展为去势抵抗性前列腺癌的风险显著降低。但是,之前北美的一项研究显示[6],携带变异等位基因的患者在ADT期间发生进展的风险更高。LÉVESQUE等[2]则报道了中国台湾地区携带这一变异等位基因的601例前列腺癌患者在ADT期间的进展风险较低,这与北美研究的结果相反。CYP19A1(rs1870050)基因多态性对疗效的不同作用可能与SNP (rs1870050)在不同人种中的变异频率差异有关。此外,在一项日本前列腺癌患者的队列研究中,CYP19A1基因中的(TTTA)序列的重复[5]和SNP (rs4775936)位点多态性均被证实与OS相关[4]。
综上,以往关于CYP19A1(rs1870050)基因的研究大多集中在其位点多态性对于治疗疗效与OS的预测效果上,缺乏位点多态性与前列腺癌侵袭性之间的研究。而病理特征是反映癌症侵袭性强弱的重要指标。本研究对位点多态性与病理特征之间的相关性进行了分析,但未进行位点差异对疗效影响的分析,是本研究的不足所在。