Skp2在年龄相关性听力损失小鼠耳蜗中的表达△
罗中业 梁瑞 刘戴瑶 周凡 刘双月 刘永新
年龄相关性听力损失(age-related hearing loss,ARHL)是随年龄增长双耳高频听力下降的感音神经性听力损失。S期激酶相关蛋白-2(S-phase kinase-associated protein-2,Skp2)是细胞周期G1/S转换的关键调节因子,参与调控细胞衰老。与年轻内皮祖细胞相比,Skp2水平在复制性衰老的内皮祖细胞中显著降低[1]。Dong等[2]研究发现,Skp2在初生小鼠耳蜗中的听觉上皮和螺旋神经元细胞中表达,且其在听觉系统的发育中扮演重要角色; Minoda等[3]在成年豚鼠的听觉上皮细胞中诱导Skp2的高表达,发现其表达水平与听觉功能密切相关。然而,耳蜗中Skp2的水平是否随着年龄增长发生显著变化,此变化是否与ARHL有关,目前尚无报道。本研究旨在通过观察不同月龄小鼠耳蜗中Skp2的表达水平,探讨Skp2在小鼠ARHL发生发展中的作用。
1 材料与方法
1.1实验动物及分组 63只健康1月龄 C57 BL/6J雄鼠,体重 15~16 g,由北京维通利华实验动物公司提供,动物许可证编号:SCXK(京)2016-0006;将小鼠随机分为2月龄组、8月龄组和12月龄组,每组21只,正常饲养至相应月龄。
1.2实验材料 兔Skp2单克隆抗体购自中国北京博奥森生物技术有限公司,Alexa Fluor©488标记山羊抗兔IgG购自美国Santa Cruz公司,辣根过氧化物酶标记山羊抗兔IgG购买自美国Earthox公司;GAPDH购买自美国Affinity 公司;FITC-鬼笔环肽购自中国上海翊圣生物科技有限公司,抗荧光淬灭剂、MDA试剂盒及SOD试剂盒购自中国北京索莱宝科技有限公司;Smart EP&OAE听觉诱发电位-耳声发射记录系统由美国IHS公司生产。
1.3听性脑干反应(ABR)检测 各组小鼠噻拉嗪(100 mg/kg)和氯胺酮(10 mg/kg)混合麻醉后,分别将电极正极置于颅顶正中皮下,负极连接被测耳,接地电极连接对侧耳。SmartEP&OAE听觉诱发电位-耳声发射记录系统给予短纯音(tone burst)刺激,选取8、12、16、24和32 kHz 5个频率分别进行测试并记录ABR阈值;重复率为39.1次/秒,带通滤波100~3 000 Hz,叠加1 024次,扫描时程16.0 ms;声刺激强度从100 dB SPL开始,以5 dB逐次递减,以最后一次出现ABR波Ⅰ并与上一波形有延续性的声强定为ABR阈值。
1.4小鼠耳蜗氧化应激水平测试 小鼠行ABR检测后各组取10只处死,并于体式显微镜下分离耳蜗;4个耳蜗合成一份样本,加入200 μL裂解液(强)及2 μL蛋白酶抑制剂,耳蜗组织匀浆破碎;低温高速离心机 4 ℃下,12 000 rpm/min离心 10 min,取上清液,根据试剂盒说明书,通过紫外分光光度仪分别检测小鼠耳蜗丙二醛(malondialdehyde,MDA)水平和总超氧化物歧化酶(total superoxide dismutase,T-SOD)活力。
1.5耳蜗标本处理 各组5只小鼠耳蜗以4% 多聚甲醛溶液(PH 7.4)4 ℃下固定24 h,随后标本经PBS润洗后置于4% EDTA溶液中脱钙备用。
1.5.1小鼠耳蜗基底膜毛细胞计数 每组5个左侧耳蜗脱钙后,体式显微镜下完整分离基底膜,并平铺于载玻片。室温下,组织在鬼笔环肽(1∶200)溶液中避光染色1 h,封片后荧光显微镜下观察。选取每0.18 mm标尺为一个视野,从基底膜顶部向底部连续观察内毛细胞(inner hair cell,IHC)、外毛细胞(outer hair cell,OHC),利用耳蜗毛细胞定量软件进行毛细胞计数。
1.5.2免疫荧光染色 每组5个右侧耳蜗,进行石蜡常规包埋。将蜡块沿蜗轴正中行5 μm连续切片,切片脱蜡至水后,用柠檬酸钠修复液(PH 6.0)微波炉修复,山羊血清封闭1 h后,滴加抗Skp2单克隆抗体(1∶200),4 ℃孵育过夜;滴加荧光二抗(1∶200)避光孵育1 h后,抗荧光淬灭剂封片,激光共聚焦显微镜下拍照。每组随机选取10个视野,应用Image.J软件在相同条件下测量小鼠耳蜗中的柯蒂器、螺旋神经节和血管纹三个部位的Skp2阳性产物的光密度值,值越大,阳性反应越强烈。
1.6蛋白印迹检测 小鼠(6只)处死后,迅速取耳蜗组织,4只耳蜗为一份样本,加入裂解液RIPA,在低温制备耳蜗蛋白样本。SDS-聚丙烯凝胶电泳后转膜,以5%脱脂奶粉室温下封闭1 h,Skp2抗体(1∶1 000稀释)4 ℃孵育过夜。加辣根过氧化物酶标记的二抗(1∶1 000稀释)室温下孵育1.5 h,以ECL法发光显影,全自动凝胶成像系统进行半定量分析,内参照物为 GAPDH,Skp2/GAPDH 比值代表 Skp2的蛋白表达水平。
1.7统计学方法 采用Prism 8.0统计软件,以单因素方差分析对数据进行统计学分析。
2 结果
2.1各组小鼠ABR阈值比较 各组ABR检测结果如表1所示,与2月龄组比较,8月龄组、12月龄组小鼠各频率 ABR阈值均升高(P<0.01)。与8月龄组相比,12月龄组小鼠各频率ABR阈值显著升高(P<0.01)。

表1 各组小鼠8~32 kHz各频率ABR阈值
2.2各组小鼠耳蜗内MDA水平和T-SOD活力比较 2月龄小鼠耳蜗中MDA水平最低,12月龄组MDA水平最高;2月龄小鼠耳蜗中T-SOD活力最高,12月龄组耳蜗中T-SOD活力最低。与2月龄组比较,8、12月龄组耳蜗中MDA水平增高(P<0.01),T-SOD活力降低(P<0.01);与8月龄组相比较,12月龄组耳蜗中MDA水平升高(P<0.01),T-SOD活力降低(P<0.01)(表2)。
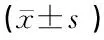
表2 各组小鼠耳蜗中MDA水平和T-SOD活力(n=5只)
2.3各组小鼠耳蜗毛细胞缺失率比较 如图1所示,2月龄组小鼠耳蜗毛细胞在全回缺失最少,而12月龄组小鼠耳蜗毛细胞在全回的缺失则明显增多;与2月龄组比较,8月龄组小鼠耳蜗顶回毛细胞与2月龄组相差不明显,越接近底回毛细胞缺失越多(P<0.01),底回外毛细胞缺失最多(P<0.01),约80%,而内毛细胞损失约20%;而12月龄组小鼠全回内、外毛细胞缺失均明显升高(P<0.01),与8月龄组相比较,12月龄组小鼠耳蜗毛细胞缺失率均明显增加(P<0.01),仅底回外毛细胞缺失相差不明显。
2.4各组小鼠耳蜗Skp2蛋白的表达 Skp2蛋白在小鼠耳蜗中的毛细胞、螺旋神经节及血管纹均有表达,2月龄组Skp2蛋白表达水平最高,尤其在螺旋神经节中;8月龄和12月龄组小鼠上述部位Skp2表达水平均降低(P<0.01)(图2)。

图1 各组小鼠耳蜗外毛细胞缺失率(a)和内毛细胞缺失率(b)(n=5耳) 注:*与2月龄组比较P<0.01,#与8月龄组比较,P<0.01

图2 各组小鼠耳蜗Skp2的表达(免疫荧光染色,标尺=50μm) 注:箭头所示为Skp2阳性表达
2.5各组小鼠耳蜗Skp2蛋白印迹检测 12月龄小鼠耳蜗Skp2电泳条带显色最浅,半定量分析结果显示,随着年龄增加,小鼠Skp2 蛋白含量逐渐减少(P<0.01),12月龄组较2月龄组减少将近50%(图3、表3)。
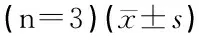
表3 各组小鼠Skp2表达的平均光密度值(n=5)及Skp2/GAPDH值
3 讨论
目前认为ARHL的主要病理改变为毛细胞、血管纹、传入螺旋神经节神经元等细胞凋亡,从而使小鼠耳蜗功能异常导致其听力损失,耳蜗内的氧化应激反应是导致ARHL的可能机制之一[4]。ARHL发病率高,人口数量庞大,不仅给社会和经济造成极大的影响,而且会使患者产生被孤立感,极大地影响患者的生活质量[5]。因此,寻找明确的发病机制成为防治ARHL的当务之急[6]。

图3 各组小鼠耳蜗Skp2蛋白电泳条带
听功能的减退、耳蜗毛细胞损伤与耳蜗的氧化应激损伤密切相关,既往研究已经表明氧化应激损伤是导致细胞衰老的主要因素[7,8],随着年龄的增长,耳蜗中氧化应激损伤增强导致MDA蓄积,而SOD活力降低,抗氧化能力下降,最终导致毛细胞凋亡。本研究显示,C57BL/6J小鼠随着年龄的增长,听力逐渐下降,是理想的ARHL模型;随着月龄增长小鼠耳蜗MDA水平明显升高,T-SOD活力明显降低,而MDA反映耳蜗内氧化应激水平,SOD的活力反映耳蜗内抗氧化能力,证实了在ARHL小鼠耳蜗存在氧化应激损伤,与以往报道[9,10]一致。
细胞凋亡的过程涉及很多细胞因子。Skp2属于F-box蛋白家族,相对分子量48 KD,是细胞周期的一个重要调控蛋白,可以通过降解细胞周期蛋白调节细胞周期[11]。Skp2具有诱导细胞增殖,抑制细胞凋亡的作用,在细胞衰老过程中,发挥重要作用[12~14]。研究发现,Skp2在小鼠胚胎内耳的早期发育阶段的听觉上皮和神经元中表达,其在小鼠听觉系统发育中起着至关重要的作用[2];此外,在豚鼠耳蜗中过表达Skp2,可以促进非感觉细胞分化、增殖,进而产生新的异位感觉毛细胞,改善豚鼠的听功能[3];以上研究均提示,Skp2在维持正常听觉功能中发挥了关键作用。本研究通过免疫荧光及Western blot检测,观察到ARHL小鼠耳蜗Skp2表达随着小鼠月龄的增长而减少,小鼠月龄越大,其表达水平越低;Skp2水平降低主要出现在耳蜗毛细胞、螺旋神经节以及血管纹等维持小鼠听功能的关键部位。推测,耳蜗氧化应激水平的加剧可能影响了Skp2表达水平下降,导致耳蜗内外毛细胞及螺旋神经节细胞功能障碍。
综上,ARHL小鼠耳蜗Skp2水平降低可能与其耳蜗细胞的衰老和听功能减退有关,这可能为临床治疗和预防ARHL提供新的研究方向。本研究仅观察到了ARHL小鼠耳蜗Skp2减少及随月龄增长T-SOD活力降低、MDA水平升高,尚没有更多证据表明是ARHL小鼠耳蜗中的氧化应激损伤诱导Skp2表达水平降低;下一步可通过调节耳蜗中Skp2的表达水平来明确其对老龄小鼠听力损失进展的影响,进一步明确Skp2减少与老化耳蜗氧化应激水平增加的关系。

