PEDV Nsp6蛋白亚细胞定位及诱导内质网应激的初步研究
徐嘉欣,武雪宁,王显赫,徐梧皓,高鑫誉,郑亮,2,吴志军,2,3,张华,2,3,曹宏伟,2,3
(1.黑龙江八一农垦大学生命科学技术学院,大庆 163319;2.黑龙江八一农垦大学动物科技学院;3.黑龙江八一农垦大学生物技术中心)
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)感染仔猪引起的一种急性接触性肠道传染性疾病[1]。临床上主要表现为猪的腹泻、呕吐、脱水、体重减轻等[2-3]。各个年龄阶段的猪均易感染PEDV,不同年龄阶段的猪感染时发病程度各不相同,其中以仔猪的发病情况最为严重,死亡率高达100%[4-5]。PED首次在英国爆发,随后在欧洲、亚洲等国家相继出现,2010年10月,PED在南方的多个省份暴发后,中国才开始出现大规模的流行,并迅速席卷全国[6-7]。新生仔猪因PED导致的死亡率飙升至80%~100%,使得养猪业遭受到毁灭性的打击,给全球经济造成严重的经济损失。
PEDV是单股正链RNA病毒,基因组全长约28 kb[8-9]。PEDV基因组包括5'和3'非翻译区,3'端含有poly(A)尾。其基因组编码4个结构蛋白(纤突蛋白S、囊膜蛋白E、膜蛋白M和核衣壳蛋白N)以及16个非结构蛋白Nsp1-Nsp16(nonstructural protein)和辅助蛋白ORF3[10-11]。
病毒进入宿主细胞后,主要通过宿主来完成自我复制及释放病毒颗粒[12]。研究表明,病毒能够利用内质网膜促进病毒蛋白的合成,导致宿主中错误折叠蛋白质在内质网中积累,进而破坏内质网结构[13]。许多RNA病毒已经能够通过改变宿主的膜室重排现象,如脊髓灰质炎病毒(PV)和柯萨奇病毒B3(CVB3)感染细胞所产生的囊泡簇来自于细胞内质网结构[14];在PEDV感染细胞时,也可出现囊泡现象,但是有关囊泡是否与细胞内质网或其他结构相关的机制研究还未被报道。
Nsp6是PEDV编码的非结构蛋白,属于膜蛋白,包含7个跨膜结构域[15],目前对于nsp6蛋白的功能介绍并不全面。根据已有研究表明,Nsp6可以通过PI3K/Akt/mTOR信号转导途径诱导自噬并促进病毒复制[16],鸡传染性支气管炎病毒(infectious bronchitis virus,IBV)的Nsp6与其类似,也可以诱导宿主细胞自噬体的形成,并对病毒复制也有影响[17]。
RNA病毒利用内质网膜的功能进行自身的转录和翻译,在病毒复制的过程中,病毒蛋白迅速聚集在内质网,造成内质网膜的破坏和消耗,错误折叠的蛋白和未折叠的蛋白聚积在内质网,导致内质网膨胀等现象,破话内质网结构。内质网为了延缓此现象,内质网自身诱发内质网应激,以延缓和减少蛋白合成额载量和蛋白的聚积[19]。
内质网应激主要是在机体受到外界环境刺激时,蛋白质在合成、加工、修饰、转运的过程中,导致大量未折叠或错误折叠的蛋白在内质网中过度积累,从而引发内质网应激反应[18-19]。在内质网腔内,含有大量可溶性分子伴侣和折叠酶,GRP78是内质网中首个被发现的分子伴侣。GRP78通过其多肽结合域和ATP酶功能域之间协同作用,辅助内质网中新生肽形成正确构象,因此GRP78在内质网腔内蛋白合成质控(Quality control)过程中发挥重要作用[19-21]。研究通过构建PEDV Nsp6真核表达载体,鉴定其表达和亚细胞定位,利用间接免疫荧光方法观察到Nsp6可与内质网膜关键蛋白PDI共定位,并激活GRP78表达上调。研究有利于丰富PEDV编码的非结构蛋白中Nsp6的结构和功能以及为PEDV与内质网应激之间复杂关系提供新的理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞和质粒
猪肾细胞(PK15)、宫颈癌细胞(Hela)由实验室保存;猪小肠上皮细胞(IPEC-J2)由浙江大学黄耀伟教授馈赠。细胞用Gibco生物公司DMEM培养基,加入10%的胎牛血清(FBS)、100μg·mL-1青霉素和链霉素,在37℃含5%CO2的恒温培养箱中培养。
pCMV-Myc、pEGFP-N1质粒由实验室保存;PRK5-Nsp6由浙江大学黄耀伟教授馈赠。pEGFPN1-Nsp6为实验室构建,验证表达并保存。DH5α感受态购自北京天根生物技术有限公司。
1.1.2 试剂和抗体
转染试剂LippfectamineTM2000(11668019)购自Invitrogen公司;小鼠抗GFP标签单克隆抗体(ab1218)购自Abmart公司;鼠抗Myc单克隆抗体(TA-01)、兔抗β-actin单克隆抗体(ZM-0001)、山羊抗小鼠辣根酶标记IgG(ZB-2305)、山羊抗兔辣根酶标记IgG(ZB-2301)购自北京中杉金桥生物技术有限公司;兔抗GRP78抗体(AF-0171)购自碧云天生物技术公司;质粒小提试剂盒(D6943-02)和胶回收试剂盒(D2500-02)购自Omega公司;内质网应激激活剂Thapsigargin(T9033)购自Sigma公司;2×Seamless Cloning Mix(CL117)购自Biomed公司。
1.2 实验方法
1.2.1 构建真核表达载体
根据GenBank网站中nsp6基因序列号为KU558701.1,设计nsp6基因特异性引物序列,上游引物序列:TCGAGCTCAAGCTTCGAATTCAGTGGTTATGTTTCACGCGC(EcoR I),下游引物序列:CATGGTGGCGACCGGTGGATCCCTGAACGGAAGAA ATCTTAA(BamH I)。将nsp6基因按照无缝克隆方法插入pEGFP-N1载体片段中,构建pEGFP-N1-Nsp6真核表达载体。
首先,PCR扩增nsp6基因,将PCR产物进行琼脂糖凝胶电泳,再将PCR产物与EcoR I和BamH I双酶切后的pEGFP-N1载体片段进行连接,其体系为:PCR产物50 ng,pEGFP-N1载体片段100 ng,2×Seamless Cloning Mix 5μL,补水至总体积10μL。轻轻混合后,瞬时离心,放置于PCR仪上50℃保温15 min。最后,产物用DH5α感受态进行转化,涂布平板,培养箱培养18 h。挑取单菌落,并提取质粒。将所提质粒进行双酶切鉴定,选取酶切正确的质粒送至吉林省库美生物科技有限公司进行测序,测序正确的载体将其命名为pEGFP-N1-Nsp6,保存于-20℃。
1.2.2 Western blot检测
将Hela细胞均匀铺在24孔板中,待细胞密度长到80%左右时,用Lipofectin2000将pEGFP-N1-Nsp6或PRK5-Nsp6质粒转染至细胞中,6 h后更换含有10%胎牛血清的DMEM培养基,培养24 h后,收取蛋白样品。收样:首先,用RAPI裂解液在冰上裂解细胞30 min,其次,加入5×Loading Buffer并按体积稀释至总浓度为1×Loading Buffer,最后用沸水将蛋白样品煮10 min,12 000×g离心10 min。跑胶:首配置10%的聚丙烯酰胺凝胶,待胶凝固后,组装电泳槽,倒入1×SDS电泳液,插上电极,分离蛋白样品,80 V,20 min,120 V,1.5 h;转膜:将胶板撬开,按照条带大小对应切下胶条,组装转膜装置,用PVDF膜吸附蛋白,冰水混合物中转膜150 min。封闭:配置0.5%脱脂奶粉,将PVDF膜放入奶粉中,摇床上封闭2 h,结束后,用1×TBST溶液洗膜3次,每次5 min。孵育抗体:按照说明书配置一抗和二抗,一抗孵育2 h,1×TBST溶液洗膜8次,每次15 min;二抗孵育2 h,1×TBST溶液洗膜8次,每次15 min。曝光:用AI600仪器曝光,保存结果图片。
1.2.3 间接免疫荧光
细胞传代爬片,待细胞密度长到60%左右时,用Lipofectin2000将pEGFP-N1-Nsp6或PRK5-Nsp6质粒转染至细胞中,培养24 h后,PBS洗涤细胞1次,加入4%多聚甲醛,室温固定20 min;PBS洗3次,每次5 min,加入0.1%Triton X-100,室温透膜20 min,PBS洗3次,加入5%BSA封闭2 h,加入一抗孵育1 h,PBS洗3次,每次5 min,加入荧光素标记的二抗,室温避光孵育2 h,PBS洗3次。最后取干净的载玻片,滴少量封片剂,用针头挑出爬片,将有细胞的一面放在封片剂上,用纸巾轻轻将多余的液体,压紧,再将指甲油均匀涂抹在爬片周围,阻止细菌进入细胞中,避光晾干,待片子干燥后用荧光显微镜观察拍照,并保存图片。
2 结果与分析
2.1 构建pEGFP-N1-Nsp6真核表达载体及双酶切鉴定
利用无缝克隆法PCR扩增大小为840 bp的nsp6基因序列,并将PCR产物连接到于pEGFP-N1载体中,构建重组真核表达质粒pEGFP-N1-Nsp6,通过菌液PCR和双酶切对重组质粒进行鉴定(如图1)结果显示,pEGFP-N1-Nsp6真核表达载体构建成功。
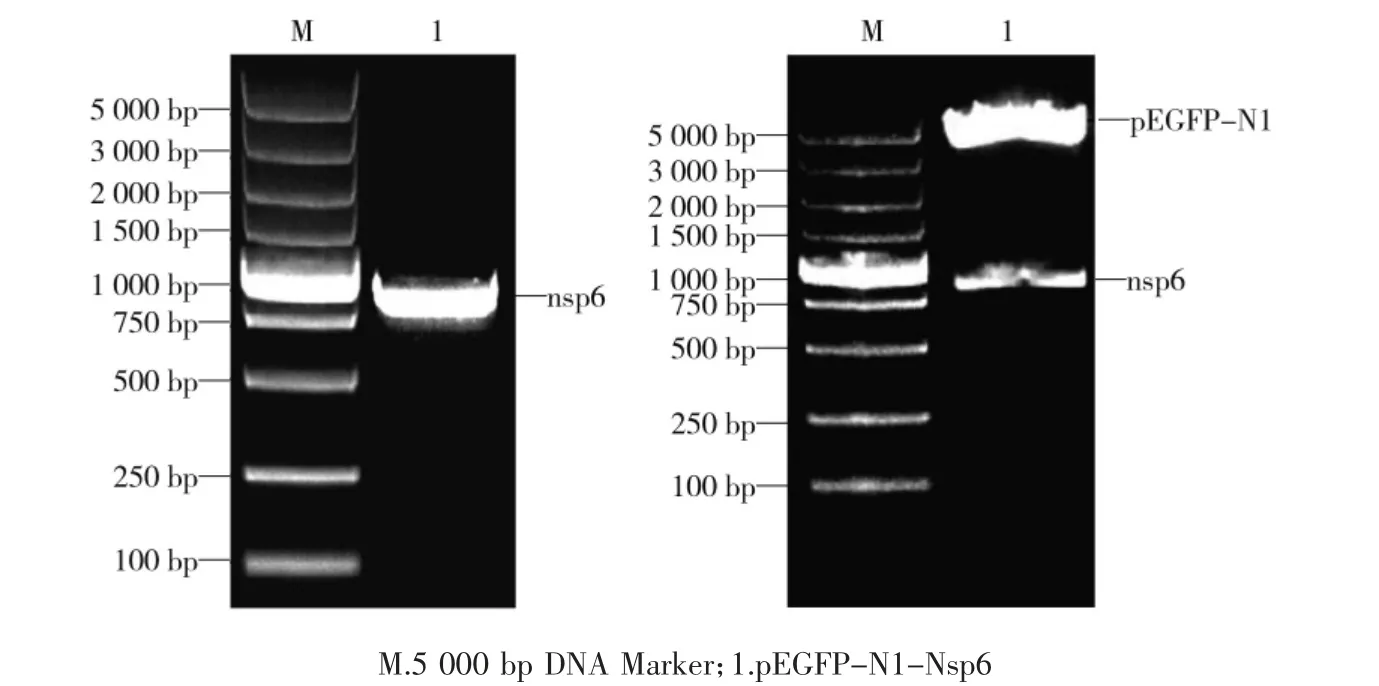
图1 菌液PCR鉴定结果 双酶切鉴定结果Fig.1 Identification of recombinant plasmid pEGFP-N1-nsp6 using PCR and double enzyme digestion analysis of recombinant plasmid pEGFP-N1-nsp6
2.2 Western blot鉴定Nsp6蛋白表达
为验证Nsp6蛋白表达是否正确,研究将pEGFPN1-Nsp6转染至Hela细胞中,24 h后裂解细胞,用GFP标签抗体进行Western blot检测,结果显示,在55 KDa附近有条带(如图2),大小与预期符合,表明pEGFP-N1-Nsp6蛋白表达成功。

图2 pEGFP-N1-Nsp6蛋白表达鉴定Fig.2 pEGFP-N1-Nsp6 protein expression identification
2.3 间接免疫荧光鉴定Nsp6细胞定位
为确定Nsp6蛋白在细胞中的定位,研究将PRK5-Nsp6转染于Hela细胞中,培养24 h后,通过荧光显微镜观察Nsp6蛋白分布情况。结果显示,(如图3),Nsp6蛋白大部分定位细胞质中,并呈弥散形态。

图3 PRK5-Nsp6定位在细胞质中Fig.3 Nsp6 protein localizes in the cytoplasm
2.4 Nsp6亚细胞共定位
为了确定Nsp6蛋白在细胞中的定位情况,研究通过登录生物信息学网址(https://www.genscript.com/psort.html)预测Nsp6蛋白亚细胞定位,结果显示(如图4A),52.2%的Nsp6蛋白位于内质网中,为了进一步明确Nsp6与内质网共定位情况,研究将PRK5-Nsp6质粒转染于PK15细胞中,培养24 h后,通过荧光显微镜观察,结果显示(如图4B),Nsp6蛋白与内质网共定位。

图4 A Nsp6蛋白亚细胞定位预测Fig.4A Nsp6 protein subcellular localization prediction
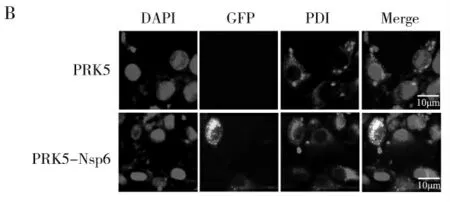
图4 B Nsp6蛋白与内质网共定位Fig.4B Nsp6 protein co-localizes with endoplasmic reticulum
2.5 Nsp6诱导内质网应激反应
GRP78是发生内质网应激的关键信号蛋白,为检测Nsp6是否诱导内质网应激反应,研究将PRK5-Nsp6和pEGFP-N1-Nsp6两种质粒分别转染于PK15细胞中,另用毒胡萝卜素(Tg)刺激细胞作为阳性对照,Western blot检测结果显示(如图5),与空白对照组及空载体组相比,转染Nsp6质粒和用Tg处理后,GRP78表达明显上调。此外,为了进一步确定Nsp6蛋白是否通过PERK信号途径导致GRP78表达上调,研究检测了eIF2α的磷酸化水平。结果显示转染PRK5-Nsp6或EGFP-N1-Nsp6后,p-eIF2α表达量升高,以上结果表明Nsp6蛋白能够诱导内质网应激反应,并激活内质网应激关键信号蛋白GRP78的表达以及激活eIF2α的磷酸化水平。

图5 Nsp6蛋白上调GRP78蛋白的表达Fig.5 Nsp6 protein upregulation of GRP78 protein expression
3 讨论
内质网是蛋白质折叠和翻译后修饰的重要场所,因此也是病毒复制和成熟的关键细胞器[22]。在病毒感染后,影响机体钙离子平衡以及内质网向高尔基体膜转运等,干扰内质网功能从而增加内质网的负担,进而导致大量未折叠蛋白和错误折叠蛋白的堆积[23-24]。因此,病毒感染后通常会诱发内质网应激。细胞产生内质网应激后,位于细胞膜上的GRP78蛋白能够识别并结合到未折叠或错误折叠的蛋白质上,并激活下游PERK、IRE1和ATF6关键信号蛋白,缓解内质网压力,诱导内质网作出相应反应[25-27]。
根据已有研究显示,诸多冠状病毒能够引发内质网应激,且大多数病毒的复制与内质网密切相关,在感染宿主细胞后引起内质网应激[28]。如丙型肝炎病毒基因组在肝癌细胞中复制能导致大量病毒蛋白和RNA复制中间产物在内质网中聚集,从而产生数以千计的新病毒颗粒[29]。登革病毒以ER为复制位点,在感染过程中有UPR激活的标志,UPR激活后诱导内膜合成,病毒蛋白优先翻译,促进复制[30]。HRV16的非结构蛋白2B通过PERK和ATF6途径诱导内质网应激反应[31]。MHV A59蛋白通过内质网应激反应上调eif2α磷酸化水平,阻止宿主蛋白的合成[32];过表达PEDV S蛋白能够上调GRP78的表达,并且可与GRP78蛋白发生共定位情况,但是具体的机制有待被阐明[33];PEDV ORF3蛋白可以亚细胞定位于内质网,引起内质网应激和细胞自噬,并导致细胞死亡,但其具体的作用机制尚不明确。
冠状病毒非结构蛋白在病毒复制中的功能相对保守[34-35],而与内质网应激有关的研究更是少之又少。PEDV编码的非结构蛋白目前已有研究相继报道,如nsp5编码3C样蛋白酶(3C-like proteinase,3CLpro),其在病毒成熟过程中扮演重要角色;非结构蛋白Nsp12是核酸解旋酶,属于解旋酶超级家族Ⅰ,可以有效地解开RNA和DNA双螺旋;Nsp14是一种尿苷酸特异性核糖核酸内切酶,它与SARS的nsp15基因有60%同源性[16,36-37];Nsp6能够诱导自噬小体的形成抑制病毒复制,这一特点同PEDV编码的辅助蛋白ORF3类似,Zou[38]等研究表明ORF3通过诱导自噬进而激活内质网应激反应。研究结果显示,Nsp6能够激活内质网标识蛋白GRP78的表达以及激活eIF2α的磷酸化水平,表明Nsp6能够参与内质网应激反应,并且结构预测结果中可以看出,Nsp6在内质网中占52%,这说明Nsp6是影响内质网应激的重要非结构蛋白。目前关于内质网应激与PEDV之间的机制研究还处于初级阶段,Nsp6参与内质网应激的具体机制尚不清楚,比如Nsp6参与内质网应激哪条信号转导途径以及与内质网标识蛋白是否存在互作进而影响病毒复制等一系列问题有待进一步深入研究。
——一道江苏高考题的奥秘解读和拓展

