蜂毒组成分析方法的研究*
王彩肖,任风芝,陈若尘,张向彬,张 彦,高彩杰,刘建芬,李丽红
(1 华北制药华坤河北生物技术有限公司,河北 石家庄 050000;2 华北制药集团新药研究开发有限责任公司,河北 石家庄 050000)
蜂毒是工蜂毒腺分泌的一种具有芳香气味的成分复杂的混合物,主要含有蛋白质多肽类、酶类、生物胺类和其它物质,其中蜂毒肽约占蜂毒干重的50%,是蜂毒中主要功能物质[1]。蜂毒具有丰富的生物活性物质,是天然药物开发利用的良好资源,被广泛应用于风湿病、关节炎、抗肿瘤、免疫调节等疾病的治疗[2],但因其结构复杂易引起药物稳定性的问题[3],因此需要采用不同的分析方法研究不同来源的蜂毒在蛋白多肽组成上的差异,以期为今后蜂毒的开发利用奠定基础。
聚丙烯酰胺凝胶电泳法(SDS-PAGE)方法采用银染的方法进行分离[4],银染法分辨率高,可以识别0.5 mg/kg以上的不同蛋白,这样可以准确识别出不同的样品中的蛋白分布。分子排阻色谱-高效液相色谱法(SEC-HPLC)可以定量蛋白质的分布及纯度,检测灵敏度高、速度快[5-6]。质谱分析具有高灵敏、高准确、高通量特性,为蛋白质学领域提供了高质量的研究分析手段,目前已有报道应用高分辨质谱进行蛋白质的分析,证明高分辨质谱有其强大的高分辨率和高性能,适用于肽段和蛋白质的组学分析[7-8]。
本研究拟采用不同的分析手段,包括聚丙烯酰胺凝胶电泳法(SDS-PAGE)、分子排阻色谱-高效液相色谱法(SEC-HPLC)、高分辨率质谱法(HRMS)分别对4个不同来源的粗蜂毒样品进行蛋白多肽组分的差异性分析,及利用高效液相色谱法(HPLC)分析其蜂毒肽含量的差异性,从而希望能为后期蜂毒的开发利用提供参考。
1 实 验
1.1 材料、试剂与仪器
1.1.1 材料与试剂
蜂毒,市售;12%预制胶,Invitrogen;Marker,Thermo;10×PBS,Sigma;银染试剂盒,Thermo;乙腈(色谱纯),Honeywell;冰醋酸(分析纯),天津市永大化学试剂有限公司;甲酸(色谱纯),Merck;三氟乙酸(色谱纯),Honeywell;蜂毒肽标准品(≥97%,HPLC),aladdin;实验用水为超纯水,自制。

表1 样品信息Table 1 The sample information
1.1.2 仪器与设备
PowerPac Basic Power Supply1645050电泳仪,美国Bio-Rad;e2695高效液相色谱仪,美国Waters;LC-2030C Plus高效液相色谱仪,日本岛津;高分辨率质谱仪(QE),美国Thermo,超纯水机,美国Pall。
1.2 实验方法
1.2.1 SDS-PAGE方法
实验采用12%的预制胶,60 V的电压进行电泳,上样量为25 μL,电泳结束后选择银染色法进行固定、染色与脱色。
样品溶液:称取适量蜂毒,用1×PBS溶液溶解稀释成 1.0 mg/mL的溶液。
1.2.2 SEC-HPLC方法
色谱柱:Shodex PROTEIN KW-802.5(8.0×300 mm, 5 μm);流动相:将乙腈、水与冰醋酸按300:400:200的比例混合,用浓氨水(25%~30%)调pH至3.0,然后用水稀释至1000 mL;流速:0.5 mL/min;柱温:25 ℃;检测波长:UV276 nm;进样量:100 μL。
样品溶液:称取适量蜂毒,用水溶解稀释成1.0 mg/mL的溶液。
1.2.3 HRMS方法
色谱条件:使用超高效液相色谱仪,色谱柱:Waters Acquity UPLC BEH C18Column(2.1×100 mm,1.7 μm);流动相:A-0.1%的甲酸水溶液,B-0.1%的甲酸乙腈溶液,梯度洗脱(0~2.5 min:10%B;2.5~5.5 min:10%~50%B; 5.5~12.5 min,50%~80%B;12.5~13 min,80%~10%B;13~15 min,10%B);柱温:30℃;进样量:10 μL;流速:0.4 mL/min;检测波长:214/254nm。
质谱条件:使用高分辨质谱仪,离子源:电喷雾离子源(ESI);扫描模式:正离子模式;喷雾电压:3.5 kV;透镜电压:50 V;辅助气体流速:5 L/min毛细管温度:320 ℃;分辨率:70000;扫描范围:200~2000 m/z。
样品溶液:称取适量蜂毒,用水溶解稀释成0.25 mg/mL的溶液。
1.2.4 HPLC方法
色谱柱:UniPS 5-300(4.6×250 mm,5 μm);流动相:A-0.1%的三氟乙酸水溶液,B-0.1%的三氟乙酸乙腈溶液,梯度洗脱(0~15 min:30%~50%B;15~20 min,50%~30%B);柱温:30 ℃;进样量:20 μL;流速:1.0 mL/min;检测波长:220 nm。
样品溶液:称取适量蜂毒,用水溶解稀释成1.0 mg/mL的溶液。
2 结果与讨论
2.1 SDS-PAGE方法
SDS-PAGE是定性分析蛋白质最常用的电泳方法,从样品实验结果的电泳图谱(图1)中可以看出凝胶背景清晰,蛋白条带分辨率高。
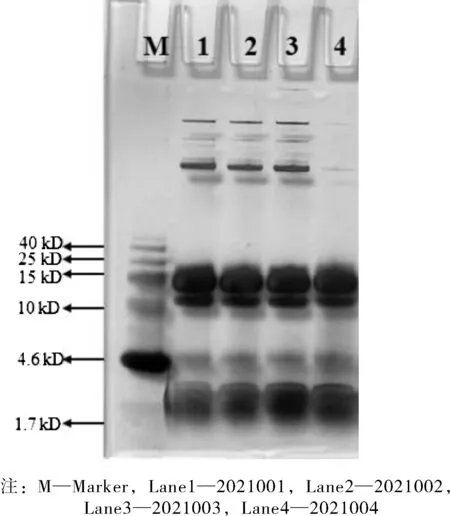
图1 SDS-PAGE检测结果Fig.1 SDS-PAGE test results
由图1可知,蜂毒蛋白质的表达条带较多,蛋白质分子量在1.7~40 kDa之间在样品中所占比例较大,是样品中的主要成分,蜂毒各主条带没有明显差异;在分子量大于40 kD范围内,不同蜂毒中呈现出不同的蛋白条带结果,这表明不同来源的蜂毒在蛋白组成上存在差异性,可对存在差异性的目标成分进行进一步的鉴定,为今后蜂毒的开发及药用研究奠定基础。
2.2 SEC-HPLC方法
通过SEC-HPLC测定蜂毒的组分差异性,实验采用两根串联的色谱柱(Shodex PROTEIN KW-802.5,8.0×300 mm, 5 μm),详细结果见图2和表2。

图2 SEC-HPLC检测结果Fig.2 SEC-HPLC test results
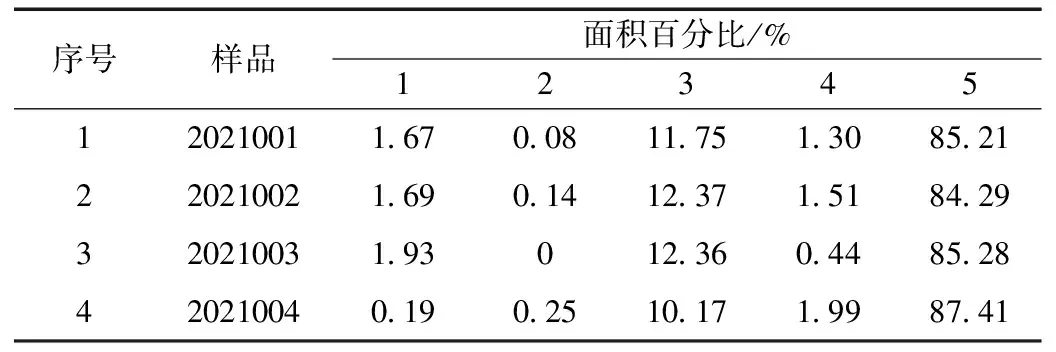
表2 SEC-HPLC结果汇总Table 2 Summary of SEC-HPLC results
蜂毒样品在20~40 min内,有5个肽类成分得到良好的分离,其中峰5为蜂毒肽I单体,以峰面积占比作为主要特征峰标准。由表2和图2可知,不同来源的蜂毒比较,高分子蛋白的含量与分布在1、2、4的位置上明显差异,这表明蜂毒样品之间组成成分存在明显差异,因此,高分子蛋白的方法可用于后期样品的研究工作中。
2.3 HRMS方法
实验采用HRMS方法对不同蜂毒进行分析,对样品中有关物质的分子量进行分析,确认样品差异性,具体实验结果见图3和表3。

图3 HRMS方法结果图谱(TIC图)Fig.3 Results of HRMS method (TIC diagram)

表3 HRMS结果汇总Table 3 Summary of HRMS results
从图3和表3中可知,蜂毒的成分复杂,主峰位于RT6. 16~6.42 min内,为蜂毒肽单体,其分子量为2845.8 Da。同时发现在RT 5.43~5.60 min区间内,蜂毒-1,2,3样品中的多聚体(分子量为16132.5 Da)明显多于蜂毒-4(2021004);RT 6.53 min左右,各个样品中的分子量分布明显不同,这也表明蜂毒样品之间组成成分存在明显差异,可作为后续对蜂毒样品分析研究的依据。
2.4 HPLC方法
实验采用HPLC方法对不同蜂毒样品中的主成分蜂毒肽的含量进行分析,确认样品差异性,具体实验结果见图4和表4。
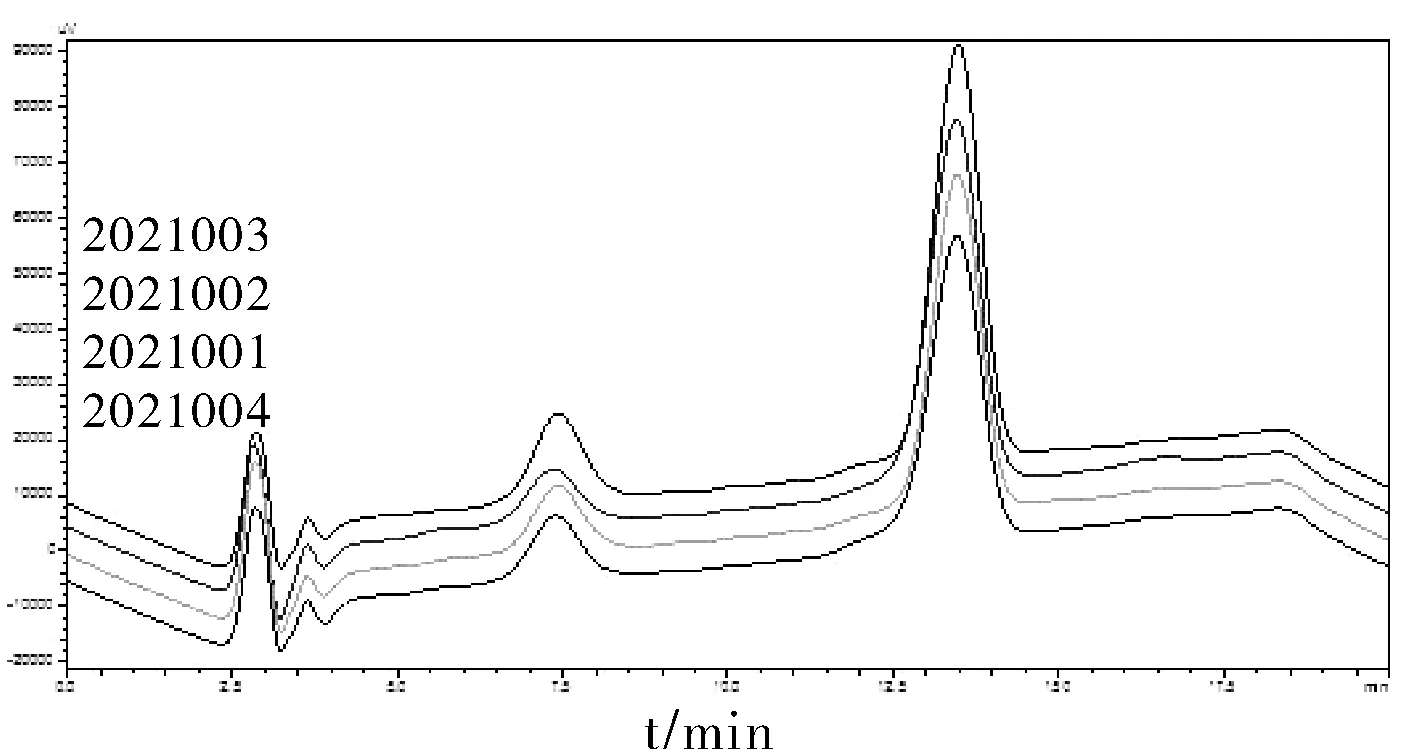
图4 HPLC方法结果图谱Fig.4 Results of HPLC method

表4 蜂毒肽含量结果汇总Table 4 Summary of melittin content results
本实验利用HPLC法,对4个蜂毒样品中蜂毒肽的含量进行了测定。结果表明,来源不同的蜂毒样品中的蜂毒肽含量存在明显差异。蜂毒肽是蜂毒中的主要成分,根据蜂毒肽的含量可以为后期蜂毒样品质量性研究及为进一步研究和开发蜂毒产品提供分析依据。
3 结 论
本研究运用SDS-PAGE、SEC-HPLC和HRMS技术对蜂毒中的蛋白多肽组分的差异性进行了一些基础分析,及利用HPLC技术对蜂毒肽含量进行检测,结果显示这些分析方法可以检测出蜂毒中蛋白多肽分子的差异性,可用于后期的深入研究中。由于蜂毒的化学成分体系非常复杂,其质量可能会受多种因素的影响,如物种来源、养殖环境、采集方法等,而且蜂毒原料与临床应用上的用药功效及安全性都有着紧密的联系,为了保证蜂毒及其相关制剂在临床上的稳定性和安全有效性,因此,有必要选择合适的分析方法用于研究蜂毒的组分差异性,为今后蜂毒的质量分析及开发利用等方面提供技术支撑。

