CO/CO2羰基化合成甲醇的理论研究*
成莉燕,燕鹏华,慕红梅
(1 兰州资源环境职业技术学院环境与化工系,甘肃 兰州 730021;2 中国石油兰州化工研究中心,甘肃 兰州 730060)
甲醇系结构最为简单的饱和一元醇,被认为是重要的化石能源而备受瞩目[1-2]。在化工、医药、轻工、纺织以及运输等行业均有广泛的应用。甲醇作为偶合能量和物质价值链的中心分子,已有学者提出了“甲醇经济”的观点。甲醇作为环境友好的清洁能源,可以作为内燃机的燃料,广泛应用于甲醇燃料电池(DMFC)[3]。还可以直接做燃料,也可以合成燃料添加剂甲基叔丁基醚[4-6]。同时甲醇还可以合成甲酸、二甲醚、醋酸、甲胺、聚乙烯醇等众多化工产品。因此,合成甲醇的研究已受到格外关注。早在1994年,在Clariant的试点工厂已经开始使用非均相催化剂催化氢化二氧化碳合成甲醇,转化率约为 35%~45%。2012年,Behrens等报道了多成分非均相催化剂将CO/CO2转化为甲醇,TOF为75.6 h-1。均相催化反应比非均相催化反应具有反应条件温和、活性高及催化体系易于调控等优点,二氧化碳均相催化加氢具有广阔的应用前景。Milsteins课题组和丁奎岭课题组分别提出了采用Ru络合物催化氢化和成甲醇的研究,其TOF值分别高达2500 h-1和1200 h-1。
本文将结合本科研团队先前的理论研究[7-8],计算研究CO2催化加氢合成甲醇的反应机理。为CO2羰基化合成甲醇反应提出可靠的理论支撑。
1 计算方法
采用B3lYP方法,在6-311+G(2d,p)基组上,对反应势能面上的反应物,中间体,过渡态和产物的构型进行全参数优化,并通过频率分析证实了各反应物,中间体和产物的能量是局部极小,各过渡态构型有唯一振动虚频。通过对每一个鞍点进行内禀反应坐标(IRC)计算,证实了反应坐标分别生成产物和反应物。全部计算工作采用Gaussian09程序完成,分子的几何构型全部由Gauss View程序从计算结构直接转换而来。
2 结果与讨论
各反应物、中间体、过渡态及产物的主要结构参数见图1。图2是钴羰基络合物催化甲醇羰基化合成甲酸甲酯反应路径示意图,图3为非催化反应的甲醇羰基化合成甲酸甲酯的反应路径。
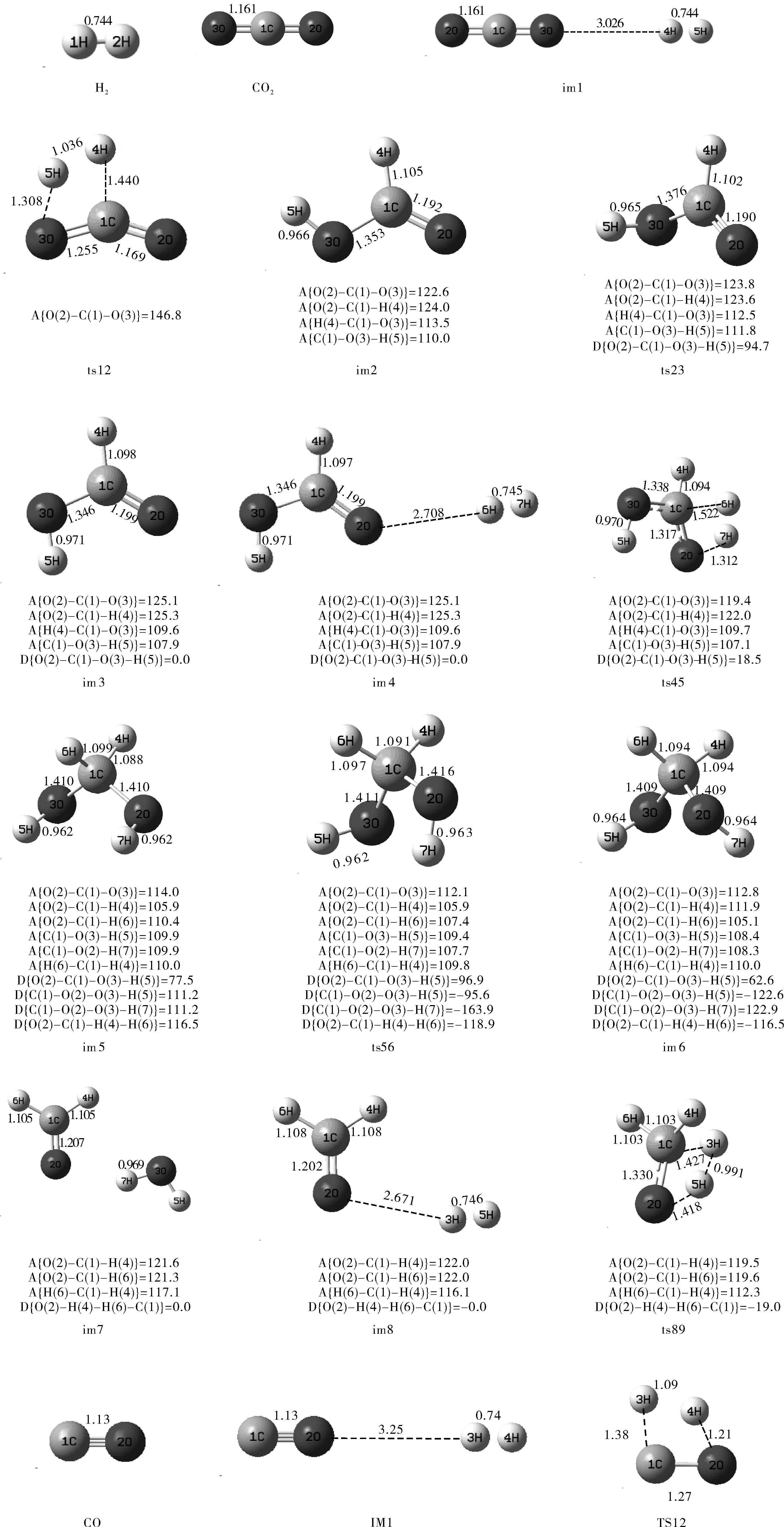
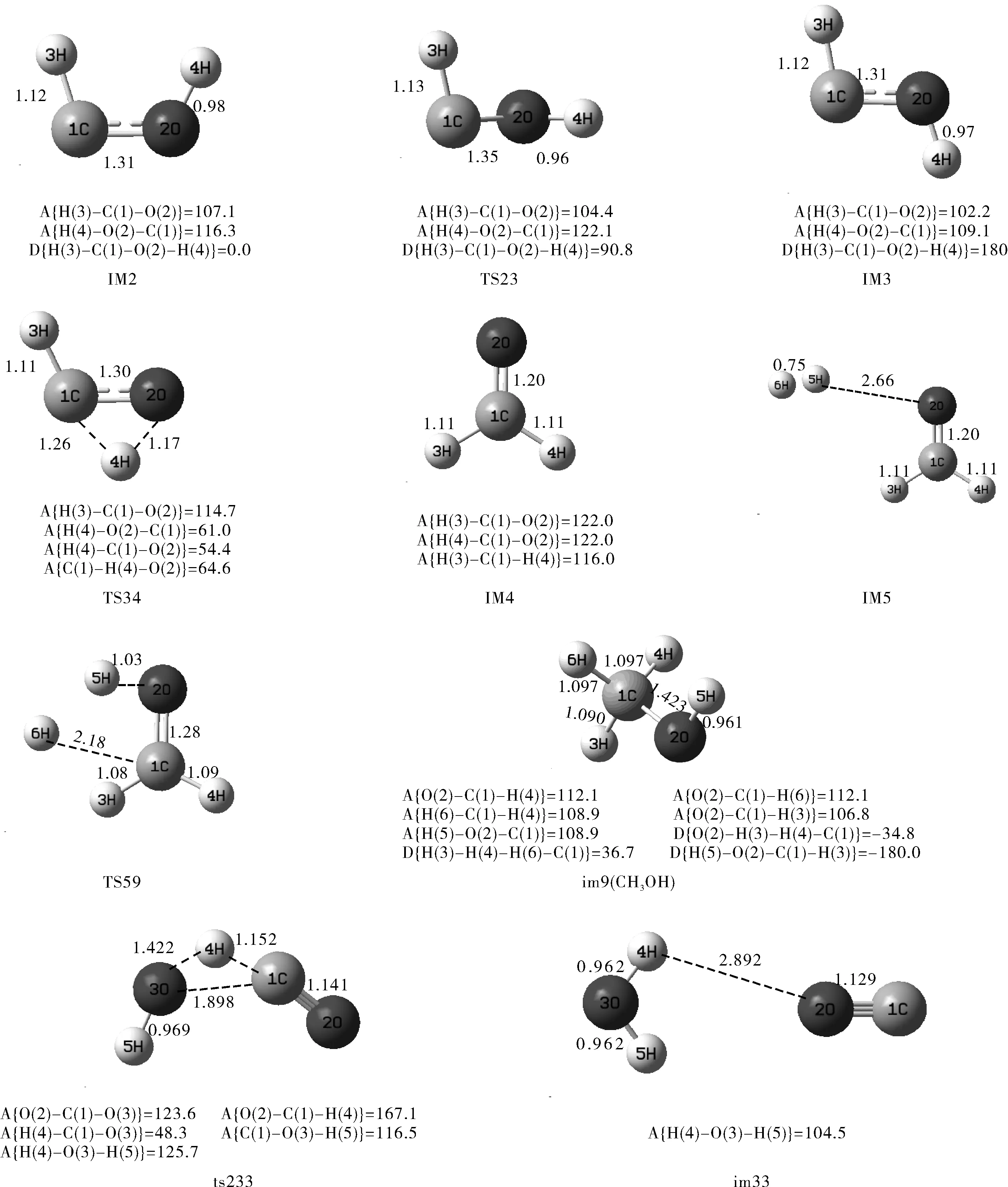
图1 反应物、中间体、过渡态和产物的几何构型 (键长Å,键角°,二面角°)Fig.1 Geometries of the critical on the potential energy surface (bond length in angstrom,bond
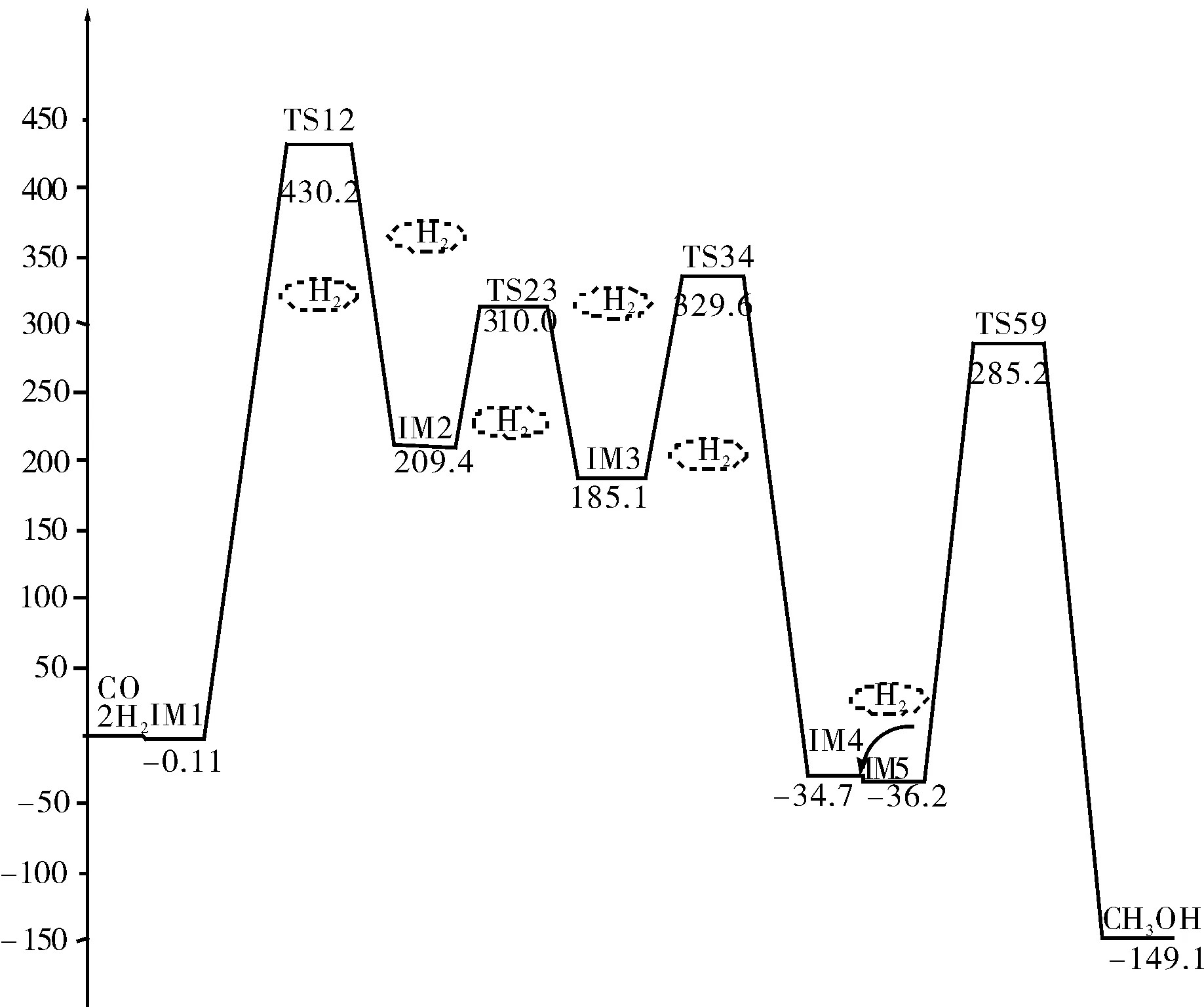
图2 CO合成甲醇反应能量路径示意图Fig.2 Diagram for the energy of CO synthesis of methanol eaction path
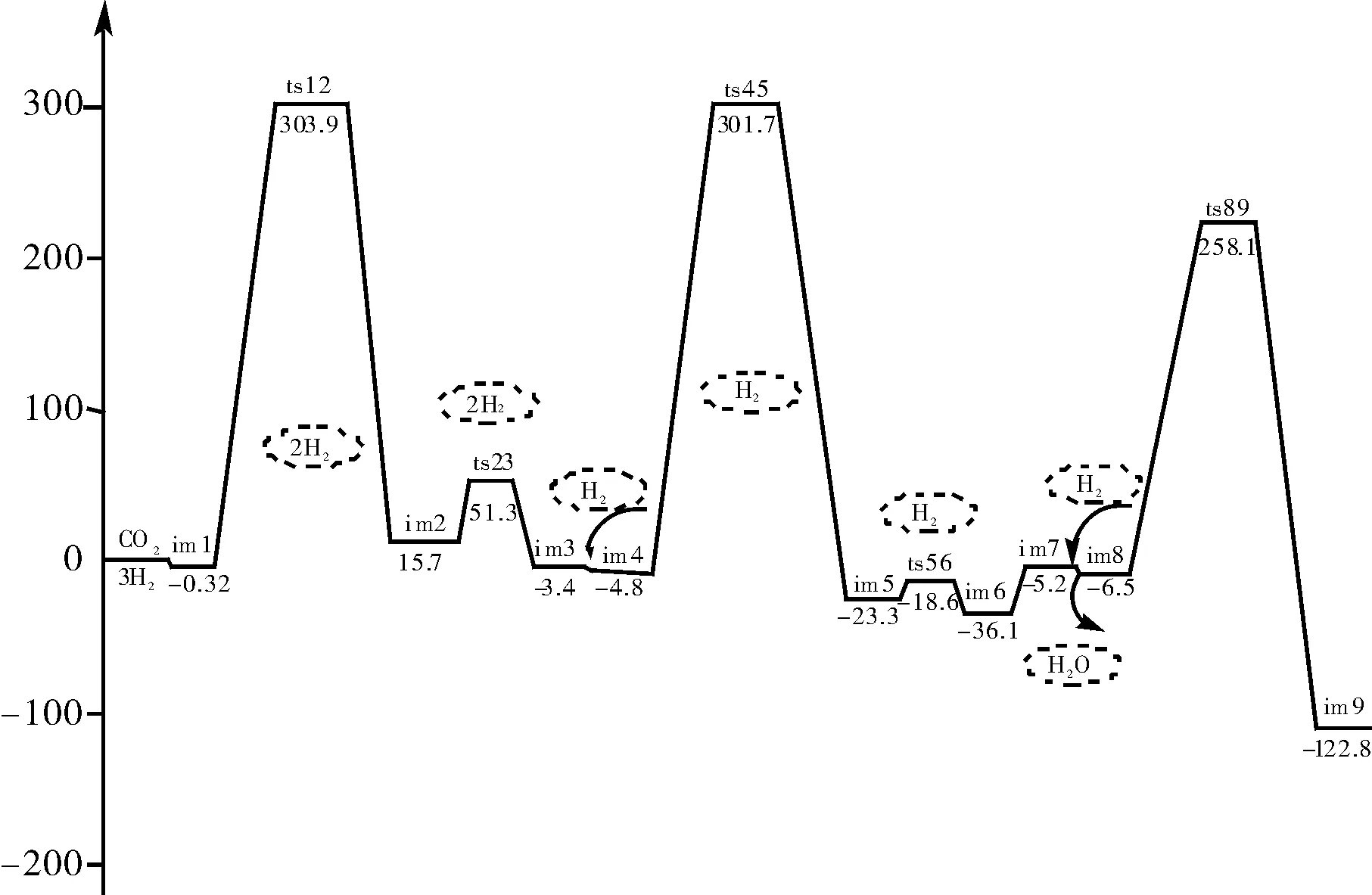
图3 CO2合成甲醇反应能量路径示意图Fig.3 Diagram for the energy of CO2 synthesis of methanol eaction path
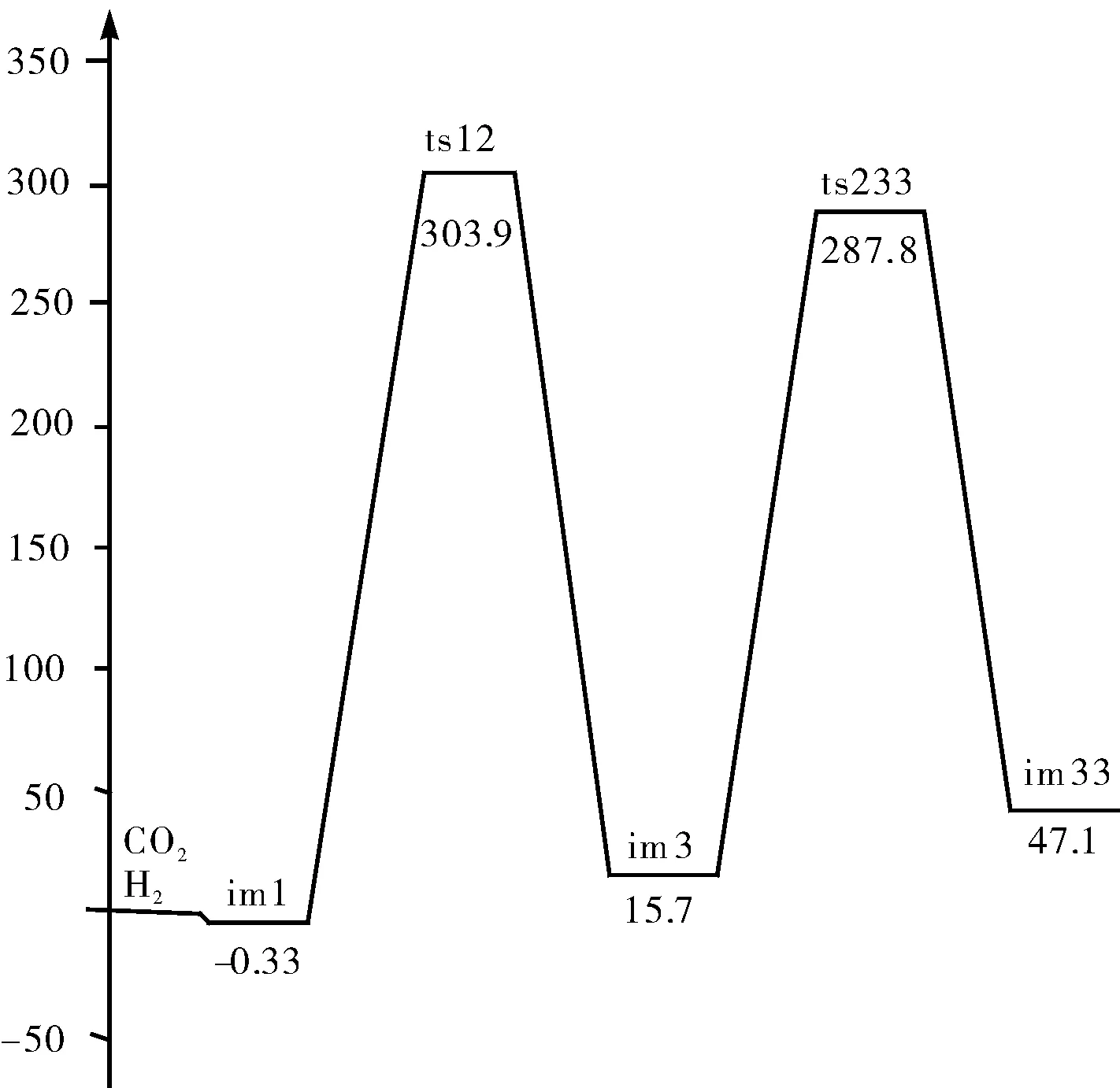
图4 CO/CO2相互转化反应能量路径示意图Fig.4 Diagram for the energy of CO/CO2 reciprocal conversion reaction eaction path
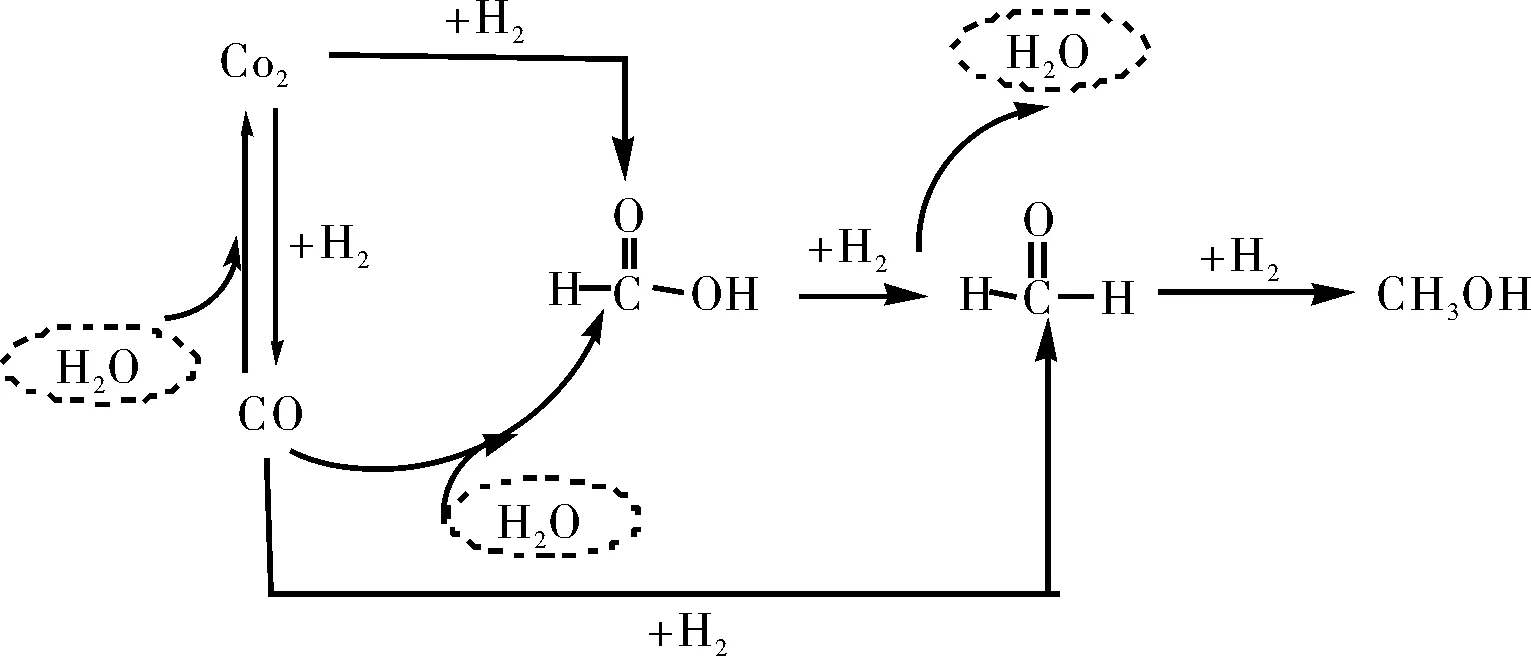
图5 CO/CO2羰基化合成甲醇的反应机理Fig.5 Reaction mechanism of carbonylation of CO/CO2 into methanol
2.1 反应历程
如图1所示,其中CO合成甲醇的路径有两条:


CO2合成甲醇的路径有一条:


2.2 反应机理分析
2.2.1 CO合成甲醇的反应
对CO 合成甲醇反应途径优化过程中,对中间体和过渡态进行了振动分析,结果表明优化后的各中间体为能量极小点,无虚频。对优化后的两个加氢反应的过渡态TS12和TS59,进行振动分析,得到对应仅有一个负值的唯一虚频。TS12的虚频为2481.69i cm-1,TS59的虚频为1300.92i cm-1。对两个过渡态进行振动分析,过渡态TS12的虚频振动模式指向中间体IM1和IM2,过渡态TS59的虚频振动模式指向中间体IM5和产物甲醇。说明这些驻点均位于正确的反应途径上。
具体反应机理如下:一分子H2首先加成到CO分子上,经氢原子异构重排后形成中间体IM4,即甲醛构型。形成了一个碳氧双键,沿反应路径,再引入一分子H2,两个氢原子分别加成到甲醛分子的碳氧双键两边, C(1)-O(2)键拉长,从1.20A经过渡态拉长到1.28A,最终变为C(1)-O(2)单键,键长为1.423A。二面角O(2)-H(3)-H(4)-C(1)由复合物im8的0°变为-34.8°。体系完成整个反应共放出能量149.1 kJ/mol。
2.2.2 CO2合成甲醇的反应
在反应途径优化过程中,对中间体和过渡态进行了振动分析,结果表明优化后的各中间体为能量极小点,无虚频。对优化后的三个过渡态ts12、ts45和ts89,进行振动分析,得到对应仅有一个负值的唯一虚频。ts12的虚频为429.3535i cm-1,ts45的虚频为471.7807i cm-1,ts89的虚频为153.3664 i cm-1。对三个过渡态进行振动分析,过渡态ts12的虚频振动模式指向中间体im1和im2,过渡态ts45的虚频振动模式指向中间体im4和im5,ts89的虚频振动模式指向中间体im8和产物甲醇。说明这些驻点均位于正确的反应途径上。
具体反应机理如下:一分子H2首先加成到CO2分子上,形成中间体im3,即甲酸构型。形成了一个碳氧双键和碳氧单键, O(2)-C(1)-O(3)的键角由原来的180.0°变为 125.1°,沿反应路径,再引入一分子H2,加成在碳氧双键上,C(1)-O(2)键拉长,从1.399A经过渡态拉长到1.317A,最终变为C(1)-O(2)单键,键长为1.409A。经过结构的优化,最终形成中间体im6,该中间体脱去一分子水之后形成甲醛,再在碳氧双键上引入一分子H2,形成复合物im8,O(2)-H(3)键长2.631A,因此两分子间作用力极弱,仅存在分子间微弱的吸引,沿着反应路径,H2分子逐渐靠近甲醛分子,两个氢原子分别加成到甲醛分子的碳氧双键两边,碳氧双键键长拉长,变为碳氧单键,二面角O(2)-H(4)-H(6)-C(1)由复合物im8的0°变为-34.8°。体系完成整个反应共放出能量122.8 kJ/mol。
2.2.3 CO与CO2相互转化的反应
从图2 CO合成甲醇反应能量路径示意图中过渡态的位垒可以明显的看出,两个过渡态的位垒分别为:430.2/mol和285.2 kJ/mol;从图3 CO2合成甲醇反应能量路径示意图中过渡态的位垒可以明显的看出,三个过渡态的位垒分别为:303.9 kJ/mol、301.7 kJ/mol和258.1 kJ/mol;经过比较可以看出,CO2羰基化合成甲醇所需能量较低,反应更容易发生。同时在反应过程中伴随有CO和CO2相互转化的过程。
3 结 语
采用密度泛函B3LY方法,在6-311+G(2d,p)上,系统研究了CO/CO2羰基化合成甲醇的反应机理,得出以下结论:
(1)CO2合成甲醇的反应中主要能垒为ts12和ts89,能垒整个过程分三步进行反应,分别为甲酸的生成、甲醛的生成和甲醇的生成。反应活化能分别为:303.9 kJ/mol、301.7 kJ/mol和258.1 kJ/mol,完成整个反应过程共放热122.8 kJ/mol;
(2)CO合成甲醇的反应中主要能垒为TS12 、TS34和TS59,反应过程中仅生成中间产物甲醛。三个主要能垒的反应活化能分别为:430.2 kJ/mol、329.6 kJ/mol和285.2 kJ/mol,完成整个反应过程共放热149.1 kJ/mol;
(3)CO与CO2的相互转化过程,其主要能垒为ts12和ts233,反应活化能分别为:303.9 kJ/mol、287.8 kJ/mol,反应从CO2向CO转化为放热反应,共放出热量47.1 kJ/mol。

