水质样品分析中pH值平均值的计算探讨
张利敏,万莉莉,李长彬
(上海威正测试技术有限公司,上海 201600)
pH值是环境检测中常用的检测项目之一。pH值平均值在以下情况可能会用到,实验室在进行质量控制时测定平行样,进行方法验证时相对标准偏差计算,pH值平均值如何计算?有的人员用pH测定值进行算术平均值,有的人用[H+]加权平均,还有的从酸碱中和水电离平衡进行计算[1-2]。这些算法都有各自的条件,如果条件发生改变,有些算法就会发生较大的偏差,甚至会产生不符合实际的结果。
pH值定义为水中氢离子活度的负对数,pH=-lgaH+[3]。 在日常工作中,我们采用电极法测定pH值,实际上是氢离子活度取负对数后的数值,在稀溶液中氢离子活度约等于氢离子的浓度,因此可用氢离子浓度来进行计算。
在实际生产中,本研究通过不同的理论计算方法与实验检测相结合的方法进行验证,现将方法与结果报道如下:
1 试剂与仪器
1.1 试 剂
(1)标准缓冲溶液Ⅰ:c(C8H5KO4)=0.05 mol/L,pH=4.00(25 ℃);
(2)标准缓冲溶液Ⅱ:c(Na2HPO4)=0.025 mol/L,c(KH2PO4)=0.025 mol/L,pH=6.86(25 ℃);
(3)标准缓冲溶液Ⅲ:c(Na2B4O7)=0.01 mol/L,pH=9.18(25 ℃)。
购买市售合格标准缓冲溶液,按照说明书使用。
1.2 仪 器
采样瓶(聚乙烯瓶);酸度计(精度为 0.01 个 pH 单位,具有温度补偿功能,pH 值测定范围为 0~14);电极(复合 pH 电极);烧杯;一般实验室常用仪器和设备。
2 方法与结果
2.1 校 准
采用两点校准法,按照仪器说明书选择校准模式,先用中性(或弱酸、弱碱)标准缓冲溶液,再用酸性或碱性标准缓冲溶液校准。
(1)将电极浸入第一个标准缓冲溶液,缓慢水平搅拌,避免产生气泡,待读数稳定后,调节仪器示值与标准缓冲溶液的 pH 值一致。
(2)用蒸馏水冲洗电极并用滤纸边缘吸去电极表面水分,将电极浸入第二个标准缓冲溶液中,缓慢水平搅拌,避免产生气泡,待读数稳定后,调节仪器示值与标准缓冲溶液的 pH值一致。
(3)重复步骤(1)操作,待读数稳定后,仪器的示值与标准缓冲溶液的 pH值之差应≤0.05 个pH单位,否则重复步骤(1)和(2),直至合格。
注 1:酸度计 1 min 内读数变化小于 0.05 个 pH单位即可视为读数稳定。
2.2 测 定
用蒸馏水冲洗电极并用滤纸边缘吸去电极表面水分,实验室测定时将样品沿杯壁倒入烧杯中,立即将电极浸入样品中,缓慢水平搅拌,避免产生气泡。待读数稳定后记下 pH值。具有自动读数功能的仪器可直接读取数据。每个样品测定后用蒸馏水冲洗电极[4]。
对一个样品进行重复测定值可视为一个随机变量,在数理统计理论上,任何随机变量的分布规律决定了其平均值的计算方法和结果。如果随机变量呈正态分布时其均值应取算术平均值[1]。当溶液中[H]+或[OH]-一种离子的浓度大于等于 1 mol/L时,就不能再用pH值,而需要直接使用它们的离子浓度来表示酸碱度。当一定比例的弱酸和弱酸盐,弱碱和弱碱盐配制成的缓冲溶液,它们可以抵抗少量强酸、强碱的作用,维持溶液的pH值几乎不变[5]。它们的pH值,受内部弱酸、弱碱分子的电离平衡机制主导,本文不加讨论。
(1)算术平均值
在环境分析中计算测定结果的平均值,算术平均值是最常见的方法。其计算式为:
(2)从化学原理考虑,pH值是溶液中氢离子浓度[H+],那么pH值平均值应是溶液中氢离子浓度的平均值[H+]平均:
pH=-lg[H+]
pH平均=-lg[H+]平均
(3)考虑酸碱中和后剩余[H+]的加权算术平均
酸性溶液以[H+]、碱性溶液以[OH-]计算,假设溶液体积相同,计算公式可简化为:
当[H+]>[OH-]时,
当[OH-]>[H+]时,
(4)同一样品的多次测定,宜采用算术平均值计算
在相同条件下,对同一样品pH值进行多次测试所产生的误差都很小,一般不会超过仪器自身的测量误差,因此对于同一样品进行多次pH值测定时,方法(1)、(2)结果基本没有差异,二者均可使用。但用方法(1)算术平均值计算pH值平均值,此法相对简便、高效。结果详见表1、表2。

表1 pH值平均值不同计算方法结果Table 1 Results of different calculation methods for average pH value

表2 pH值平均值不同计算方法结果Table 2 Results of different calculation methods for average pH value
通过对表1、表2结果分析,对同一样品进行多次分析测定,算术平均值和用[H+]平均进行计算,结果一致。
(5)对于一组极差较大的样品
对于极差较大,样品均为酸性溶液,从表3可以看出,其平均值的计算方法(2)与实际结果更接近;对于极差较大,样品中有酸性、有碱性的溶液,其平均值的计算,从表4可以看出,方法(1)和(3)已不符合实际情况,需考虑酸碱中和、电离平衡等因素的影响。
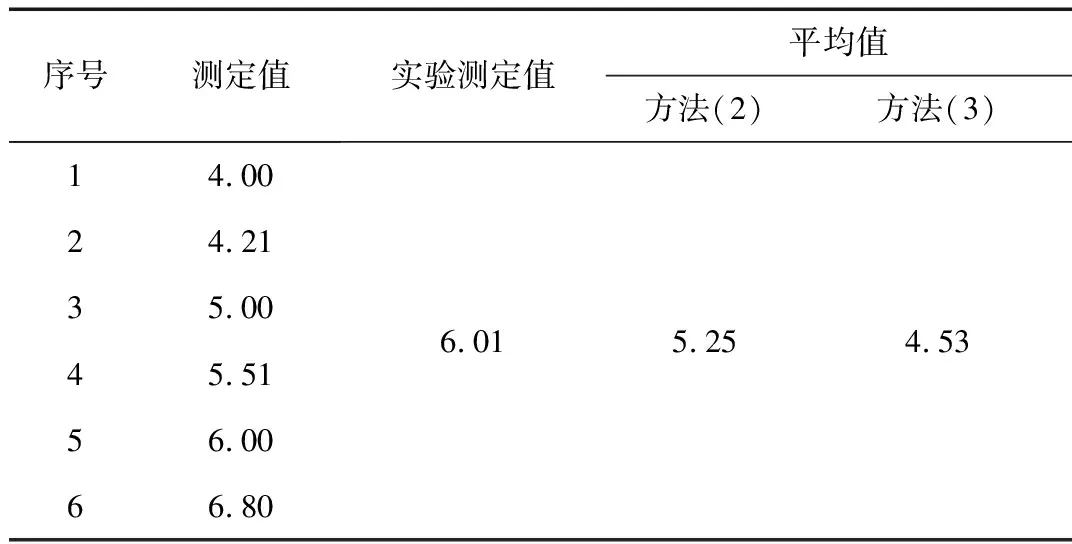
表3 pH值平均值不同计算方法结果Table 3 Results of different calculation methods for average pH value
通过对表3结果分析,对于同为酸性的样品pH值极差较大的溶液,用[H+]平均进行计算与实际结果相对接近,但也不能较好的反应实际情况。
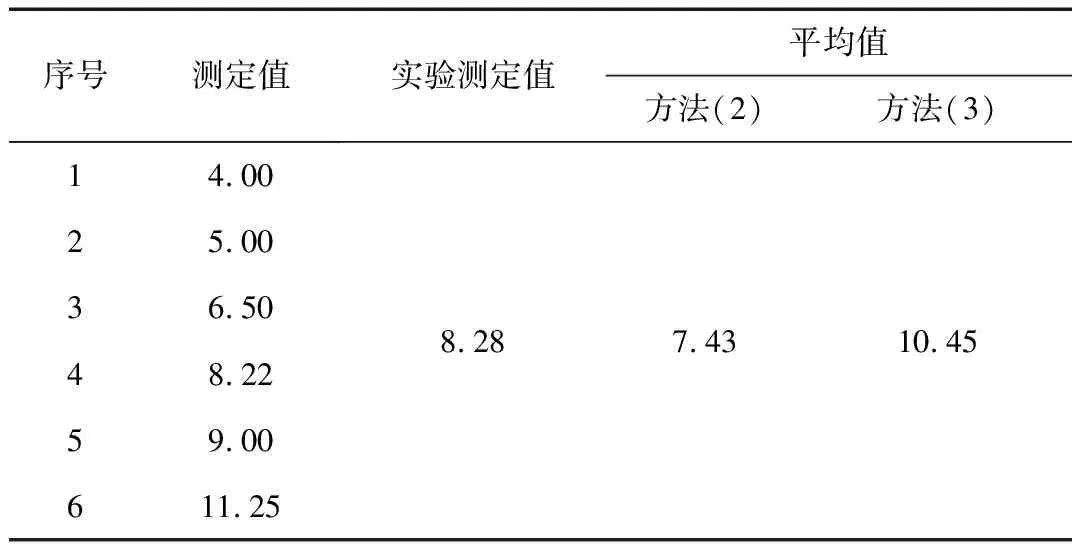
表4 pH值平均值不同计算方法结果Table 4 Results of different calculation methods for average pH value
通过对表4结果分析,跨越酸碱性的样品溶液,通过计算求其平均值已不符合实际情况,需考虑酸碱中和、电离平衡等因素的影响。
3 结 论
对于水质样品进行平行样分析时,HJ 1147-2020质量控制与质量保证中规定测定结果取第一次测定值[4]。对于未做具体规定的标准,笔者认为同一样品的平行样分析可以以二者算术平均值报出。在进行pH值方法验证时,验证其精密度时用到的pH值平均值,因其对于同一样品进行多次测定,可用各pH值测定值进行算术平均值报出,计算结果简单、准确。
对于一组样品中样品pH值极差较大的溶液,若均为酸性或碱性,用[H+]或[OH-]的加和进行计算相对符合实际情况;日常检测中工厂排污口排放的废水不同时间段的pH值可能既有酸性又有碱性,则需要考虑酸碱中和后剩余[H+]以及电离平衡等因素,需再做进一步的讨论。

