CO2腐蚀及其缓蚀剂应用研究进展
刘畅,陈旭,杨江
(1 辽宁石油化工大学石油天然气工程学院,辽宁 抚顺 113001;2 辽宁石油化工大学石油化工学院,辽宁 抚顺 113001;3 西安石油大学石油工程学院,陕西 西安 710065)
在油气田环境中CO2常作为天然气或者石油的伴生气组分而存在。此外,工程上常通过CO2驱油技术(CO2-EOR)及油气层酸化的过程提高原油采收率,这导致了油气中CO2的含量较高。干燥的CO2并没有腐蚀性,当其溶于水后生成碳酸,在pH相同的情况下,碳酸的总酸度比盐酸更高,对油井管材与地面集输系统具有比盐酸更强的腐蚀性[1]。CO2腐蚀严重影响着石油工业的发展。在实际生产运输中,常通过正确选材、涂层、镀层、改进工艺及添加缓蚀剂等方法来进行CO2腐蚀防护,其中添加缓蚀剂的效果尤为突出。因此,开发优秀的缓蚀剂以延长油气田设备的使用寿命,对石油化工行业的发展有着十分重要的意义[2]。
1 CO2腐蚀研究进展
1.1 CO2腐蚀机理
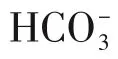

钢在含有CO2的水溶液中的腐蚀是一个非均质过程,是其表面同时发生的一系列自发电化学反应的结果。通过阳极氧化导致固体Fe 溶解到水相,并释放电子。产生的电子被同时发生的阴极(还原)反应消耗,使过程继续进行。目前普遍接受的CO2腐蚀的阴极反应如式(6)~式(9)所示[4]。

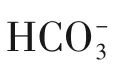

而也有学者认为在腐蚀过程中,腐蚀的初步产物并非FeCO3而是首先生成Fe(HCO3)2,进一步水解生成FeCO3
[6],反应步骤见式(11)、式(12)。
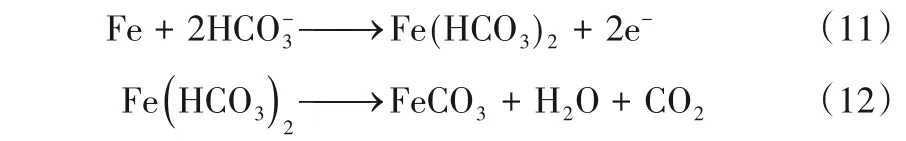
陈长风等[7]同样认为在生成最终产物之前,生成其他产物,但他们认为首先生成的是Fe(OH)2,反应过程见式(13)、式(14)。

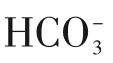
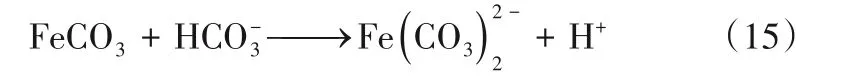
腐蚀过程总反应见式(16)[9]。

1.2 CO2腐蚀的影响因素
CO2腐蚀情况复杂,腐蚀形态分为均匀腐蚀和局部腐蚀,腐蚀过程受多种因素影响,如CO2分压、温度、pH、介质成分及流速流态对CO2腐蚀均有影响。
1.2.1 CO2分压
CO2分压直接影响腐蚀速率,并且有一定的决定性作用。目前也是CO2腐蚀强度的主要判定依据。Long 等[14]的研究结果表明,当CO2分压达到0.021MPa 时,即可发生腐蚀,CO2分压增大至0.05MPa 时出现点蚀。Aria 等[15]的研究结果表明,当CO2分压由0增加到0.1MPa,腐蚀电流密度仅轻微增加,继续增加CO2分压至0.5MPa,溶液中H2CO3的浓度增加,CO2水化反应的作用变得更加明显,从而导致腐蚀电流密度显著提高。CO2分压的增大的确促进了腐蚀过程的进行,但并不是在所有压力范围内都产生单调趋势影响。崔怀云等[16]研究发现,CO2分压力对N80 油管钢的腐蚀速率的影响存在一个拐点。温度为25℃时,拐点约为1MPa:CO2分压<1MPa 时,腐蚀速率较快且腐蚀程度严重;CO2分压>1MPa 时,腐蚀速率反而下降。Bai等[17]在更大的CO2分压范围内研究了其对腐蚀过程的影响,结果发现拐点为1.5MPa。CO2分压<1.5MPa时腐蚀速率急剧增加;但CO2分压为1.55MPa 时腐蚀速率略有降低;随着CO2分压的持续升高,腐蚀速率再次升高;CO2分压达到9.0MPa后腐蚀速率基本保持不变。
1.2.2 温度
温度一般通过影响CO2溶解度和反应物与生成物间的传质速度而间接影响腐蚀速率。温度的升高虽能促进反应的进行,但随着反应的进行,产物膜FeCO3的形成速度也将加快,从而阻止腐蚀反应的进行。张磊[18]认为温度通过影响CO2在溶液中的溶解度,对腐蚀过程产生两方面影响:一方面,腐蚀产物膜的形成抑制了由温度升高促进的腐蚀过程,降低了均匀腐蚀速率;另一方面,在形成腐蚀产物膜的过程中存在条形或蜂窝状的裂纹,促进了局部腐蚀过程。温度对腐蚀过程的影响同样存在拐点,在形成致密腐蚀产物膜之前,温度升高推动反应进行的能力大于产物膜对反应的抑制能力。黄天杰[19]研究了温度对P110钢在饱含CO2/H2S水介质中的腐蚀行为的影响,发现腐蚀速率随温度的升高先升高后降低,拐点为50℃。这是由于温度超过临界值50℃后,金属表面的产物膜由疏松多孔变为晶态致密,从而达到良好的保护效果。李岩岩等[20]研究了超临界CO2条件下温度对N80 钢腐蚀行为的影响,同样发现腐蚀速率存在拐点:在温度低于40℃时不利于钢表面生成腐蚀产物膜,随着温度的升高虽加速了金属的初期腐蚀,同时也促进了产物膜FeCO3的形成,使产物膜完整致密,拥有良好的保护性。不同学者得到的拐点值不同,这可能是由实验条件不同造成的。Rizzo等[21]通过电化学实验及X射线断层扫描研究了1Cr 碳钢在40℃和80℃下的CO2腐蚀行为,结果表明,40℃时试样的腐蚀速率要比80℃时高10倍。温度较高时,较高的FeCO3过饱和度导致了FeCO3的加速沉淀形成保护性沉淀膜,腐蚀形态表现为均匀腐蚀;在低温情况下,由于FeCO3层的稳定性不同,此时形成的产物膜疏松多孔,保护性不佳,促使金属发生局部腐蚀。
1.2.3 溶液pH
pH 并不直接影响腐蚀速率,而是通过影响阴极的析氢反应及表面产物膜的扩散溶解过程,从而对腐蚀速率产生影响。一般来说,pH 增大,氢离子浓度降低,抑制氢的还原反应,从而降低腐蚀反应的速率。并且随着pH 的升高,FeCO3的溶解度下降,使基体表面附近的Fe2+沉积为FeCO3膜[22-23]。Zhu 等[24]研究了低铬钢CO2阴极腐蚀机理,结果表明,当介质pH 小于3.5 时,阴极反应主要为H+的还原反应,腐蚀过程处于扩散控制下;当pH 增大至3.5~5 范围内,阴极反应为H+及H2CO3的还原,此时腐蚀处于混合控制(活化-扩散控制)下;当pH 大于5 后,阴极过程与H+无关,阴极主要发生H2CO3的还原,腐蚀主要受活化控制。龙凤乐等[25]研究了pH 对X65 钢在CO2环境下均匀腐蚀规律的影响,实验中通过加入一定量的NaHCO3来增大溶液的pH,实验结果表明,随着溶液中NaHCO3含量的增加,溶液的pH增大,腐蚀速率呈负指数下降。杨壮春等[26]研究了不同pH对X65管线钢CO2腐蚀的影响,结果表明,pH为4.0时的金属表面腐蚀产物膜形成不良导致腐蚀速率较快,而在pH 为6.6 时,表面能够形成保护性致密腐蚀产物膜。
1.2.4 溶液成分
此外,部分溶解性气体的存在,可能使CO2腐蚀更加严重。O2的存在通常能够改变腐蚀产物膜的成分。鲁群岷等[30]研究了溶解氧对X80 钢在含CO2油田介质环境中腐蚀行为的影响,结果表明,在仅含有CO2的环境中,金属表面生成致密的FeCO3产物膜,但当O2参与反应过程,基体表面将生成疏松的Fe2O3膜,诱发局部腐蚀。图1为O2对CO2腐蚀产物膜破坏机理。Xia等[31]研究了O2对3Cr钢在CO2环境中冲刷腐蚀的影响,结果表明,腐蚀环境中的O2对Cr 富集情况也有影响,相比于CO2环境,在CO2-O2环境中金属表面生成保护性较弱的产物膜,由FeCO3、Fe2O3、Fe3O4和少量非晶态产物组成,并且腐蚀产物中几乎没有Cr富集。除O2外,H2S气体也是CO2腐蚀的重要影响因素。H2S 溶于水后产生大量H+降低溶液pH,从而促使基体发生腐蚀[32]。Javidi 等[33]研究了H2S 对敏化和非敏化304 和316 不锈钢的CO2腐蚀行为的影响,结果表明,在H2S 的浓度达到200×10-6时腐蚀速率明显增加,并且会出现点蚀。Lee[34]研究结果表明,CO2中的H2S 浓度在(0~340)×10-6的范围内,在H2S的浓度极低(约10×10-6)的条件下,金属的腐蚀过程受到抑制,反应完全由H2S 控制。Li 等[35]研究了H2S 和CO2共存下H2S浓度对管线钢腐蚀行为的影响,同样发现在加入H2S 浓度较小时,腐蚀速率从0.34mm/a 下降为0.25mm/a,但随着H2S浓度的继续增加,金属表面形成疏松产物膜并且结合力差,诱使发生电偶腐蚀。
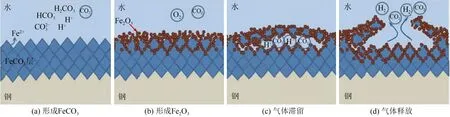
图1 O2对CO2腐蚀产物膜破坏机理
1.2.5 介质的流速及流态
除上述环境因素外,介质的流速及流态对CO2腐蚀过程也有一定影响。一般在低流速时形成较均匀的防护膜,随着流速的增大,防护膜覆盖不均匀造成局部腐蚀,即点蚀坑。相较于静态条件,动态条件下流动的介质能够使腐蚀产生的离子迅速离开基体附近,并且流动产生的剪切力可能会破坏已经产生的腐蚀产物膜,促进反应发生。Zhang 等[36]研究了N80 碳钢在动态超临界CO2-水环境下的腐蚀行为,结果表明,动态条件下保护性腐蚀产物膜的形成受到阻碍,从而导致腐蚀速率增大。但也有研究发现,随着流速的增加,金属的耐蚀性增大[37-38],原因在于随着流速的增加,金属表面逐渐生成薄而致密的保护性Fe3O4膜。若流速继续增大,流态也将发生相应的变化,可能从层流状态变为湍流。当流态为湍流时,金属易发生汽蚀,腐蚀速率较快[39]。可见流速的初步增大对腐蚀有促进作用,但增大到一定范围内反而会抑制腐蚀过程的进行,而当流态变为湍流后,腐蚀速率又将剧增。
2 抑制CO2腐蚀缓蚀剂的研究进展
2.1 常见抑制CO2腐蚀缓蚀剂及其作用机理
目前对于抑制CO2腐蚀的缓蚀剂的应用,含N化合物类缓蚀剂种类最多且用量最大,其中包括咪唑啉及其衍生物类、季铵盐类、有机胺类等,除此之外,含S化合物类缓蚀剂、含P化合物类缓蚀剂等也应用于CO2环境。
2.1.1 咪唑啉衍生物类缓蚀剂
咪唑啉衍生物分子主要包括咪唑啉环、R1链及R2侧链,三部分都起着重要的作用,其结构式见图2[40]。
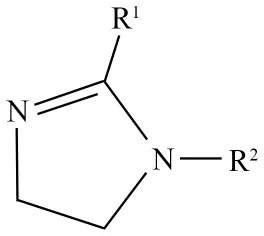
图2 咪唑啉衍生物分子结构
咪唑啉环、侧链和引入的其他基团使分子产生多个吸附位点及疏水基团[41]。由于咪唑啉环上存在带有孤电子对的N原子,能够与基体表面原子形成配位键而化学吸附于金属表面。分子中R1链引入烷基疏水链,能够将腐蚀介质与金属隔开。侧链引入的氨基乙撑,增强了疏水性及黏附力,在CO2/H2S 环境中缓蚀率可达86.8%[42]。Okafor 等[43]研究了2-十一烷基-1-乙基氨基咪唑啉(2UEI)在饱和CO2的NaCl溶液中对N80碳钢的缓蚀行为,结果表明,2UEI 化学吸附于金属表面,在浓度为80mg/L时其缓蚀效率最高可达90.89%。咪唑啉衍生物的缓蚀能力与碳链长度、流速及其浓度均有关系。赵桐等[44]研究了碳链长度对咪唑啉衍生物在高压CO2环境中缓蚀性能的影响,发现咪唑啉衍生物分子中的烷基链越长,膜的疏水性越好,黏附力越大。在烷基疏水链中引入双键可以提高疏水性及吸附稳定性。针对咪唑啉环与其性能之间的关系,张晨峰等[45]研究了多环咪唑啉的合成及其缓蚀作用,发现合成的四环咪唑啉缓蚀剂(LAI)在饱和CO2的模拟溶液中的缓蚀效果要比双环咪唑啉缓蚀剂(SAI)更好,并且在添加量为400mg/L时,缓蚀效率达到最高为93.87%。
2.1.2 季铵盐类缓蚀剂
季铵盐又名四级铵盐,单体常应用于杀菌。用于抑制CO2腐蚀的季铵盐大多为咪唑啉季铵盐类,咪唑啉季铵盐类比咪唑啉单体缓蚀效果更好,N+的引入提高了亲水性及成膜能力。陈庆国等[46]研究了一种二酰氨基吡啶季铵盐的合成,并通过浸泡实验及电化学实验在含CO2模拟油田水中评价了该缓蚀剂的缓蚀性能。结果表明,该种缓蚀剂在添加量为50mg/L 时,对L245NCS 钢的缓蚀效率可达96.91%,缓蚀性能良好。图3 为添加50mg/L 缓蚀剂前后L245NCS钢点蚀的3D形貌。
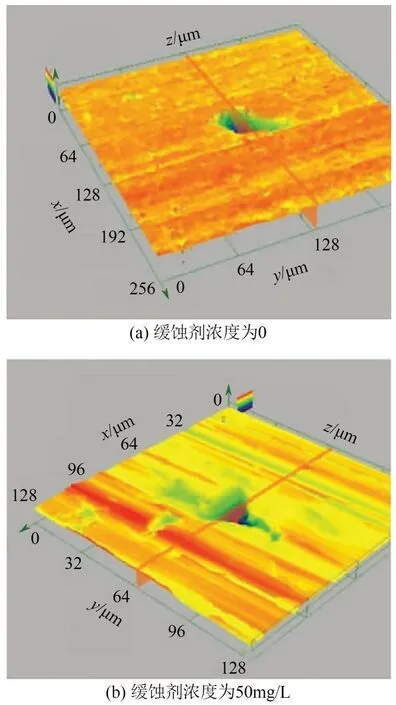
图3 在添加缓蚀剂前后L245NCS钢点蚀的3D形貌
董猛等[47]研究了高温高压CO2/H2S 条件下季铵盐缓蚀剂的缓蚀效果,结果显示金属表面形成了一层具有良好抗腐蚀性且成分稳定、不易分解的有机膜。但是,对高温条件下缓蚀剂的选择还需考虑对FeCO3的影响。Michael[48]研究表明,在60~70℃时,氯化二甲基芐基烃铵(C14)缓蚀剂具有良好的缓蚀效果,但温度达到80℃时,该种缓蚀剂促进腐蚀。
2.1.3 有机胺类缓蚀剂
有机胺类缓蚀剂中含有N原子,N原子可以在金属表面吸附,从而起到缓蚀作用。酰胺类缓蚀剂是常用的有机胺类缓蚀剂之一,其毒性低且生物降解性好。酰胺分子可占据多个活性位点进行吸附,羰基和氨基亲水基团吸附在基体表面,烷基作为疏水屏障将腐蚀介质与金属隔离开[49-50]。由于分子中存在酰胺键,使其在较宽pH 范围内有良好的耐水解性。杜海燕等[51]合成了棕桐双酰胺并评价了其抗CO2腐蚀性能,结果表明,其在饱和CO2油田采出液中具有良好的缓蚀作用,并且在160℃以下有较好的热稳定性,缓蚀效率最高可达83%以上。此外,脂肪酰胺无毒易降解,在用量较少时也能达到不错的缓蚀效果,符合绿色、高效型缓蚀剂要求[52-53]。在实际应用中,有机胺类缓蚀剂还可以作为杀菌剂用于CO2油田采出水中,在抑制CO2腐蚀的同时阻止铁氧化菌的生长,达到双重防腐的效果。刘宏伟等[54]研究了CO2和硫酸盐还原菌(SRB)共存条件下十二胺缓蚀剂对20 钢的缓蚀作用,结果表明,当缓蚀剂浓度达到100mg/L时,SRB的活性得到明显的抑制,从而减轻金属的均匀腐蚀。
2.1.4 表面活性剂类缓蚀剂
表面活性剂类缓蚀剂分子中具有极性基团和非极性基团的结构特征,极性基团吸附于金属基体表面,非极性基团排列于介质中,从而将腐蚀介质与金属基体分隔开。例如,表面活性剂十六烷基三甲基溴化铵(CTAB)可在铁表面形成保护膜,达到缓蚀效果[55]。吴亚等[56]合成了一种阳离子Gemini表面活性剂,命名为3,5-双(亚甲基十二烷基二甲基氯化铵)-1,2,4-三氮唑(12-triazole-12),并对其抑制CO2腐蚀性能进行研究,结果表明,此种缓蚀剂先物理吸附于金属表面,随后转为化学吸附,在金属表面形成稳定吸附层。在加入的12-triazole-12浓度为300mg/L 时,缓蚀效果最佳。赵景茂等[57]在表面活性剂的基础上进行改良合成了双子表面活性剂,通过引入了羟基增强了水溶性,并评价了其对Q235 钢在CO2饱和盐水溶液中的缓蚀效果。结果表明,当缓蚀剂分子碳数为12时,缓蚀效果最好。Zhang 等[58]研究了槐糖脂在CO2饱和的油田采出水中对X65 钢的缓蚀效果,发现在室温下添加量为30mg/L时,缓蚀效率高达92.44%。
2.1.5 其他缓蚀剂
不同类型缓蚀剂的作用机理也不尽相同。大多数缓蚀剂分子是通过物理或化学吸附于金属表面从而抑制腐蚀过程。为提高缓蚀效率,减少缓蚀剂添加量,多活性位点化合物得以开发,即一个分子中集中了多个活性吸附基团,如Tian等[59]合成的肉桂亚氨基-[5-(对甲基)-苯基-(1,3,4-三唑基)-2-硫醇](CITT)、肉桂基-[5-(对甲基)-苯基-氨基-(1,3,4-三唑基)-2-硫醇]-酰腙(CATA)。有时也引入较长的疏水链阻碍腐蚀介质与基体接触,如癸硫醇[60]。Tiu 等[61]发现聚乙烯胺、聚天冬氨酸、纤维衍生物等聚合物与小分子缓蚀剂相比拥有更好的成膜能力,缓蚀性能较好。
2.2 不同缓蚀剂之间的协同增效
缓蚀剂协同效应即两种或两种以上缓蚀剂混合使用后,缓蚀效率远远高于各组分单独使用时缓蚀效率简单相加的结果,使之达到1+1≫2 的效果[62]。目前大部分复配研究均是基于咪唑啉类缓蚀剂与其他类缓蚀剂的缓蚀协同效应,可分为与卤素离子的协同增效,与含有N、S、O、P等原子的有机物复配,与一些活性阴离子混合,与无机缓蚀剂的协同效应及与植物型缓蚀剂等的共同作用等[63]。对其他各类缓蚀剂之间的协同效应研究较少。
2.2.1 咪唑啉缓蚀剂与其他缓蚀剂的协同增效
咪唑啉缓蚀剂能与I-产生协同增效作用的观点已经被普遍认同。I-能够特异吸附在金属基体表面,并改变金属表面电荷分布情况。Wei 等[64]研究了咪唑啉缓蚀剂与KI在超临界CO2/H2O体系中对碳钢的缓蚀协同增效作用,结果表明,相比于单独加入咪唑啉缓蚀剂,加入KI 后腐蚀速率显著降低。Heydari等[65]研究了氨基咪唑啉衍生物(IM)与I-对碳钢在CO2饱和盐水溶液中腐蚀的协同抑制行为,结果表明,I-的加入显著提高了IM在金属表面的覆盖度,缓蚀效果增强。马淑清等[66]利用油酸基咪唑啉缓蚀剂在含CO2介质中与KI进行了复配,结果在复配比例为1∶1 时协同作用最为明显,复配后的混合缓蚀剂缓蚀效率相比单组分的油酸基咪唑啉提高了23.55%。赵景茂等[67]认为咪唑啉类缓蚀剂与卤素离子的缓蚀机理是由于架桥现象使缓蚀剂在金属表面的覆盖面积增大,从而提高缓蚀效率。
此外,咪唑啉缓蚀剂与含有N、O、S、P等原子的有机物(有机胺类、炔醇类及硫脲类等)之间也存在协同效应[68-69]。赵景茂等[70]在CO2盐水体系中研究了咪唑啉衍生物类缓蚀剂(OIMQ)与硫脲(TU)之间的共同作用,结果表明,在复配比为OIMQ∶TU=5∶5 时,缓蚀效率达到最大,其缓蚀机理为负催化效应。复配后的缓蚀剂在金属表面形成了一种致密的双层结构,内层以硫脲为主,外层主要是咪唑啉衍生物。刘多容等[71]研究了CO2气液两相缓蚀剂SM-12B(通过合成双咪唑啉季铵盐和多单元吗啉环己胺缓蚀剂,再与含硫有机物及炔醇类缓蚀剂进行复配,得到抑制CO2腐蚀的气液两相缓蚀剂),对其性能评价结果表明,SM-12B 与含硫有机物进行复配后表现出良好的缓蚀性能,在浓度为400mg/L、温度90~110℃、pCO2<1.0MPa 的条件下,气液两相缓蚀效率分别达到71.57%及80.82%。
由于一般的无机缓蚀剂都为“危险型缓蚀剂”,因而很少用无机缓蚀剂做复配。无机缓蚀剂主要有硝酸盐、亚硝酸盐、磷酸盐、硅酸盐等,一般是以形成钝化保护膜的形式达到缓蚀效果,属于阳极型缓蚀剂。何晓英[72]研究了在CO2腐蚀环境下季铵盐类咪唑啉与钨酸钠之间的协同作用,结果表明,在钨酸钠的添加量为500mg/L、复配比为1∶2时,缓蚀效率高达91.05%。
植物型缓蚀剂与咪唑啉缓蚀剂都属于低毒、绿色环保型的缓蚀剂,但针对这两种缓蚀剂在CO2环境中复配增效的研究较少。以往的研究证明了植物型缓蚀剂与卤素离子之间存在良好的协同作用[73],这为咪唑啉与植物型缓蚀剂的复配提供了参考。Oguzie[74]对绿罗勒、南瓜叶等多种植物提取物和卤素离子进行了复配研究,发现在酸性介质中加入卤素离子后,提高了植物提取物在碳钢表面的覆盖率,同时也增强了物理吸附力,从而达到协同效果。
2.2.2 其他缓蚀剂之间的协同增效
除与咪唑啉缓蚀剂复配外,也有文献报道季铵盐与含硫化合物类有机物也存在协同效应。李善健等[75]研究了喹啉和硫脲在饱和CO2油田采出水中对N80钢的缓蚀协同作用,结果表明,喹啉与硫脲之间存在较强的协同作用效果。在缓蚀剂单独使用时基体表面呈现较严重的全面腐蚀,而使用复配型缓蚀剂时金属表面呈现少量点蚀坑,腐蚀过程受到强烈抑制。在喹啉与硫脲复配比为3∶7 时,缓蚀效率高达97.15%。赵景茂等[76]证明了二氢噻唑衍生物与硫脲及表面活性剂的混合物复配后在CO2气液两相环境中对Q235 钢有良好的缓蚀作用。兰旭[77]将合成的季铵盐类缓蚀剂与几种Gemini 表面活性剂复配后,缓蚀效率高达92%。
3 展望
(1)近年来关于CO2腐蚀的报道颇多,但对于CO2腐蚀机理并没有得到一致结论,特别是在高温高压环境下,CO2腐蚀机理还未达成一致,仍是今后研究的重点。
(2)CO2腐蚀影响因素较多,目前的研究大多基于实验得到腐蚀规律。然而由于实验条件及实验参数差异较大,导致结果规律性不统一。随着数学模型在腐蚀科学中的应用,未来可通过软件建模技术对各因素协同作用下金属的腐蚀速率进行预测,并对腐蚀机理进行深入探讨。
(3)对于复配型缓蚀剂,现有的大多研究以探究最佳比为目的,其缓蚀机理主要停留在物理吸附和化学吸附,而对缓蚀剂与CO2腐蚀产物膜之间的作用机制研究较少,可以作为今后研究的一个方向。
(4)对于不断提高的缓蚀要求,缓蚀剂逐步向更高效、多功能、无公害方向发展。从天然植物、药物等中提取或分离出有效缓蚀成分,也是未来缓蚀剂发展的重要方向。

