盐酸羟考酮缓释片联合硫酸吗啡缓释片治疗中晚期癌症患者爆发痛的效果
姚辉杰
山东省济宁北湖省级旅游度假区人民医院药剂科,山东济宁 272072
相关研究资料显示,在恶性肿瘤患者中,约有50%~70%的患者会在同一时间出现程度不同的疼痛,约有1/4 的患者至死都没有有效解决疼痛问题[1]。在临床中,最初相关研究学者[2]把爆发性癌痛做出了一项定义,认为其是特殊癌症疼痛状态,患者通过实施药物控制基础疼痛的情况下,依然会发生急性疼痛加剧或突发疼痛加剧的情况,此情况严重影响到患者的生活质量、交往能力以及日常自理能力。现阶段临床多应用药物对癌痛患者实施治疗,常见药物包括中枢神经系统用药、阿片类药物、非甾体抗炎药等,其中重度癌痛患者一线用药多为阿片类药物,不过不同患者对于阿片类药物敏感度存在区别,且现阶段关于此种药物不同情况对应剂量的使用缺少相关标准[3]。《成人癌痛治疗指南》[4]的相关内容显示,可以将阿片类药物控释制剂作为临床重度癌痛患者的背景给药,而盐酸羟考酮缓释片具有其特有的控释技术,能够在癌痛的临床治疗中产生显著优势。本研究主要分析硫酸吗啡缓释片联合盐酸羟考酮缓释片对中晚期癌症患者爆发痛产生的作用。
1 资料与方法
1.1 一般资料
选取2015年12月至2018年12月济宁北湖省级旅游度假区人民医院的104 例癌痛患者作为研究对象,采用随机抽签法将其分为对照组(52 例)和观察组(52 例),对照组中,男27 例、女25 例;年龄26~74 岁,平均(61.38±6.10)岁;肿瘤类型:乳腺癌4例、肺癌20 例、肠癌7 例、胃癌8 例、肝癌13 例;疼痛程度:中度30 例、重度22 例;疼痛部位:腰痛5 例、胸肋痛21 例、背痛9 例、腹痛8 例、四肢痛9 例。观察组中,男28 例、女24 例;年龄28~73 岁,平均(61.61±6.02)岁;肿瘤类型:乳腺癌6 例、肺癌21 例、肠癌8例、胃癌8 例、肝癌9 例;疼痛程度:中度28 例、重度24例;疼痛部位:腰痛6 例、胸肋痛22 例、背痛8 例、腹痛7例、四肢痛9 例。两组的一般资料比较,差异无统计学意义(P>0.05),具有可比性。
依照《癌症疼痛诊疗规范》[5]中的疼痛数字评分(numeric rating scales,NRS)对疼痛强度进行分级,包括无痛(0 分)、轻度(1~3 分)、中度(4~6 分)、重度(7~10 分)。
本研究已通过医院医学伦理委员会审核通过,患者及家属均知情同意且自愿签署相关同意书。纳入标准: ①预期生存时间>3 个月的患者; ②有清醒的神志,能够准确表达疼痛程度的患者;③经细胞学或病理学诊断为恶性肿瘤的患者;④患者NRS 评分≥4分,且疼痛位置相对固定,痛点≤3 处者;⑥患者Karnofsky 功能状态评分[6]≥40 分,年龄在18~75 岁间者。排除标准:①恶液质者;②处于妊娠或哺乳期者;③对研究相关药物过敏者; ④同时患有智力或精神障碍者;⑤同时患有肾、肝及心等功能异常者。
1.2 方法
对照组患者实施口服硫酸吗啡缓释片(生产厂家:萌蒂(中国)制药有限公司,生产批号:19030002,规格:30 mg/片)治疗,初始用药剂量为每次30 mg,每隔12 h 服用一次,24 h 内根据患者NRS 评分适当增加药量,最大剂量为每次120 mg。观察组患者实施在对照组患者基础上联合盐酸羟考酮缓释片(生产厂家:英国BARD PHARMACEUTICALS LIMITED,生产批号:190865,规格:10 mg/片)口服治疗,若患者疼痛程度为中度,盐酸羟考酮缓释片的初始用药剂量为每次10 mg,每隔12 h 服用一次;若疼痛程度为重度,则每次20 mg,每隔12 h 服用一次。根据患者NRS 评分适当调整用药时间及用药剂量,最大剂量为60 mg。
两组患者皆连续治疗一周。
1.3 观察指标及评价标准
①比较组间疼痛缓解情况,具体包括轻度缓解、部分缓解以及完全缓解三种,观察患者疼痛缓解率。根据WHO 疼痛疗效准则[6]联合NRS 法联合进行判别:NRS 评分下降到0 分,患者完全没有疼痛为完全缓解;NRS 评分下降幅度>50%,疼痛感明显改善,不会影响到睡眠为部分缓解;评分下降幅度<50%,疼痛感得到一定改善,不过依然有明显的痛感为轻度缓解。总缓解率=(完全缓解+部分缓解)/总例数×100%。②观察两组患者治疗前后血清指标变化情况,包括肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、5-羟色胺(5-hydroxytryptamine,5-HT)、β-内啡肽(β-endorphin,β-EP)、白细胞介素-6(interleukin-6,IL-6)及P 物质(substance P,SP)。于治疗前及治疗后对患者空腹静脉血进行采集,采集量6 ml,离心时间8 min,转速4000 r/min,离心半径10 cm,取上层血清,利用ELISA 法对上述血清指标含量进行检测。③比较两组患者疼痛稳定情况,包括爆发痛次数与疼痛稳定时间。疼痛稳定时间为第一次用药开始到第一次疼痛控制稳定之间的时间差,疼痛控制稳定为患者连续2 d维持在24 h 内爆发痛次数<3 次,NRS 评分在3 分以下。并记录患者24 h 爆发痛的次数。④生活质量利用中文版癌症患者生命质量测定量表(functional assessment of cancer therapy-general,FACT-G)[7]做出评估,其内容涵盖日常生活、人际交往、生活兴趣、精神状态四项,总分为10 分,分值与生活质量呈反比。⑤对患者治疗期间的不良反应发生情况进行记录,涵盖便秘、嗜睡乏力、尿潴留、恶心呕吐及头晕等。
1.4 统计学方法
采用SPSS 21.0 统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,两组间比较采用t 检验;计数资料用率表示,组间比较采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者疼痛缓解率的比较
两组患者的疼痛缓解率比较,差异无统计学意义(P>0.05)(表1)。

表1 两组患者疼痛缓解率的比较[n(%)]
2.2 两组患者治疗前后血清指标的比较
两组患者治疗前的血清TNF-α、IL-6、SP、5-HT、β-EP 水平比较,差异无统计学意义(P>0.05),两组患者治疗后的血清TNF-α、IL-6、SP 低于本组治疗前,5-HT、β-EP 高于治疗前,差异有统计学意义(P<0.05),观察组患者治疗后的血清TNF-α、IL-6、SP 含量低于对照组,5-HT、β-EP 高于对照组,差异有统计学意义(P<0.05)(表2)。
表2 两组患者治疗前后血清指标的比较(±s)
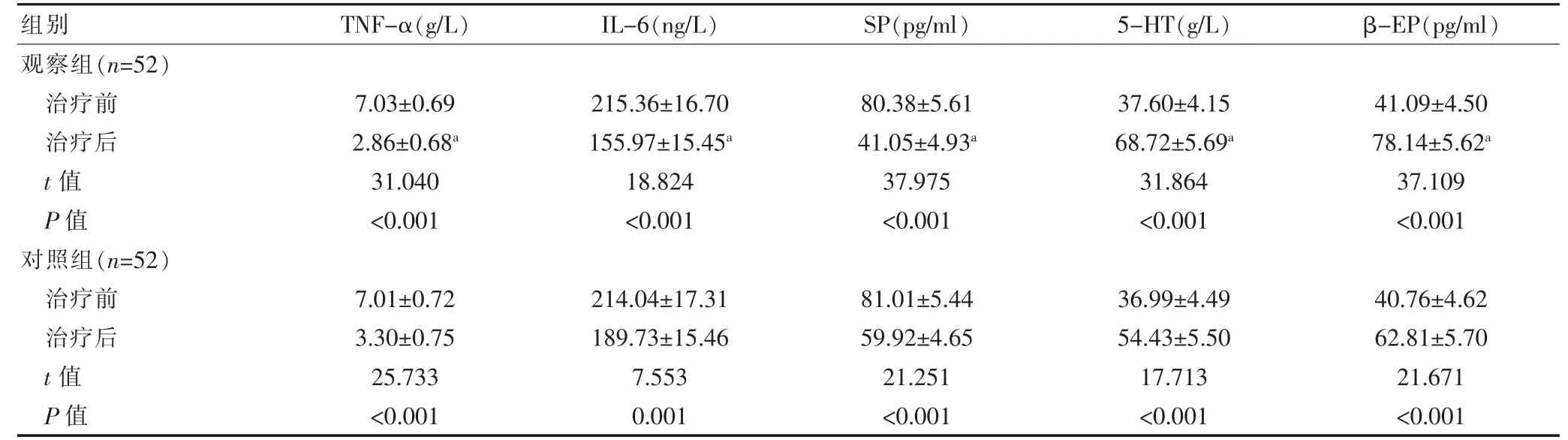
表2 两组患者治疗前后血清指标的比较(±s)
与对照组治疗后比较,aP<0.05
组别 TNF-α(g/L) IL-6(ng/L) SP(pg/ml) 5-HT(g/L) β-EP(pg/ml)观察组(n=52)治疗前治疗后t 值P 值对照组(n=52)治疗前治疗后t 值P 值7.03±0.69 2.86±0.68a 31.040<0.001 215.36±16.70 155.97±15.45a 18.824<0.001 7.01±0.72 3.30±0.75 25.733<0.001 214.04±17.31 189.73±15.46 7.553 0.001 80.38±5.61 41.05±4.93a 37.975<0.001 37.60±4.15 68.72±5.69a 31.864<0.001 41.09±4.50 78.14±5.62a 37.109<0.001 81.01±5.44 59.92±4.65 21.251<0.001 36.99±4.49 54.43±5.50 17.713<0.001 40.76±4.62 62.81±5.70 21.671<0.001
2.3 两组患者疼痛稳定时间及爆发痛次数的比较
观察组爆发痛次数[(14.61±3.15)次]低于对照组[(17.23±3.22)次],差异有统计学意义(t=4.194、P=0.001)。观察组疼痛稳定时间[(67.70±16.94)h]低于对照组[(82.41±17.46)h],差异有统计学意义(t=4.360,P=0.001)。
2.4 两组患者治疗前后生活质量评分的比较
两组治疗前的生活质量评分比较,差异无统计学意义(P>0.05);两组患者治疗后的生活质量评分低于治疗前,且观察组患者治疗后的生活质量评分低于对照组,差异有统计学意义(P<0.05)(表3)。
表3 两组患者治疗前后生活质量评分的比较(分,±s)

表3 两组患者治疗前后生活质量评分的比较(分,±s)
与对照组治疗后比较,aP<0.05
组别 生活兴趣 日常生活 人际交往 精神状态观察组(n=52)治疗前治疗后t 值P 值对照组(n=52)治疗前治疗后t 值P 值6.98±1.21 3.40±1.03a 16.246<0.001 7.30±1.56 3.16±1.02a 16.107<0.001 7.49±0.98 3.49±0.95a 21.133<0.001 7.10±1.50 2.40±0.86a 19.602<0.001 7.00±1.16 5.17±1.05 8.434 0.001 7.19±1.75 4.60±1.28 8.614 0.001 7.53±1.01 5.00±1.02 12.710<0.001 7.04±1.39 3.95±0.90 13.456<0.001
2.5 两组患者不良反应发生率的比较
两组患者不良反应发生率比较,差异无统计学意义(P>0.05)(表4)。
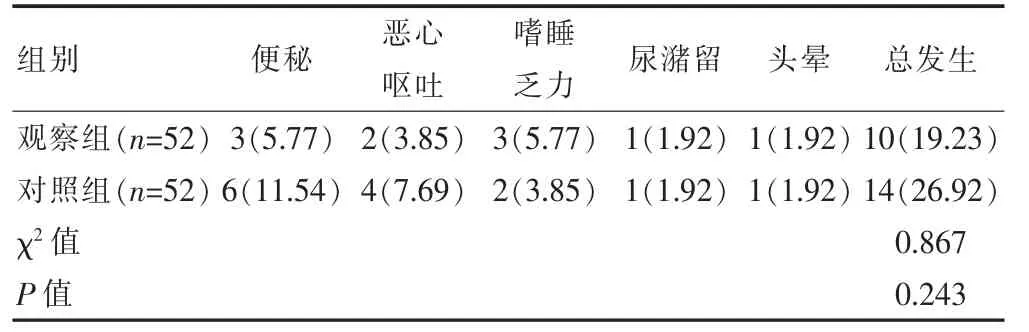
表4 两组患者不良反应发生率的比较[n(%)]
3 讨论
癌痛会对患者的心情、生活质量、睡眠质量及活动等带来不利影响,若疼痛长时间持续发生,还会导致患者出现多种不良情绪,如抑郁、恐惧、焦虑等。现阶段癌痛产生的机制可能包括以下几点。其一,受过大心理压力的影响;其二,机体内脏及血管遭受癌细胞侵入;其三,受癌细胞浸润的影响,其周边淋巴细胞会分泌出致痛物质;其四,周边神经与组织受到癌组织的生长与转移而产生压迫,进而导致神经缺血及坏死;其五,治疗期间出现较大的不良反应造成患者身体损伤[8-11]。大部分中重度患者都会比较倾向于药物治疗,同时也能够收获较大益处,很多患者在接受合理用药后,疼痛都能够得到良好缓解。
目前临床中最为常见的镇痛药物为盐酸吗啡缓释片,其有效成分作用于机体中可以处于缓释状态,使药理恒定发挥,同时口服的方式更加快捷简便,针对各类不同的癌性疼痛都能够产生较好的镇痛效果。该药物属于强效阿片受体激动剂的一种,能够进一步降低神经递质在神经末梢的释放量,并对腺苷酸环化酶产生一定的抑制作用,从而降低环磷酸腺苷在神经细胞中的含量,对抑制各类疼痛产生积极作用,不过在用药后,很多患者会出现多种程度不同的副作用,如呼吸抑制、呕吐、恶心及便秘等[12-15]。有研究[16]显示,患者用药一个月后容易出现嗜酸等症状,且疼痛症状会在停药后反弹,会对患者生活质量造成诸多不利影响。盐酸羟考酮缓释片也是强阿片类镇痛药物的一种,该药物的主要优势包括生物利用度高、没有剂量封顶效应、药效持续时间长且起效快等,目前在中重度癌痛患者的临床治疗中已经成为首选药物之一[17-19]。该药有效成分属于阿片受体纯激动剂的一种,能够与阿片受体产生作用,而且面对各类疼痛都能够产生一定的应用效果[20-21]。相关资料显示[22],与其他阿片类药物相比较,该药物对于受体能够产生更好的效果,且受体同内脏痛、神经病理性疼痛等联系紧密,因此羟考酮在此类疼痛症状的止痛效果上更加突出。本研究结果表明,观察组疼痛缓解率与对照组进行比较,差异无统计学意义(P>0.05),观察组疼痛稳定时间明显短于对照组,治疗后爆发痛次数少于对照组,差异有统计学意义(P<0.05),这一结果可以看出,盐酸羟考酮缓释片联合硫酸吗啡缓释片能够更快地缓解患者的疼痛症状,且效果较为稳定。血清β-EP 主要可以同细胞膜产生的特异性受体结合,进而降低疼痛信号的传递;5-HT 主要可以缩短机体疼痛时间,降低疼痛次数,使痛阈提升,而血清SP 属于兴奋性神经递质的一种,主要作用为传导痛觉与伤害性信息,进而产生疼痛;TNF-α 主要可以对机体炎症细胞的形成和聚集产生介导作用,从而促进细胞凋亡;IL-6 能够使炎症反应进一步加快,从而损伤患者肝脏功能。本研究结果显示,观察组血清TNF-α、IL-6、SP 低于对照组,5-HT、β-EP 高于对照组,差异有统计学意义(P<0.05)。由此可见,盐酸羟考酮缓释片联合硫酸吗啡缓释片可以产生较好的抗炎效果,并能够较好的改善疼痛症状。此外,观察组与对照组不良反应发生率比较,差异无统计学意义(P>0.05),同时两组均没有出现严重的副作用,由此可见,盐酸羟考酮缓释片联合硫酸吗啡缓释片的临床用药安全性较高。
综上所述,在对患者实施硫酸吗啡缓释片治疗的同时,联合羟考酮缓释片共同治疗能够对癌痛患者爆发痛次数产生良好的控制作用,并进一步提升疼痛缓解率,缩短疼痛稳定时间,改善患者生活质量。

