磁共振动态增强扫描联合扩散加权成像定量分析在乳腺导管原位癌伴微浸润中的诊断价值
熊淑红 肖 琼 阮玖根 付水平 宋 婷 丁 瑶 谭秋萍
江西省新余市人民医院影像中心,江西新余 338000
近年来,乳腺癌的发病率有逐年升高趋势,该病起病隐匿,难以早期发现,且好发于中青年女性,给此类人群的生命健康带来严重威胁[1-2]。随着影像检测技术的不断提高,乳腺导管原位癌(ductal carcinoma in situ,DCIS)的检出率亦得到显著提升,本型处于乳腺恶性肿瘤早期,若能及时干预处理,多预后较好[3]。乳腺导管原位癌伴微浸润(breast ductal carcinoma in situ with microinvasion,DCIS-Mi) 为DCIS 发展为浸润性导管癌的过渡阶段,亦是乳腺肿瘤治疗关键时间窗,错过该时点将招致治疗难度显著增高,因此将此类疾病早期检出有助于提高整体诊疗效果[4-5]。目前动态增强磁共振成像(dynamic contrast enhanced MRI,DCEMRI)及扩散加权成像(diffusion weighted imaging,DWI)因具有图像清晰、准确度高、不易受外界因素干扰等优势,已成为检测乳腺疾病的首选影像学方法[6-7]。本研究进一步探究DCE-MRI 联合DWI 在DCIS-Mi 中的诊断效能,旨在为后续临床推广应用提供指导。
1 资料与方法
1.1 一般资料
回顾性分析2018年3月至2020年1月新余市人民医院确诊DCIS-Mi 并行MRI 检查的患者共100例,根据患者行病检确诊类型的差异分为对照组(60 例,病检确诊为单纯DCIS)与观察组(40 例,病检确诊为DCIS-Mi)。对照组中,年龄30~65 岁,平均(48.27±9.74)岁;肿瘤部位:右乳32 例,左乳28 例;肿瘤位于上象限35 例,内下14 例,中央11 例。观察组中,年龄28~62 岁,平均(47.83±9.10 岁);肿瘤部位:右乳21例,左乳19 例;肿瘤位于上象限23 例,内下9 例,中央8例。两组患者的一般资料比较,差异无统计学意义(P<0.05),具有可比性。所有患者及其家属均对本研究知情同意,本研究已经医院医学伦理委员会批准通过。
纳入标准:①患者已行乳腺活检且结果符合单纯DCIS 或DCIS-Mi 表现[8];②乳腺MRI 诊断为可疑恶性病变(breast imaging reporting and data system,BIRADS≥4 类[9]);③年龄25~75 岁。排除标准:①处于妊娠或哺乳期者;②合并其它乳腺疾病者;③合并生殖或内分泌系统疾病者;④合并一个及以上脏器功能严重不全者;⑤合并其它肿瘤者。
1.2 观察指标及检测方法
比较两组病灶扩散情况、非肿块样强化特点及肿块样强化特点。使用Simens 公司SKyra 3.0 TMR 超导MR 仪和乳腺相控阵线圈。患者均于月经后7 d 进行MRI 检查,检查时取俯卧位,双乳松弛并自然下垂于线圈洞内,紧贴线圈,双手取自然位。对横轴面T2WI、T1WI、DWI、横轴面DCE-MRI 进行检测。对以上层面扫描的原始图像传输至后期工作站进行分析,由两名放射主治医师在双盲情况下进行测量和图像分析。首先将DWI 应用扩散校正软件包进行校正,后自动生成DWI 图和表观扩散系数(apparent diffusion coefficient,ADC)图,在ADC 图上测量最小ADC(ADCMin)和最 大ADC(ADCMax),同时 计 算ADC 差(ADCDR)=ADCMax-ADCMin。对DCE-MRI 图像下非肿块样强化及肿块样强化例数进行统计并对影像学特点进行分析比较,计算早期强化率(early enhancement rate,EER)=(增强后第1 期信号强度-增强前信号强度)/增强前信号强度×100%。
1.3 统计学方法
使用SPSS 13.0 统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,两组间比较采用t 检验;计数资料用率表示,组间比较采用χ2检验或Fisher确切概率检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者病灶部位的比较
观察组ADCMin低于对照组,ADCDR及EER 高于对照组,差异有统计学意义(P<0.05);两组ADCMax比较,差异无统计学意义(P>0.05)(表1)。
表1 两组患者病灶部位的比较(±s)
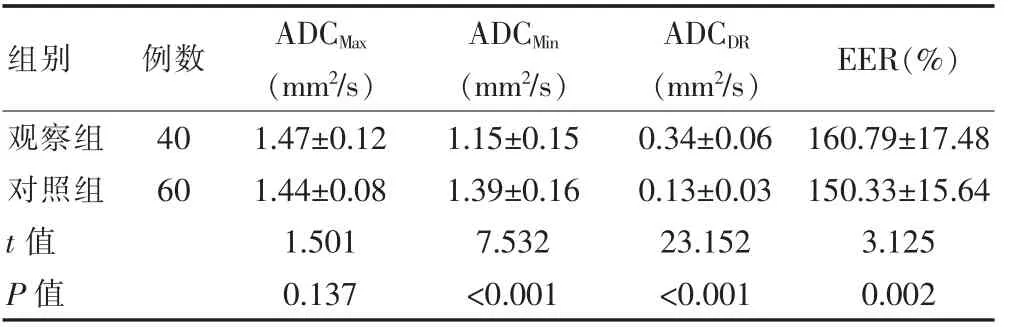
表1 两组患者病灶部位的比较(±s)
?
2.2 两组患者非肿块样强化及肿块样强化情况的比较
两组非肿块样强化例数与肿块样强化例数比较,差异无统计学意义(P>0.05)(表2)。
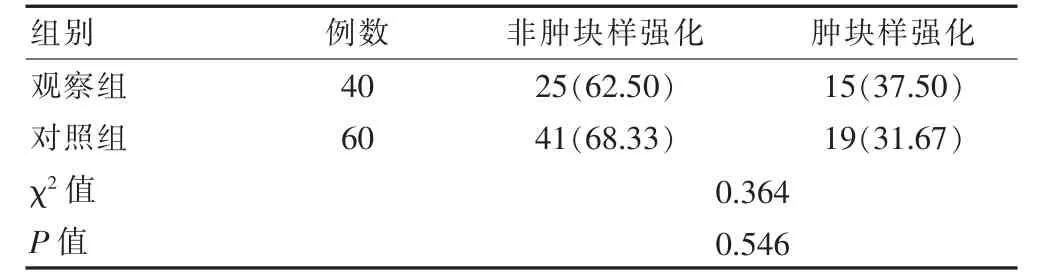
表2 两组患者非肿块样强化及肿块样强化情况比较(例)
2.3 两组患者MRI 非肿块样强化特点的比较
两组非肿块样强化特点比较,两组内部强化特点比较,差异有统计学意义(P<0.05);观察组均质强化例数占比低于对照组,不均质强化例数占比高于对照组,差异有统计学意义(P<0.05);两组分布特点比较,差异有统计学意义(P<0.05);观察组局灶分布例数占比低于对照组,节段分布例数占比高于对照组,差异有统计学意义(P<0.05)(表3)。
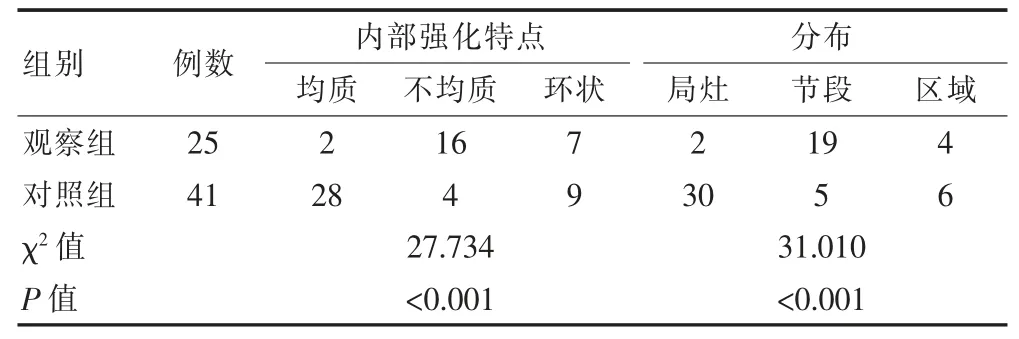
表3 两组患者MRI 非肿块样强化特点的比较(例)
2.4 两组患者MRI 肿块样强化特点的比较
两组肿块样强化特点比较,两组内部强化特点比较,差异有统计学意义(P<0.05),观察组均质强化例数占比低于对照组,环状强化例数占比高于对照组,差异均有统计学意义(P<0.05)。观察组病灶边缘不清晰例数占比高于对照组,差异有统计学意义(P<0.05)。两组病灶在外形各项占比比较,差异无统计学意义(P>0.05)(表4)。
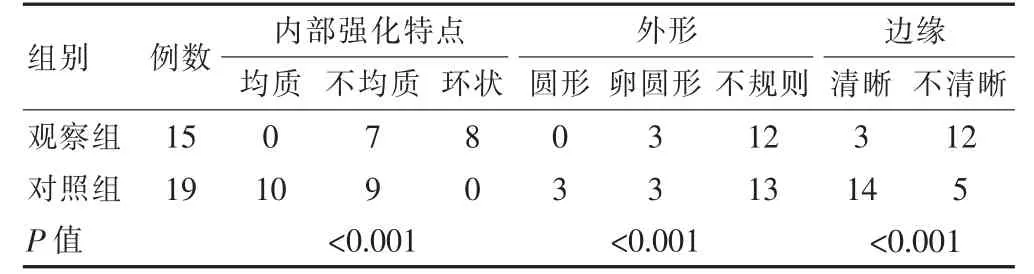
表4 两组患者MRI 肿块样强化特点的比较(例)
3 讨论
经典诊疗学中将单纯DCIS 及DCIS-Mi 均归纳为早期乳腺癌病变,两者在临床表现上存在较多相似性[11]。随着学术界对乳腺癌认识的深入以及相关临床经验的逐步积累,人们发现单纯DCIS 与DCIS-Mi 在诸多特性上亦存在显著区别,因此对DCIS 与DCISMi 的早期、准确的鉴别诊断成为临床迫切需求[12]。目前已有研究显示,DWI 联合DCE-MRI 对于早期乳腺癌的鉴别诊断具有较高的准确性[13],为进一步探讨该种检查方式对DCIS-Mi 的诊断价值故设立本研究。结果发现,观察组ADCMin低于对照组,ADCDR高于对照组,差异均有统计学意义(P<0.05),表明DCIS-Mi相较于单纯DCIS 肿瘤细胞密度及细胞外间隙存在确切差异性。ADC 大小主要受肿瘤细胞增殖速度、排列密度与细胞外间隙大小影响,ADCMin代表病灶中癌细胞密度最高区和癌巢的位置,ADCDR为ADCMax与ADCMin的差值,即病灶内不同成分间的差异[14-15]。当单纯DCIS 进展为DCIS-Mi 时,肿瘤细胞密度增加,细胞外间隙变小,并突破基底膜,导致病灶部位水分子扩散运动受限,ADCMin降低,同时突破基底膜的肿瘤细胞将逐渐侵犯邻近组织,使得肿瘤组织中细胞成分差异增大,ADCDR增加。EER 用于代表局部组织细胞血流灌注程度,肿瘤组织多因为丰富的血供而在EER 指标中与正常组织表现出较大的差异性[16-18]。本研究中,观察组EER 高于对照组,差异有统计学意义(P<0.05),提示DCIS-Mi 局部组织灌注多于单纯DCIS,考虑其与肿瘤进展过程中病变侵袭范围扩大,促进新生的血管不断增多,且血管内皮通透性增加相关。
本研究亦对DCIS-Mi 与单纯DCIS 在不同MRI强化类型中的特点进行比较,结果显示,对于MRI 显像表现为非肿块样强化的患者,观察组均质强化例数占比低于对照组,不均质强化例数占比高于对照组,差异有统计学意义(P<0.05)。观察组局灶分布例数占比低于对照组,节段分布例数占比高于对照组,差异有统计学意义(P<0.05);对于MRI 显像表现为肿块样强化的患者,观察组均质强化例数占比低于对照组,环状强化例数占比高于对照组,观察组病灶边缘不清晰例数占比高于对照组,差异均有统计学意义(P<0.05)。DCIS-Mi 与单纯DCIS 在MRI 显像特征的差异性可能与两者肿瘤细胞侵袭力不同相关,单纯DCIS 中肿瘤细胞未突破基底膜,故局限于乳腺导管内,且边界相对清晰,以线样分布为主,内部强化较均匀。DCISMi 中肿瘤细胞已突破基底膜,具有侵袭性生长趋势,故以段样分布为主,内部强化多不均匀或呈环状。临床应用中可根据以上特点对单纯DCIS 与DCIS-Mi进行鉴别。
综上所述,DWI 联合DCE-MRI 对于DCIS-Mi 具有较好的诊断效能,可通过病灶分布及内部强化特点对单纯DCIS 与DCIS-Mi 进行鉴别诊断,具有临床应用价值,本研究进一步探讨了DWI 联合DCE-MRI 在病灶分布及内部强化特点上对DCIS 与DCIS-Mi 的鉴别作用,为临床联合鉴别提供了理论参考。

