丹参新酮标准样品的研制
夏杰,贾巧君,叶子弘,杨东风,侯卓妮,肖艺,张晓丹


〔摘要〕 目的 根據GB/T15000.3-2008《标准样品工作导则(3)标准样品:定值的一般原则和统计方法》和GB/T15000.5-2008《标准样品工作导则(5)标准样品:化学成分标准样品技术通则》中指导要求,在国家标准化技术管理委员会批准立项的基础上,开展关于丹参新酮标准样品的研制。方法 以唇形科鼠尾草属药用植物陕南道地丹参(Salvia miltiorrhiza Bge)为原料通过醇提、硅胶柱色谱分离、制备色谱得到丹参新酮纯品;采用红外分光光度分析法(IR)、紫外光谱(UV)、核磁共振(NMR)和质谱(MS)等波谱技术对其进行定性分析和结构确证。将样品分装成100瓶(10 mg/瓶),采用高效液相色谱法(HPLC)进行均匀性和稳定性检验以及联合定值分析。结果 经检验该样品在95%的置信区间范围内均匀性良好;在0~4 ℃的条件下,24个月内稳定性良好;采用多个实验室协作试验定值,丹参新酮标准样品的纯度为99.350%,扩展不确定度0.053%。结论 丹参新酮达到国家标准样品的技术要求,丹参新酮标准样品批号GSB 11-3803-2020可以用于丹参药材及其副产品中丹参新酮含量的测定、结构的确定、质量甄别、检测方法的校正和质量控制,为药材和产品成分检测结果的准确性、对比性、可溯性提供参考。
〔关键词〕 丹参新酮; 标准样品;均匀性;稳定性;定值;不确定度
〔中图分类号〕R284 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.11.011
Preparation of Miltirone Standard Sample
XIA Jie1, JIA Qiaojun1,2, YE Zihong3, YANG Dongfeng1,2, HOU Zhuoni1,2, XIAO Yi4, ZHANG Xiaodan1,2*
(1. College of Life Sciences and Medicine, Zhejiang Sci-Tech University, Hangzhou, Zhejiang 310012, China; 2. Laboratory of Plant Secondary Metabolism and Regulation of Zhejiang Province, Hangzhou, Zhejiang 310012, China; 3. College of Life Sciences, China Jiliang University, Hangzhou, Zhejiang 310012, China; 4. Yizhonghe Medicinal Plants Research Institute of Zhejiang Ningbo, Ningbo, Zhejiang 315000, China)
〔Abstract〕 Objective According to the guiding requirements of GB/T15000.3-2008 Guidelines for Standard Samples (3): General Principles and Statistical Methods of Fixed Value and GB/T15000.5-2008 Guidelines for Standard Samples (5): Technical General Rules of Chemical Composition Standard Samples, on the basis of the approval of the project by the National Standardization Technical Management Committee, the standard sample of miltirone was developed. Methods Salvia miltiorrhiza Bge, a medicinal plant of Salvia of Labiatae, was used as raw material. The pure miltirone was obtained by alcohol extraction, silica gel column chromatography, preparative chromatography respectively. Infrared spectrophotometry (IR), ultraviolet spectroscopy (UV), nuclear magnetic resonance (NMR) and mass spectrometry (MS) were used for qualitative analysis and structural confirmation. The samples were divided into 100 bottles (10 mg/bottle), and then the uniformity and stability were tested by high performance liquid chromatography (HPLC) method, and the combined fixed value analysis was carried out. Results The results of the study indicated that the sample had good uniformity within 95% confidence interval. It was stable within 24 months at 0~4 ℃. Multiple laboratories were used to cooperate to test the setting value, the purity of standard sample of miltirone was 99.35% and the expanded uncertainty was 0.053%. Conclusion Miltirone meets the technical requirements of national standard samples, and the standard sample batch number GSB 11-3803-2020 can be used for the determination of the content of salvia miltiorrhiza Bge and its by-products, the determination of the structure, the quality screening, the calibration and quality control of the detection method, and provide reference for the accuracy, comparability and traceability of the detection results of the medicinal materials and the product components.
〔Keywords〕 miltirone; standard sample; uniformity; stability; constant value; uncertaint
丹参(Salvia miltiorrhiza Bge),味苦,微寒,归心、肝经,为唇形科植物丹参的干燥根和根茎,广泛分布在全国各地,是重要的大宗药材[1-2]。其次生代谢产物丹参酮类物质是主要有效成分群,丹参酮的药理作用极其广泛[3-4],近年来随着研究的不断深入,在抗肿瘤方面取得了显著成果,此外还具有心脑血管药理作用,天然抗氧化作用及抗菌消炎作用等。丹参新酮是丹参酮类物质的重要组分,目前研究报道表明,丹参新酮在抗炎、抗癌、心脑血管防治等方面均具有药效,科学家们也纷纷从药理角度去阐释药效的产生[5-12]。然而,作为丹参酮类物质的重要组成之一,随着药理药效药动力学方面的研究越来越深入,国内外对丹参新酮标准样品研制方法的报道却较少,也无市售丹参新酮标准样品,由于标准样品的缺乏,使丹参新酮产业化发展受到制约,丹参新酮相关研究与开发受到限制。为满足丹参新酮及相关产品的检测开发需求,按照国家标准样品工作导则[13],成功研制出丹参新酮国家标准样品。
1 材料与方法
1.1 仪器与设备
Waters E2695液相色谱仪(沃特世科技(上海)有限公司公司);Rotavapor R-3旋转蒸发仪(瑞士Buchi有限公司);冷冻干燥仪(宁波Scientz生物技术股份有限公司);C-815中压液相色谱仪(瑞士Buchi有限公司);Waters Prep150 System快速纯化制备色谱[沃特世科技(上海)有限公司(Waters)公司];UV-2500PC紫外吸收图谱分析仪器(日本京都Shimadzu有限公司);Necolit iS傅立叶红外光谱仪(赛默飞世尔科技(中国)有限公司);布鲁克Q-Tof micro质谱仪(德国Bruker·Daltonic有限公司);Bruker Avance 600 MHz核磁共振仪(德国Bruker·Daltonic有限公司)。
1.2 材料与试剂
丹参根采集于陕西省商洛市,由浙江理工大学浙江省植物次生代谢重点实验室张晓丹副教授鉴定为唇形科鼠尾草属植物丹参(Salvia miltiorrhiza Bge)。乙酸乙酯、石油醚、冰醋酸等纯度为99.990%的质谱纯(杭州高晶精细化工有限公司);200~300目硅胶(青岛海洋化工厂);乙腈、甲醇(质谱纯-德国默克股份公司)。
1.3 丹参新酮样品的制备
原料为陕南道地药材丹参(Salvia miltiorrhiza Bge)的根,将30 kg药材干品用6倍量95%乙醇回流提取3次(每次2 h),2~5 ℃静置析晶后抽滤得丹参酮粗品。取粗品进行硅胶柱层析,用石油醚-乙酸乙酯梯度洗脱(V/V,100∶1,80∶1,60∶1,40∶1),合并收集丹参新酮斑点段。干燥浓缩后采用中压液相色谱二次纯化,乙腈和去离子水梯度洗脱,最后用甲醇洗脱,经薄层层析检测后根据Rf值(正向薄层层析(TLC)Rf=0.380,反向薄层层析Rf=0.500)合并相同组分进行真空浓缩,得到纯度90%以上的丹参新酮标准品。用Waters快速纯化制备色谱,在检测波长254 nm,色谱流动相A为乙腈,B为0.2%乙酸水,C为甲醇。梯度洗脱:0~10 min,25%~50% A (20% C);10~40 min,50%~60% A (20% C);40~60 min,60% A (20% C)。合并收集丹参新酮斑点段,合并浓缩,冷冻干燥,得到纯度高于99%的丹参新酮标品。
1.4 纯度分析法
纯度分析是评价标准样品的重要指标之一。标准样品中的水分含量通过传统的卡尔·费休法测定[14],然后通过使用不同有机溶剂展开体系的薄层色谱、高效液相色谱法(HPLC)、高效液相色谱质谱联用(HPLC-MS)等不同方法开展对丹参新酮标准样品多方位的纯度检验[15-17]。
1.5 结构鉴定
对于有机化合物的结构鉴定,通常采用四大波谱进行综合测定,即采用红外分光光度分析法(IR)、紫外光谱(UV)、核磁共振(NMR)、HPLC-MS进行综合定性分析,对制备的样品进行结构确认,分析条件如下。
UV:溶剂为乙醇,光谱带宽2.000 nm,紫外可见光区(200~400nm)全波长扫描。
IR:溴化钾压片后对吸收峰进行分析。
HPLC-MS实验:仪器:布鲁克Q-Tof micro质谱仪,质谱条件:电离方式ESI+,毛细管电压4.5 kV,载气:普氮,载气温度:180 ℃,载气流速:4.000 L/min,扫描范围为m/z=50~800。
NMR实验:以氘代氯仿为溶剂,四甲基硅烷(TMS)为内标进行测定。
1.6 均匀性检验
均匀性是评价标准样品空间分布特征最基本的属性,通过均匀性考察特定值在每个部分是否均匀,明确标准样品特定值在每个部分的分散程度,从而确定其是否满足国家标准样品研制标准。对于丹参新酮标准样品研制而言,以标准样品工作导则第7章有关样品均匀性检验和判断为指导,分装某一批次研制出的丹参新酮样品。总共抽样数目为10个,将样品以1~10进行编号,从10瓶样品中以3种不同程序从上述编号的样品,分别各称取0.250 mg样品3份,并以1.000 mL色谱乙醇作为溶剂溶解后进行HPLC分析,以HPLC面積归一法进行测定样品纯度值。3次的抽样样品编号顺序为1、3、5、7、9、2、4、6、8、10瓶;10、9、8、7、6、5、4、3、2、1号瓶;2、4、6、8,10、1、3、5、7、9号瓶。对每个样品重复测定3次。
1.7 稳定性检验
稳定性是指标准样品在某些外界因素影响下随时间变化规律的试验方法。将丹参新酮样品进行分装,在4 ℃冰箱条件下保存两年进行标准样品长期稳定性检验。分别于0、1、2、3、6、9、12、18、24个月时间随机抽取3个样品,按照色谱条件进样测定,每份试样以测定3次的平均值为其定值结果,用峰面积归一化法求出纯度。以直线模型作为经验模型,采用t检验和F检验对稳定性获得的数据进行分析。
1.8 定值
定值是指采用技术上有效的方法,确定样品的一个或多个特征值的程序。采用多个实验室协作试验的联合定值方式,分别对随机抽取24个样品进行检测,对所采集的测定结果采用格拉布斯检验法进行检验、公式计算丹参新酮标准样品的标准值和不确定度。
2 结果与讨论
2.1 丹参新酮纯度分析
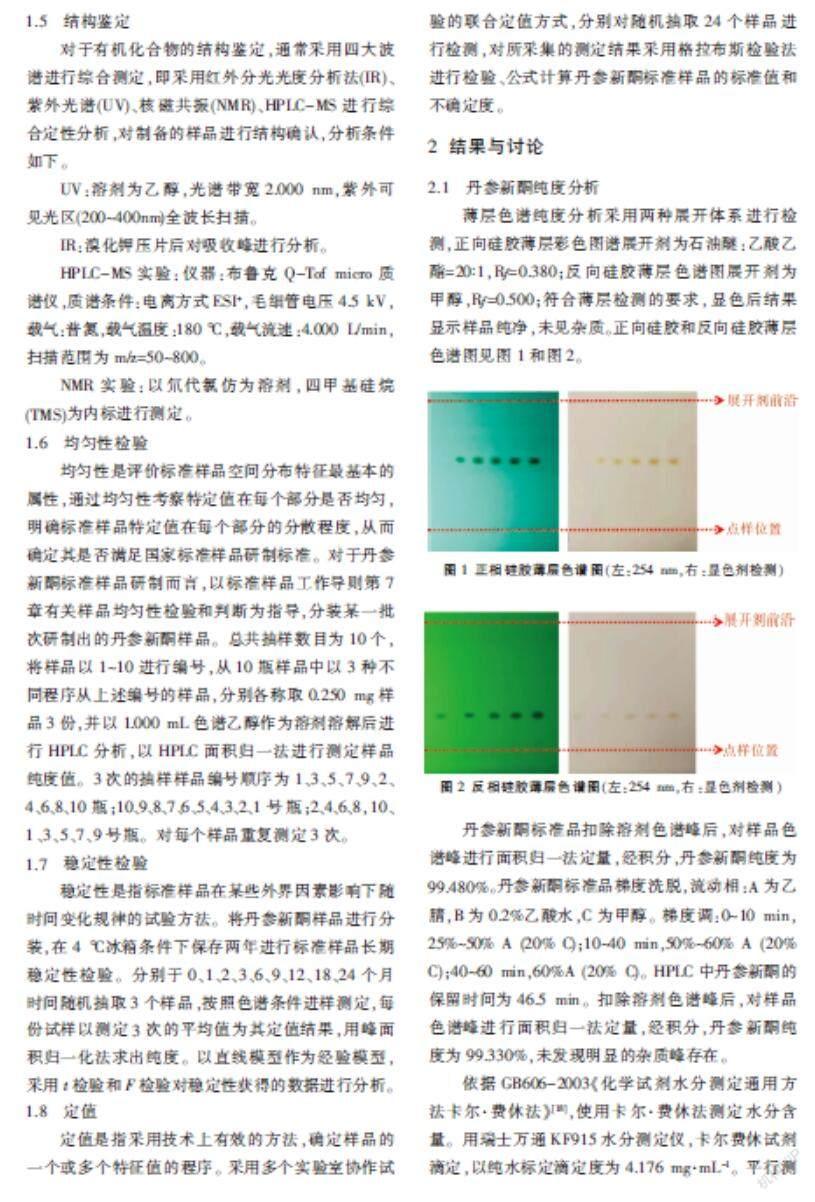
薄层色谱纯度分析采用两种展开体系进行检测,正向硅胶薄层彩色图谱展开剂为石油醚:乙酸乙酯=20∶1,Rf=0.380;反向硅胶薄层色谱图展开剂为甲醇,Rf=0.500;符合薄层检测的要求,显色后结果显示样品纯净,未见杂质。正向硅胶和反向硅胶薄层色谱图见图1和图2。
丹参新酮标准品扣除溶剂色谱峰后,对样品色谱峰进行面积归一法定量,经积分,丹参新酮纯度为99.480%。丹参新酮标准品梯度洗脱,流动相:A为乙腈,B为0.2%乙酸水,C为甲醇。梯度调:0~10 min,25%~50% A (20% C);10~40 min,50%~60% A (20% C);40~60 min,60%A (20% C)。HPLC中丹参新酮的保留时间为46.5 min。扣除溶剂色谱峰后,对样品色谱峰进行面积归一法定量,经积分,丹参新酮纯度为99.330%,未发现明显的杂质峰存在。
依据GB606-2003《化学试剂水分测定通用方法卡尔·费休法》[18],使用卡尔·费休法测定水分含量。用瑞士万通KF915水分测定仪,卡尔费休试剂滴定,以纯水标定滴定度为4.176 mg·mL-1。平行测定3次,取平均值测定结果为:(0.171±0.003)%。
2.2 丹参新酮的结构鉴定
2.2.1 熔点和元素分析 采用梅特勒熔点仪MP50测得熔点:96~97 ℃;采用元素分析仪vario micro cube测定得元素分析测定值:C(80.230±0.130)%,H(7.678±0.100)%;元素分析计算值:C 80.810%,H 7.854%。
2.2.2 UV光谱分析 该化合物在240~280 nm,258.000 nm (0.781),358.000 nm (0.071)处有紫外吸收。这些吸收峰为典型的邻二苯醌吸收特征,其中258.000 nm处的强吸收峰为醌样结构引起的,240~280 nm及358 nm为苯样结构引起的。
2.2.3 IR光谱分析 IR(cm-1):3 445.470(羟基的伸缩振动),2 961.970,2 937.550(-CH3、-CH2的伸缩振动),1 666.990(羰基-C=O尖锐吸收峰),1 655.920 (羰基-C=O尖锐吸收峰),650~900,1 456.560~1 63 2.33 0,3 000~3 100(苯核的骨架特征吸收峰)。
2.2.4 MS分析 使用Agilent1200&6120 Quadrupole
LC/MS仪器,Agilent InfinityLab Poroshell 120EC-C18(50 mm×3.0 mm,2.7 μm)色谱柱;MS条件:ESI+离子源,正离子模式,毛细管电压3.0 kV,载气:氮气,载气流速:12 L/min,载气温度:350 ℃,扫描范围为m/z=100~1 000。ESI+-MS模式下得到正离子质谱分析图测量值m/z=305.151[M+Na]+,理论计算值m/z=305.1512[M+Na]+。
2.2.5 NMR分析 通过将高分辨质谱数据和核磁共振谱分析结果与已经报道过的文献对比,所鉴定化合物的质谱和核磁共振数据均与丹参新酮的文献[19]报道基本一致,即化合物是丹参新酮核磁数据归属见表1和表2。
2.3 均匀性实验
标准样品的均匀性,是标准样品的基本属性之一,在标准样品研制过程中是不可或缺的步骤。对样品丹参新酮样品进行分装后,对其进行纯度均匀性检验,均匀性检验结果见表3与表4。
综上,以υ1(即组间)=9及υ2(即组内)=20查F界值表,得F0.05(9,20)=2.390,由于F=MS间/MS内=1.570 瓶间方差用下式计算: s■■=■=0.000 553 瓶间标准偏差是该方差的平方根: sbb=0.023 500 重复性标准偏差可由MSwithin计算: sr=■=0.054 220 均匀性检验的不确定度ubb=sbb=0.023 500 2.4 稳定性实验 对丹参新酮标准品的长期稳定性进行检验,0、1、2、3、6、9、12、18、24个月时间随机抽取3个样品检验试驗结果如表5所示。 上述数据表明,不同采样时间测得的样品纯度平均值并在没有随时间的变化而发生明显的改变,按照计算所示,测定值应在且均在(99.250±0.050)%内,该标准样品在两年内是稳定的。 用t检验对数据进行统计分析: 丹参新酮标准样品随时间变化而均匀发生变化,经验模型使用的是直线形式,通过观察设定经验模型直线的斜率是否在特定时期内发生差异的大小来判定丹参新酮标准样品的相对稳定性,相关数据分析过程如下所示: 斜率可以用下式计算: b1=■=■=0.000 885 式中:■=99.25 ■=8.33 下式计算截距: b0=■-b1■=99.25-(-0.000 885)×8.33=99.26 直线上的点的标准偏差计算: s2=■=■=0.002 70 取其平方根s=0.051 9,与斜率相关的不确定度用下式计算: s(b1)=■=■=0.002 2 自由度为n-2和p=0.95(95%置信水平)的分布t因子等于2.365 由于:|b1|=0.000 885 即 |b1|<0.005 23 结果显示该方程斜率变化无显著性差异的。证明丹参新酮标准样品在两年内是稳定的。 F检验:上表数据(0~24个月)经线性拟合,得到上表的结论。 通过以上结果分析,在测定时间为24个月内测定样品的直线回归方程的拟合度较好。直线回归的方差分析为F=0.160小于方差分析临界值F0.05(1,7)=5.59。所以在4 ℃的储存条件下,所制备的丹参新酮标准样品在24个月内是稳定的。见表6。 2.5 定值结果及其不确定度评价 2.5.1 定值结果 根据GB/T 15000-2008《标准样品工作导则(3)标准样品定值的一般原则和统计方法》中说明的标准样品定值方法,选择了多个实验室分别测定,各实验室反馈结果见表7。 收集整理8家实验室的数据结果进行统计分析,数据排列方式为由大至小的顺序,用格拉布斯法(Grubbs)进行检验,数据符合规定,未发现异常值。各实验室数据的正态性采用峰度法检验,同样未检出异常值。将各家实验室测得的数据作为无偏估计值,计算8家测定结果的平均值及标准偏差。对表7的数据进行方差分析,结果见表8。计算加权平均值作为定值结果,总平均值为99.86%。 2.5.2 定值分析的不确定度评价 根据国家标准样品指导准则GB/T 15000.3-2008标准规定,定值结果包括两部分,标准值和不确定度丹参新酮特性标准值的计算不确定度由标准值定值实验引入的不确定度、均匀性检验引入的不确定度和稳定性检验引入的不确定度。根据全部测定结果,计算丹参新酮标准样品的特性标准值和不确定度。 标准值定值实验引入的不确定度uchar=u()=0.096 91%;瓶间均匀性引起的标准不确定度為ubb=0.023 5%;稳定性检验引入的不确定度为ults=0.605 31%扣除水分灰分后标准样品纯度:P=(1-Pm-Pa)PHPLC=(1-0.171%-0)×99.35%=99.180%其中:Pm为水分含量;Pa为无机元素含量;PHPLC为HPLC-UV定值主成分峰的百分比值;经杂质分析结果可知:Pm=0.171 0%,Pa=0.000 095 6%。 因此,丹参新酮标准样品的定值结果为丹参新酮样品的纯度为99.180%,扩展不确定度为0.243%。 3 结论 本研究根据标准样品工作导则的要求,成功研制出了丹参新酮国家标准样品,并经均匀性检验、稳定性检验,丹参新酮的均匀性和稳定性结果均符合标样要求。研制的丹参新酮标准样品对中药材质量控制、化合物检测、相关药理作用、产品开发等科学研究提供技术支持,具有重大意义。 参考文献 [1] LU S F. Biosynthesis and regulatory mechanisms of bioactive compounds in Salvia miltiorrhiza, a model system for medicinal plant biology[J]. Critical Reviews in Plant Sciences, 2021, 40(3): 243-283. [2] 陈向荣,陆京伯,石汉平.丹参的药理作用研究新进展[J].中国医院药学杂志,2001,21(1):44-45. [3] 蔡 琳,彭 鹏,郭 甜.丹参药理作用及临床研究进展[J].山东化工,2016,45(17):51-52. [4] 梁 勇,羊裔明,袁淑兰.丹参酮药理作用及临床应用研究进展[J]. 中草药,2000,31(4):304-306. [5] 王梦梦,吉兰芳,崔树娜.丹参功效的物质基础研究进展[J].中医学报,2019,34(5):944-949. [6] ZHANG X W, ZHANG P, AN L, et al. Miltirone induces cell death in hepatocellular carcinoma cell through GSDME-dependent pyroptosis[J]. Acta Pharmaceutica Sinica B, 2020, 10(8): 1397-1413. [7] TANG H J, SONG P, LI J, et al. Effect of Salvia miltiorrhiza on acetylcholinesterase: Enzyme kinetics and interaction mechanism merging with molecular docking analysis[J]. International Journal of Biological Macromolecules, 2019, 135: 303-313. [8] ZHAI J X, SONG Z H, WANG Y W, et al. Zhixiong Capsule (ZXC), a traditional Chinese patent medicine, prevents atherosclerotic plaque formation in rabbit carotid artery and the related mechanism investigation based on network pharmacology and biological research[J]. Phytomedicine, 2019, 59: 152776. [9] CHEN X P, GUO J J, BAO J L, et al. The anticancer properties of Salvia miltiorrhiza bunge (Danshen): A systematic review[J]. Medicinal Research Reviews, 2014, 34(4): 768-794. [10] 黄诒森,张均田.丹参中三种水溶性成分的体外抗氧化作用[J]. 药学学报,1992,27(2):96-100. [11] YIN C Y, EVASON K J, ASAHINA K, et al. Hepatic stellate cells in liver development, regeneration, and cancer[J]. Journal of Clinical Investigation, 2013, 123(5): 1902-1910. [12] 宋 偉.丹参新酮抗血小板作用及对血栓形成的影响[D].武汉: 华中科技大学,2018. [13] 标准样品工作导则(3).标准样品.定值的一般原则和统计方法: GB/T 15000.3—1994[S]. [14] 孟 蓉,尚汝田.卡尔费休法测定水分的发展及其在某些领域中的应用[J].化学试剂,2001,23(1):39-41,50. [15] 耿岩玲,林云良,王岱杰,等.人参皂苷Re标准样品的研制[J].时珍国医国药,2020,31(4):993-997. [16] 马玉翠,吴晓毅,王 尉,等.β-谷甾醇标准样品的研制[J].中国实验方剂学杂志,2017,23(16):90-95. [17] 申 诚,陈 涛,王岱杰,等.獐牙菜醇苷国家天然产物标准样品的研制[J].中国中药杂志,2020,45(4):955-960. [18] 国家标准局.化工产品中水分含量的测定卡尔·费休法(通用方法):GB6283—1986[S].北京:中国标准出版社,1987. [19] LI C J, XIA F, ZHANG W, et al. Semisynthesis of miltirone, 1, 2-dehydromiltirone, saligerone from carnosic acid and cytotoxities of their derivatives[J]. Tetrahedron Letters, 2018, 59(26): 2607-2609. (本文编辑 苏 维)

