“风寒湿”外邪影响Th17/Treg失衡促进类风湿关节炎病证发生的分子机制研究
张逢,戴宗顺,林也,蔡雄,宋厚盼,陈聪,廖菁

〔摘要〕 目的 探討Th17/Treg细胞在类风湿关节炎(痹证)中的表达情况及“风寒湿”外邪影响痹证发生的分子机制。方法 (1)雄性SD大鼠90只,随机分为正常对照组、单纯佐剂性关节炎(AIA)组和AIA风寒湿痹组,每组30只。正常对照组和单纯AIA组大鼠正常饲养;AIA风寒湿痹组每天置于人工智能气候箱内接受风寒湿刺激,14 d后单纯AIA组和AIA风寒湿痹组免疫含有热灭活结合杆菌的完全弗氏佐剂(CFA);AIA风寒湿痹组CFA免疫后风寒湿再刺激6 d。各组动物CFA免疫前1天、免疫后第6、10天,分离外周血单核细胞(PBMCs),流式细胞术检测CD4+Th17和CD4+CD25+Foxp3+Treg细胞,分析Th17/Treg细胞比例。(2)雄性SD大鼠20只,随机分为正常对照组和AIA风寒湿痹组,每组10只。正常对照组和AIA风寒湿痹组大鼠的实验条件同(1)。CFA免疫后第14天麻醉大鼠,分离PBMCs,流式细胞术检测外周血CD4+T细胞pSTAT3蛋白、CD4+IL-17+淋巴细胞pSTAT4和pSTAT6的蛋白平均荧光强度,RT-PCR检测外周血CD4+T细胞中RORγt、Foxp3、STAT3、STAT4、STAT6 mRNA的表达。结果 随着AIA风寒湿痹大鼠病情的进展,外周血CD4+Th17细胞比例逐渐增加,CD4+CD25+Foxp3+Treg细胞比例逐渐降低,与同时间点单纯AIA组大鼠比较,差异具有统计学意义(P<0.05或P<0.01)。与正常对照组比较,AIA风寒湿痹组大鼠外周血CD4+pSTAT3+和CD4+IL-17+pSTAT4+及CD4+IL-17+pSTAT6+蛋白表达量显著增加,CD4+T细胞中Foxp3 mRNA表达量显著降低,而RORγt、STAT3、STAT4、STAT6 mRNA表达量显著增加,差异具有统计学意义(P<0.05或P<0.01)。结论 “风寒湿”外邪可能通过JAK/STAT信号通路激活Th17细胞分化,并抑制Treg细胞分化,导致Th17/Treg细胞失衡,从而促进RA病证的发生。
〔关键词〕 类风湿关节炎;痹证;“风寒湿”外邪;Th17/Treg;JAK/STAT信号通路
〔中图分类号〕R255.6 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.11.003
Mechanistic Studies of Th17/Treg Imbalance Influenced by Exogenous Wind-cold-damp
Pathogens on the Development of Rheumatoid Arthritis
ZHANG Feng1, DAI Zongshun2, LIN Ye1, CAI Xiong1, SONG Houpan2, CHEN Cong2, LIAO Jing1,2*
(1. Hunan Key Laboratory of Chinese Medicine Powder and Innovative Drugs Established by Provincial and Ministry Training Bases, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Hunan Provincial Key Laboratory of Translational Research in TCM Formulas and Zheng, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China)
〔Abstract〕 Objective To observe the molecular mechanism of “wind-cold-damp” (FHS) exogenous pathogenic factors and the expression of Th37/Treg cells on Bi syndrom (rheumatoid arthritis, RA). Methods (1) Ninety male SD rats were randomly and evenly assigned into normal control group, simple adjuvant-induced arthrtis (AIA) group and FHS+AIA group. Normal control group and simple AIA group were normally fed, and the FHS+AIA group was placed in an intelligent artificial climate box every day to receive FHS stimulation. After 14 days of FHS stimulation, rats in the simple AIA group and FHS+AIA group were injected complete Freuds adjuvant (CFA) containing heat-inactivated Mycobacterium tuberculosi to establish AIA. FHS+AIA group continued to receive FHS stimulation for additional 6 days. Peripheral blood mononuclear cells (PBMCs) were isolated 1 day before, 6 and 10 days after CFA immunization. Percentages of CD4+Th17 and CD4+CD25+Foxp3+Treg cells were detected by flow cytometry. (2) Twenty male SD rats were randomly and evenly assigned into normal control group and FHS+AIA group. The experimental conditions of rats in normal control group and FHS+AIA group were the same (1). On day 14 after CFA injection, rats were anesthetized and blood specimens were collected for isolation of PBMCs. Mean fluorescence intensity of pSTAT3 protein in CD4+T cells, pSTAT4 and pSTAT6 proteins in CD4+IL-17+T cells were detected and analyzed by flow cytometry, and mRNA expression levels of RORγt, Foxp3, STAT3, STAT4, and STAT6 in CD4+T cells were examined by RT-PCR. Results With the progression of the disease in FHS+AIA group of rats, the proportion of peripheral blood CD4+Th17 cells gradually increased, and the proportion of CD4+CD25+Foxp3+Treg cells gradually
decreased, compared with the simple AIA group of rats at the same time point, the difference was statistically significant (P<0.05 or P<0.01). Compared with normal control group of rats, FHS+AIA group of rats showed significantly elevated fluorescent intensities of CD4+pSTAT3+, CD4+IL-17+pSTAT4+ and CD4+IL-17+pSTAT6+ proteins in the peripheral blood, markedly decreased mRNA level of Foxp3 and significantly increased mRNA levels of RORγt, STAT3, STAT4, and STAT6 detected in CD4+T cells, the difference was statistically significant (P<0.05 or P<0.01). Conclusion FHS exogenous pathogenic factors may activate the differentiation of CD4+Th17 cells and inhibit the differentiation of Treg cells through the JAK/STAT signaling pathway, leading to imbalance of Th17/Treg cells, thus promoting the occurrence of RA syndrome.
〔Keywords〕 rheumatoid arthritis; Bi syndrom; wind-cold-damp exogenous pathogenic factors; Th17/Treg; JAK/STAT signaling pathway
类风湿关节炎(rheumatoid arthritis, RA)是一种以关节滑膜慢性炎症、软骨及骨组织侵蚀,最终导致关节结构破坏、畸形为主要临床特征的慢性、系统性自身免疫疾病[1]。流行病学研究[2-3]表明,全球RA发病率约为0.5%~1.2%,我国RA患病率约为0.28%~0.36%,其5年致残率高达30%~50%,至今仍缺乏理想的治疗药物与方法,是造成劳动力丧失及致残的主要疾病之一。RA病因不明,发病机制复杂,目前认为主要与遗传、饮食和环境等因素有关[4]。根据其临床症状和体征,RA属于中医学“痹证”范畴,与中医古籍所记载的“历节”“鹤膝风”“尪痹”等病证相似[5]。对其病因病机的认识,《素问·痹论》有云:“风寒湿三气杂至,合而为痹也。其风气胜者为行痹、寒气胜者为痛痹、湿气胜者为着痹也”“不与风寒湿气合,故不为痹”[6-7]。另外,痹的产生与饮食和生活环境有关,所谓“食饮居处,为其病本也”[6]。
基于“风寒湿三气杂至合而为痹也”的中医经典理论和现代医学对于环境因素在RA发病机制中重要作用的认识,推测“风寒湿”外邪能显著影响RA的发生和/或发展。选择应用最广泛的经典佐剂性关节炎(adjuvant-induced arthrtis, AIA)动物模型,采用改良人工智能气候箱,给予大鼠风寒湿刺激,再诱导AIA的方案,研究“风寒湿”外邪刺激对AIA发生发展的影响[8]。李鑫等[9]研究表明,“风寒湿”外邪只影响AIA的发生,其在疾病初发阶段中医证候表现为风寒湿痹证。
RA的特征是以大量CD4+T细胞浸润为主的慢性滑膜炎症反应,而大鼠AIA也是一种T细胞介导的免疫性炎症动物模型[10]。CD4+T细胞作为效应T细胞的重要成分,可参与免疫应答过程中的各个阶段,其介导的免疫反应异常被认为是RA的主要发病机制之一[9-10]。用流式细胞仪初步检测了风寒湿刺激14 d后大鼠外周血T细胞种类和表面抗原,显示CD4+T细胞亚群数量明显升高[9]。根据其产生的细胞因子及其与之相关的功能不同,通常将CD4+T细胞分为Th1、Th2、Th17和Treg四大亚群。课题组前期研究发现,与正常饲养大鼠比较,风寒湿刺激大鼠可见CD4+Th17细胞亚群明显增多,血清IL-17含量显著升高[11]。因此,本研究主要围绕CD4+Th17分化和Th17/Treg失衡,进一步深入探讨“风寒湿”外邪影响类风湿关节炎(痹证)发生的分子机制,以期为中医论治痹证与相关药物研发提供参考。
1 材料
1.1 实验动物
SPF级SD雄性大鼠,体质量为90~110 g,购自湖南斯莱克景达实验动物有限公司,许可证号:SCXX(湘)2011-0003,合格证编号:43004700008303;43004700008412;43004700008456;43004700008423。饲养处及实验地:湖南中医药大学实验动物中心SPF级实验室,许可证号:SYXK(湘)2019-0009,室温(22±3) ℃,相对湿度40%~70%,自由采食,分笼饲养。动物房中明暗交替(12 h白天∶12 h黑夜),动物适应环境7 d后开始进行实验。
1.2 主要试剂
热灭活结合杆菌H37Ra(批号:20170320)、矿物油(批号:M8410)、Ficoll淋巴细胞分离液(批号:F4375)均购自美国Sigma Aldrich公司;抗鼠CD4抗体(批号:11-0040-81)、抗鼠IL-17抗体(批号:12-7177-81)、抗鼠CD25抗体(批号:12-0251-81)、抗鼠pSTAT3抗体(批号:MA5-32089)、抗鼠pSTAT4抗体(批号:71-7900)、抗鼠pSTAT6抗体(批号:PA5-104892)、抗鼠Foxp3-APC抗体(批号:17-5773-80)、试剂A破膜剂(批号:23228)、试剂B破膜剂(批号:23224)均购自美国eBioscience公司;异氟烷气体麻醉剂(深圳市瑞沃德生命科技有限公司,批号:084989);逆转录试剂盒(美国ABI公司,批号:4374967);SYBR Premix Ex TaqTM II RORγt试剂盒(上海生物工程技术公司,批號:B110032)。
1.3 主要仪器
改良人工智能气候箱(上海汗诺仪器公司,型号:PRX-150);250i细胞二氧化碳培养箱(型号:51033587)、超微量核酸定量检测仪(型号:701-058112)均购自美国Thermo Fisher公司;全自动细胞计数器(美国Bio-Rad公司,型号:TC20);荧光定量PCR仪(瑞士Roche公司;型号:AXYPCR384LC480CNF);气体麻醉机(美国SurgriVet公司,型号:SurgiVet CDS9000);流式细胞分析仪(美国Becton Dickinson公司,型号:TM X-20);台式超高速冷冻离心机(美国Beckman Coulter公司,型号:Allegra 64R);电子天平(日本岛津公司,型号:ATY224)。
2 方法
2.1 AIA风寒湿痹大鼠体内Th17/Treg细胞失衡检测
2.1.1 分组与造模 动物模型构建参考文献[8-9],90只雄性SD大鼠随机分为正常对照组、单纯AIA组和AIA风寒湿痹组,每组30只。正常对照组和单纯AIA组大鼠正常饲养14 d;AIA风寒湿痹组大鼠每天置于人工智能气候箱内接受风寒湿刺激(风速5 m/s、温度0~2 ℃、相对湿度90%~95%)1次,每次4 h,14 d后,除正常对照组外,其他两组于尾根部皮下注射0.1 mL含200 g Mtb的CFA诱导AIA,AIA风寒湿痹组CFA免疫后继续接受风寒湿刺激6 d。
2.1.2 AIA关节炎指数评定 CFA免疫后,依据大鼠多发性关节炎的特性,采用5级评分法[12]对CFA免疫后的大鼠进行关节炎指数评分:正常情况,无红肿,计0分;脚趾关节红斑或轻度红肿,计1分;趾关节和足跖或踝关节中度红肿,记2分;踝关节以下足爪全部红肿或者踝关节重度红肿,计3分;裸关节在内全部足爪红肿变形,计4分,最高每只可达16分。
2.1.3 流式细胞术检测外周血CD4+Th17和CD4+CD25+Foxp3+Treg的细胞比例 CFA免疫前1天、免疫后第6、10天分别麻醉大鼠,腹主动脉取血,用淋巴细胞分离液分离出外周血单核细胞(peripheral blood mononuclear cell, PBMCs),用RPMI 1640培养液制成单细胞悬液,调整细胞密度为1×107/mL,稀释FITC标记的抗鼠CD4抗体(1∶200),每个样本2.0 μL染色30 min,冰上孵育;洗涤后,按细胞内染色试剂盒说明书进行后续细胞内染色;固定破膜,洗涤3次;分别加稀释PE标记的抗鼠IL-17(1∶400)、Foxp3-APC(1∶300)和CD25-PE抗体(1∶400),4 ℃避光孵育30 min,洗涤,对照管加入同型对照。上流式细胞分析仪检测,应用BD Cell Quest软件获取数据进行分析。
2.2 AIA风寒湿痹大鼠JAK/STAT信号通路检测
2.2.1 分组与造模 雄性SD大鼠,体质量90~110 g,随机分为正常对照组和AIA风寒湿痹组,每组10只。正常对照组大鼠正常饲养;AIA风寒湿痹组大鼠风寒湿刺激14 d后,于尾根部皮下免疫含Mtb的CFA,继续接受风寒湿刺激6 d,风寒湿刺激和AIA免疫方法同“2.1.1”项。
2.2.2 流式细胞术检测外周血CD4+T细胞pSTAT3蛋白、CD4+IL-17+淋巴细胞pSTAT4和pSTAT6蛋白的含量 CFA免疫后14 d,麻醉大鼠,腹主动脉取血,用淋巴细胞分离液分离出PBMCs,用RPMI 1640培养液制成单细胞悬液,调整细胞密度为1×107/mL。以稀释后的CD4-FITC(1∶200)设门,固定破膜,根据需要,分别用稀释后的IL-17-APC(1∶300)、pSTAT3-PE(1∶400)、pSTAT4-PE(1∶400)、pSTAT6-PE(1∶400)染色,洗涤后上机检测。CD4+pSTAT3+蛋白平均荧光强度代表CD4+T细胞JAK/STAT信号通路活化状态。CD4+IL-17+pSTAT4+和CD4+IL-17+pSTAT6+蛋白平均荧光强度代表CD4+T细胞中Th17细胞JAK/STAT通路的活化状态。
2.2.3 RT-PCR检测外周血CD4+T细胞中RORγt、Foxp3、STAT3、STAT4和STAT6 mRNA表达 PBMCs经免疫磁珠法分选CD4+T细胞,设计引物,其中各基因PCR引物序列见表1。Trizol提取滑膜组织总RNA,紫外分光光度计测定RNA含量及纯度,逆转录合成cDNA,并进行定量PCR扩增。以GAPDH为内参。数据以ABI自带软件SDS对RT-PCR进行分析,RORγt mRNA表达水平代表Th17细胞水平,Foxp3 mRNA表达水平代表Treg细胞水平,STAT3、STAT4、STAT6 mRNA表达水平代表CD4+T細胞JAK/STAT通路的活化状态。
2.3 统计学分析
采用SPSS 23.0统计软件进行分析,计量资料描述用“x±s”表示,两组间比较采用独立样本t检验,多组间均数比较采用单因素方差分析,方差齐时,用LSD法;方差不齐时,用Dunnett3法。以P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
3 结果
3.1 各组大鼠外周血CD4+Th17细胞比例
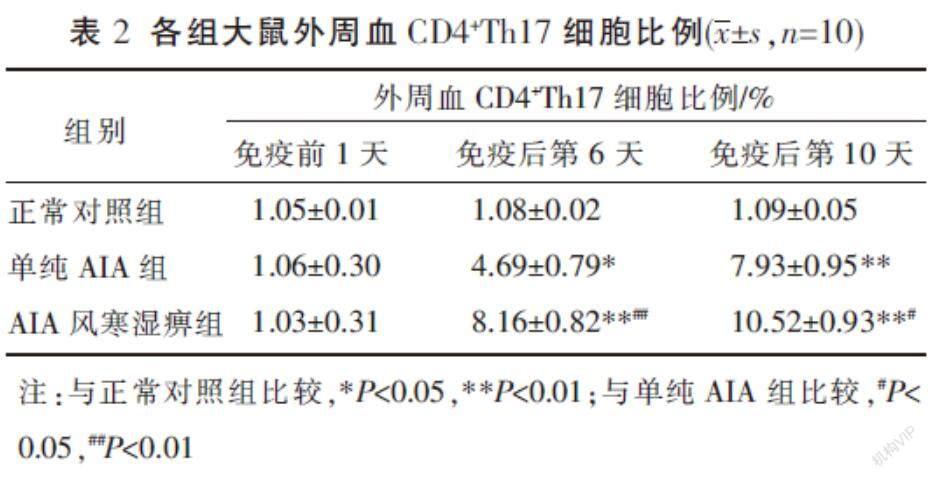
免疫前1天,各组间的CD4+Th17细胞比例比较,差异无统计学意义(P>0.05)。在免疫后第6、10天,与正常对照组相比,单纯AIA组及AIA风寒湿痹组大鼠的外周血CD4+Th17细胞比例均增加(P<0.05,P<0.01);同时间点,AIA风寒湿痹组与单纯的AIA组相比,CD4+Th17细胞比例增加(P<0.05,P<0.01)。见表2。
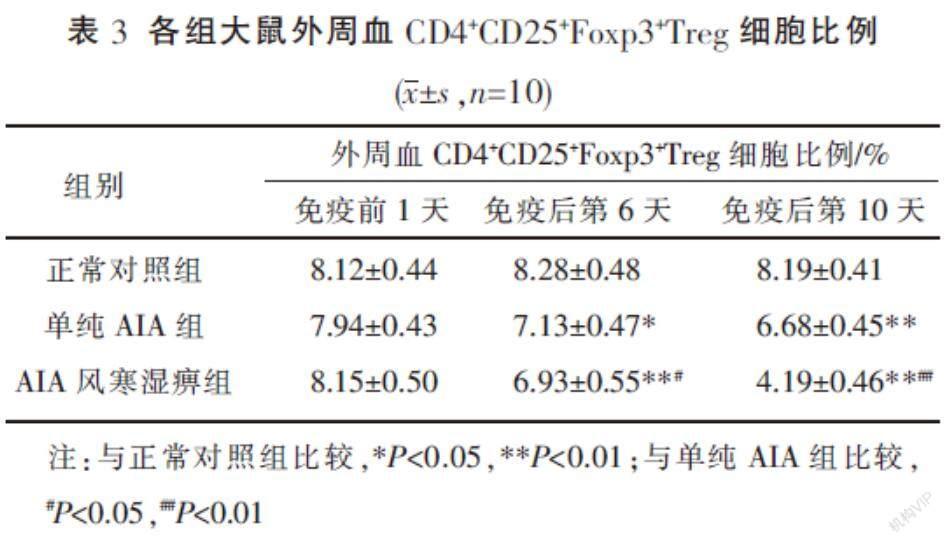
3.2 各组大鼠外周血CD4+CD25+Foxp3+Treg细胞比例 免疫前1天,各组间的CD4+CD25+Foxp3+Treg细胞比例比较,差异无统计学意义(P>0.05)。在免疫后第6、10天,与正常对照组相比,单纯AIA组及AIA风寒湿痹组大鼠的外周血CD4+CD25+Foxp3+Treg细胞比例均降低(P<0.05,P<0.01);同时间点,AIA风寒湿痹组与单纯AIA组相比,CD4+CD25+Foxp3+Treg细胞比例降低(P<0.05,P<0.01)。见表3。
3.3 各组大鼠外周血CD4+pSTAT3+、CD4+IL-17+pSTAT4+和CD4+IL-17+pSTAT6+蛋白表达比较
与正常对照组比较,AIA风寒湿痹组外周血CD4+pSTAT3+、CD4+IL-17+pSTAT4+及CD4+IL-17+pSTAT6+蛋白表达量增加(P<0.05,P<0.01)。见表4。
3.4 各组大鼠外周血CD4+T细胞中RORγt、Foxp3
mRNA表達水平比较
与正常对照组比较,AIA风寒湿痹组外周血CD4+T细胞中Foxp3 mRNA表达量降低,RORγt mRNA表达量增加(P<0.01)。见表5。
3.5 各组大鼠外周血CD4+T细胞中STAT3、STAT4、STAT6 mRNA表达水平比较
与正常对照组比较,AIA风寒湿痹组外周血CD4+T细胞中STAT3、STAT4、STAT6 mRNA表达量增加(P<0.05,P<0.01)。见表6。
4 讨论
RA属于中医“痹证”中最为常见的临床疾患之一,是一种以慢性侵蚀性关节炎为主要特征的自身免疫性疾病。RA病因不明,发病机制复杂,其分子病理特征是以大量CD4+T细胞浸润为主的慢性滑膜炎症反应。Th17细胞是CD4+T细胞新亚型,高分泌IL-17等炎性细胞因子,促进炎症反应和延续骨破坏进程[13]。RA患者外周血CD4+T细胞中Th17细胞的比例增加,而Treg细胞的比例降低,导致Th17/Treg细胞失衡,而Treg细胞通过直接接触或产生抑制性细胞因子(如TGF-、IL-10)对自身反应T细胞活化和增殖起负调控作用[14-15]。本研究结果显示,RA风寒湿痹大鼠存在Th17/Treg细胞失衡现象,风寒湿刺激大鼠外周血CD4+Th17细胞比例较单纯AIA组显著增加(P<0.05,P<0.01),Treg细胞比例显著降低(P<0.05,P<0.01),Th17/Treg细胞比例处于失衡状态。
有研究[16]表明,JAK/STAT信号通路活化参与RA的发生,且炎症位点中的T细胞分化由JAK/STAT信号通路激活所介导。在树突细胞、单核细胞等抗原呈递细胞(antigen presenting cell, APC)作用下,IL-6协同低浓度的TGF-β,激活JAK1,进而招募STAT3,并使其磷酸化,活化的JAK1/STAT3通路激活RORγt,使初始 CD4+T细胞向Th17细胞分化[17-18]。同时,在Th17分化的负向调节研究中,细胞因子信号转导抑制蛋白因子3(suppressor of cytokine signaling3, SOCS3)是重要的负向调节因子,它通过抑制STAT3的磷酸化发挥作用[19]。RORγt被认为是Th17细胞谱系特异性的转录激活因子,可诱导调控IL-17的高水平分泌,并抑制Treg细胞分化[20]。Th17细胞被转录因子STAT4和STAT6调控,生成IL-17,同时可产生IL-23、IL-6和TNF-α等炎性细胞因子,IL-23可促进激活的记忆细胞产生IL-17,使Th17细胞得以存活和维持功能[17]。Foxp3是Treg的特异性标志物,其持续表达是维持Treg活性的关键因素。研究[21-22]表明,RA患者外周血RORγt表达量显著增加,Foxp3表达量显著降低。本研究结果显示,AIA风寒湿痹大鼠外周血RORγt表达量显著增加,Foxp3表达量显著降低,与文献报道一致,提示AIA风寒湿痹大鼠Th17/Treg细胞处于失衡状态。研究[23-24]显示,RA患者STAT3、STAT4、STAT6 mRNA表达量显著增加。本研究结果显示,AIA风寒湿痹大鼠外周血CD4+T细胞中STAT3、STAT4、STAT6 mRNA表达量显著增加(P<0.05,P<0.01),RORγt和Foxp3 mRNA表达量也显著增加(P<0.05,P<0.01),提示JAK/STAT信号通路活化并参与了炎症位点中的T细胞分化。
综上,“风寒湿”外邪可能通过激活JAK/STAT信号通路,并在STAT3、STAT4、STAT6、RORγt及Foxp3 mRNA的参与下,激活Th17细胞分化,并抑制Treg细胞分化,导致Th17/Treg细胞失衡,从而促进炎症发生。
参考文献
[1] SMOLEN J S, ALETAHA D, BARTON A, et al. Rheumatoid arthritis[J]. Nature Reviews Disease Primers, 2018, 4: 18001.
[2] SAFIRI S, KOLAHI A A, HOY D, et al. Global, regional and national burden of rheumatoid arthritis 1990-2017: A systematic analysis of the Global Burden of Disease study 2017[J]. Annals of the Rheumatic Diseases, 2019, 78(11): 1463-1471.
[3] LI Z G. A new look at rheumatology in China—opportunities and challenges[J]. Nature Reviews Rheumatology, 2015, 11(5): 313-317.
[4] 栗占國.类风湿关节炎年度回顾[J].医学研究杂志,2013,42(3):4-5.
[5] 林 也,廖 菁,戴宗顺,等.风寒湿外邪作用于EPO影响痹证(类风湿关节炎)的发生[J].湖南中医药大学学报,2021,41(3):345-349.
[6] 潘胡丹,刘 良.类风湿关节炎中医治疗经验探讨[J].中医杂志,2016,57(2):173-175.
[7] 吴晋英,李俊莲,张世霞.《金匮要略》痹证探析[J].中国中医基础医学杂志,2013,19(5):496,520.
[8] 林 也,戴宗顺,张 婷,等.基于“以方测证”的类风湿关节炎风寒湿痹证动物模型的构建研究[J].湖南中医药大学学报,2021,41(5): 668-672.
[9] 李 鑫,魏艳霞,林 也,等.风寒湿外邪对痹证(佐剂性关节炎)发生发展的影响[J].中国中西医结合杂志,2017,37(12):1496-1501.
[10] VAN EDEN W, WAKSMAN B H. Immune regulation in adjuvant-induced arthritis: Possible implications for innovative therapeutic strategies in arthritis[J]. Arthritis & Rheumatism, 2003, 48(7): 1788-1796.
[11] 林 也.基于以方测证的类风湿关节炎风寒湿痹病证结合动物模型构建研究[D].长沙:湖南中医药大学,2019.
[12] CAI X, WONG Y F, ZHOU H, et al. The comparative study of Sprague-Dawley and Lewis rats in adjuvant-induced arthritis[J]. Naunyn-Schmiedebergs Archives of Pharmacology, 2006, 373(2): 140-147.
[13] MIOSSEC P, KORN T, KUCHROO V K. Interleukin-17 and type 17 helper T cells[J]. The New England Journal of Medicine, 2009, 361(9): 888-898.
[14] BETTELLI E, CARRIER Y, GAO W D, et al. Reciprocal
developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells[J]. Nature, 2006, 441(7090): 235-238.
[15] BEHRENS F, HIMSEL A, REHART S, et al. Imbalance in distribution of functional autologous regulatory T cells in rheumatoid arthritis[J]. Annals of the Rheumatic Diseases, 2007, 66(9): 1151-1156.
[16] KRAUSE A, SCALETTA N, JI J D, et al. Rheumatoid arthritis synoviocyte survival is dependent on Stat3[J]. Journal of Immunology, 2002, 169(11): 6610-6616.
[17] MATHUR A N, CHANG H C, ZISOULIS D G, et al. Stat3 and Stat4 direct development of IL-17-secreting Th cells[J]. Journal of Immunology (Baltimore, Md : 1950), 2007, 178(8): 4901-4907.
[18] WU H X, YAN S X, CHEN J Y, et al. JAK1-STAT3 blockade by JAK inhibitor SHR0302 attenuates inflammatory responses of adjuvant-induced arthritis rats and decreases Th17 and total B cells[J]. Joint Bone Spine, 2016, 83(5): 525-532.
[19] KIM E K, KWON J E, LEE S Y, et al. IL-17-mediated mitochondrial dysfunction impairs apoptosis in rheumatoid arthritis synovial fibroblasts through activation of autophagy[J]. Cell Death & Disease, 2017, 8(1): e2565.
[20] KLUGER M A, NOSKO A, RAMCKE T, et al. RORγt expression in Tregs promotes systemic lupus erythematosus via IL-17 secretion, alteration of Treg phenotype and suppression of Th2 responses[J]. Clinical and Experimental Immunology, 2017, 188(1): 63-78.
[21] SUN H Q, GAO W W, PAN W P, et al. Tim3+Foxp3+ tregcells are potent inhibitors of effector T cells and are suppressed in rheumatoid arthritis[J]. Inflammation, 2017, 40(4): 1342-1350.
[22] KANEKO S, KONDO Y, YOKOSAWA M, et al. The RORγt-CCR6-CCL20 axis augments Th17 cells invasion into the synovia of rheumatoid arthritis patients[J]. Modern Rheumatology, 2018, 28(5): 814-825.
[23] WALKER J G, AHERN M J, COLEMAN M, et al. Expression of Jak3, STAT1, STAT4, and STAT6 in inflammatory arthritis: Unique Jak3 and STAT4 expression in dendritic cells in seropositive rheumatoid arthritis[J]. Annals of the Rheumatic Diseases, 2006, 65(2): 149-156.
[24] 呂 卓,李 娟,冯知涛,等.RA患者外周血HLA-DR4、PAD4、STAT4 mRNA表达及与疾病活动的相关性[J].南方医科大学学报,2010,30(6):1349-1353.
(本文编辑 匡静之 周 旦)

