解脂耶氏酵母中光控表达系统的构建及其应用研究
张萍,魏文平,周英,叶邦策,
(1 华东理工大学微分析与生物系统工程实验室,生物反应器工程国家重点实验室,上海 200237;2 浙江工业大学工程生物学与健康研究中心,长三角绿色制药协同创新中心,药学院,浙江 杭州 310014)

人工构建的调控元件是改造细胞可控地生产目标产物的重要改造工具[1-2],光诱导型传感器作为一类重要的控制元件,在底盘细胞的工程化改造过程中展现出很好的应用潜力[3-4]。之前传统的基因诱导表达系统虽然可高效快速地得到目标产物,但由于一些化学型诱导剂价格昂贵、易产生细胞毒性、难清除等缺陷,限制其在工业化生产中的应用;光作为一种诱导因子具有快速无毒,可将诱导信号迅速地传递至细胞内的优势,在不改变宿主代谢条件的前提下,可实现靶标基因时间空间上的精确表达,具有较好的应用潜力。在实际操作中可根据光照强度和时间,调节靶标基因的表达水平[5],或者通过切换光照和黑暗条件,使光效应蛋白发生光依赖型的构象变化,从而达到可逆转诱导效果。 Zhao 等在酿酒酵母(Saccharomyces cerevisiae)中引入光诱导表达系统,将异丁醇的产量提高到(8.49±0.31)g/L[6];之后为了克服持续性产物代谢途径激活产生的不良后果,如与初级代谢的能量竞争及有毒中间代谢产物积累等造成细胞生物量下降等负面影响,他们以脱氧核糖乙酸合成途径为模型,利用光遗传控制对酵母细胞代谢进行区域化动态调控,通过降低中间代谢产物浓度和减少竞争途径能量流消耗,最终使产物合成产量提高了6 倍[7]。此外,Tandar 等[8]通过对葡萄糖-6-磷酸异构酶的光控表达,调节EMP/PPP 流量比,优化前体和还原力供给,并最终在光控传感器的作用下提高了甲羟戊酸等产物的产量。但如何选择具有应用优势且适配性好的底盘细胞仍是限制光控传感器开发的首要 问 题 之 一[9-10]。 解 脂 耶 氏 酵 母(Yarrowia lipolytica)是非常规酵母中最具代表性的一种,是近年应用较为广泛的一种底盘细胞[11-14],具有利用底物谱广,安全性高,耐酸及有机溶剂,在代谢过程中可大量产生合成聚酮类、黄酮类和萜类化合物所必需的前体物acetyl-CoA 和malonyl-CoA 等众多优势[11,15-25],已被广泛应用于多种食品及药品的发酵生产领域。目前,在Y. lipolytica中已经成功地开发了脂肪酸诱导型启动子[26]、铜离子响应传感器[27]和木糖诱导型传感器[28]等调控元件,但还未见时空动态调控元件的报道,光诱导型传感器在一定程度上可以弥补这一缺陷。本研究中利用的光敏调控系统来自于革兰氏阴性细菌(如Myxococcus xanthus、Thermus thermophilus),是一套细菌自发的防御机制,目的是保护自身免受光的氧化。在这些生物体中,CarH 是一种光响应转录调控因子,调控胡萝卜素基因簇的表达,而它的活性和光敏性依赖于腺苷钴胺素(AdoB12)。Chatelle 等[4]利用T.thermophilus来源的 CarH 及其同源DNA操纵序列CarO在哺乳动物细胞中构建了一套光控转录系统;经过诱导型启动子中CarO的数量等参数优化,可以实现350倍的诱导倍数;此研究展现出这一系统在真核系统中的应用前景。
对香豆酸和柚皮素主要来源于植物,具有多种保健功效,而从植物中提取受季节和产地等多种因素影响较大,利用微生物法合成具有显著优势,如生产强度高、反应条件温和、成本低廉等。对香豆酰-CoA 是白藜芦醇、柚皮素、芹菜素、野黄芩素等黄酮类化合物以及生物碱等天然产物的合成前体,而对香豆酸是合成对香豆酰-CoA 的必要前体物质,对高效生物合成众多天然活性产物具有重要的意义[18-19,29-32]。对香豆酸又名对羟基肉桂酸(CAS号:501-98-4),是植物苯丙烷途径的上游代谢物,具有强大的抗氧化、抗菌和抗炎特性,也是多种功能活性成分的前体物质[29-30]。柚皮素就是其中的一种重要衍生物,属于天然黄酮类的化合物,具有抗炎、抗氧化、抗病毒等多种重要的药理活性,具有重要的应用价值[18]。由于两者都来源于植物,来源受限,有必要利用合成生物学方法,通过代谢工程手段,实现植物来源天然产物在微生物中的异源高效合成;然而,微生物底盘细胞的改造过程受制于高效调控元件的限制,发掘性能优良、适配性好的多样化调控元件,有助于实现不同来源天然产物在微生物细胞中的生产。
本研究利用细菌来源的CarH 作为绿光诱导因子[4],以 VPRH 结构域[28]为转录激活因子,在真核细胞Y. lipolytica中构建基于复合因子CarHVPRH 为绿光响应元件的光控表达系统,该系统可以在绿光和黑暗条件下对报告基因mcherry进行转录调控,并且具有及时响应的动态调控优势;在此基础上,将其应用于Y. lipolytica中构建对香豆酸及柚皮素的光诱导型合成途径。实现在绿光及黑暗条件下对合成途径的干预性调控,有利于动态调节前体及产物合成,平衡细胞生长与产物积累之间的关系,为Y. lipolytica的光诱导型元件的开发提供了可精准动态调控的传感器工具。
1 材料与方法
1.1 材料
1.1.1 菌株、质粒与引物
本研究使用的菌株和质粒见表1。本研究合成的引物序列见表2。

表1 本研究所用的质粒和菌株Tab.1 Plasmids and strains used in this study

表2 本研究中使用的引物Tab.2 Primers used in this study
1.1.2 培养基
YNB-Leu 固体培养基(100 mL):酵母基础氮源(yeast nitrogen base W/O)0.67 g,葡萄糖1 g,L-亮氨酸0.05 g,琼脂2 g。
YNB 固体培养基(100 mL):酵母基础氮源0.67 g,葡萄糖1 g,琼脂2 g。
YPD 液体培养基(100 mL):蛋白胨2 g,葡萄糖2 g,酵母提取物1 g。
1.1.3 主要试剂和仪器
试剂:限制性核酸内切酶购自TaKaRa公司;高保真聚合酶(Phanta Max Super-Fidelity DNAPolymerase)购自南京诺唯赞公司;LB 培养基、琼脂及葡萄糖购自上海捷瑞生物工程有限公司;蛋白胨及酵母提取物购自OXOⅠD 公司;酵母基础氮源及L-亮氨酸购自Solarbio 公司;腺苷钴胺素(coenzyme B12)购自阿拉丁公司;酵母转化试剂盒Frozen-EZ yeast transformation Ⅱ 购 自 ZYMO RESEARCH 公司;PCR 纯化试剂盒及同源重组试剂盒购自全式金(北京)生物技术有限公司。
仪器:上海精宏电热恒温培养箱;上海精宏恒温摇床;Biotek Synergy2 多功能酶标仪;岛津Prominence-ⅠLC-2030 系列高液相色谱仪;艾瑞嘉LED绿光灯10 W(520~530 nm);尼康激光共聚焦显微镜。
1.2 质粒设计与构建
1.2.1 信号输出模块构建
以pSET152-Pj23119-2CarO-GFP 质粒为模板,使 用 引 物 SalⅠ-Pj23119F 和 CarO-TEF-R 扩 增 得 到2CarO;以p13-Tm 质粒为模板,使用引物CarOTEF-F 和 StuⅠ-XPR2-277R 扩 增 得 到 TEF-mCherry-XPR2; 以 2CarO 和 TEF-mCherry-XPR2 为 模 板 ,使用引物 SalⅠ-Pj23119F 和 StuⅠ-XPR2-277R 进行融合PCR,得到2CarO-TEF-mCherry-XPR2。此片段即为含有CarO 位点、TEF 核心启动子序列和报告基因mCherry的信号输出模块。
1.2.2 激活因子复合体CarH-VPRH 的表达模块构建
以pUC57-CarH 质粒为模板, 使用引物1312CarH-F 和 CarH-VPRH-R 扩增得到 CarH(GeneⅠD:3169555);以 pUC57-VPRH 质粒为模板,使用引物 CarH-VPRH-F 和 KpnⅠHSF1-R,扩增得到VPRH[28]; 以 CarH 和 VPRH 为 模板 ,使 用 引 物1312CarH-F 和 KpnⅠHSF1-R 进行融合 PCR,得到CarH-VPRH。用限制性核酸内切酶PmlⅠ和KpnⅠ酶切pⅠNA1312 质粒,酶切产物使用PCR 纯化试剂盒纯化。将CarH-VPRH 插入到上述酶切pⅠNA1312质粒中以构建质粒p13-CV。
1.2.3 绿光响应质粒p13-CV-2CarO-Tm构建
用限制性核酸内切酶SalⅠ和StuⅠ酶切p13-CV 质粒,并将片段2CarO-TEF-mCherry-XPR2 通过同源重组的方式插入到上述位点中(SalⅠ和StuⅠ)以构建质粒p13-CV-2CarO-Tm。
1.2.4 对香豆酸合成质粒p13-CV-2CarO-TAL构建
以p13PxoTAL 质粒为模板,使用引物TEFTAL-F 和 StuⅠ-XPR2-277R 扩增得到 TAL;使用引物 SalⅠ-Pj23119F 和 StuⅠ-XPR2-277R,将诱导型启动子2CarO-TEF 与 TAL 进行融合 PCR,得到2CarO-TEF-TAL,并通过同源重组的方式组装到SalⅠ和StuⅠ双酶切的p13-CV 质粒中以构建质粒p13-CV-2CarO-TAL。
1.2.5 柚皮素合成质粒p12-4CC构建
以p12-4CL 质粒为模板,使用引物1269-SpeⅠ-XPR2-F 和 FBAin-CYCt-R 扩 增 得 到 FBAin-4CL;以pCas-AXPCHSCHⅠ质粒为模板,使用引物FBAin-CYCt-F 和 1269-SpeⅠ-XPR2-R 扩 增 得 到CHS-Pexp1-FBAin-CHⅠ。用限制性核酸内切酶SpeⅠ酶切pⅠNA1269 质粒,酶切产物使用PCR 纯化试剂盒纯化。将FBAin-4CL 和CHS-Pexp1-FBAin-CHⅠ通过多片段同源重组的方式组装到SpeⅠ酶切的pⅠNA1269质粒中以构建质粒p12-4CC。
1.3 酵母重组菌构建
本研究使用的骨架质粒pⅠNA1312和pⅠNA1269需要酶切线性化处理后转入Po1f 菌株。酶切线性化体系(200 μL):超纯水洗脱的质粒溶液140 μL,缓 冲 液 0.1% BSA、 10×H Buffer、 0.1% Triton各 20 μL,内切酶NotⅠ 3 μL。反应条件 37 ℃水浴4 h。酶切反应结束后,使用PCR 纯化试剂盒纯化酶切产物,最后用50~80 μL 超纯水洗脱酶切线性质粒并用于酵母转化。酵母转化步骤参考转化试剂盒Frozen-EZ yeast transformation Ⅱ的试剂比例和操作步骤。待转化步骤结束后,将酵母菌液涂布在YNB-Leu 或YNB 固体平板上,30 ℃培养48 h。
1.4 菌株的筛选和培养
转化筛选和纯化培养含有pⅠNA1312 衍生质粒的菌株的培养基为YNB-Leu固体培养基,在此基础上进一步转化质粒p12-4CC的菌株的培养基为YNB固体培养基。菌株种子液的培养以及光诱导培养基为YPD 液体培养基。挑选能够在YNB-Leu 或YNB固体平板上生长的酵母单菌落于装有1.2 mL YPD液体培养基(含20 μmol/L 腺苷钴胺素)的24 孔的深孔板(有不透光的盖子覆盖,可视为黑暗条件),并于30 ℃、220 r/min恒温摇床培养48 h。48 h后各孔吸取700 μL 菌液测定荧光值(RFU)和600 nm 处的光密度(OD600),以此荧光强度较高的菌株作为能够发挥CarH-VPRH激活作用的菌株。
1.5 光诱导实验
转接含有光控传感器质粒的Y. lipolytica进行绿光响应性能测试。以不包裹锡箔纸的透明的锥形瓶作为诱导实验组,以包裹锡箔纸的锥形瓶作为黑暗条件实验组。培养基为YPD(含20 μmol/L腺苷钴胺素),装液量为5/25(25 mL 锥形瓶中装有5 mL 的 YPD 培养基)。在装有绿光灯(520~530 nm)的恒温摇床(30 ℃,220 r/min)中培养,锥形瓶和绿光灯的距离为12 cm,培养72 h,取样测定RFU 与OD600值,评价诱导效果。培养测试时按照种子液OD600=5,接种量1%的条件接种培养。种子液培养条件为:30 ℃,220 r/min,YPD 培养基,培养24 h。
1.6 腺苷钴胺素浓度优化
对CarH-VPRH 发挥激活作用所必需的腺苷钴胺素的浓度进行优化。以Yl-CVH 为测试菌株,其培养条件同光诱导实验,并设置腺苷钴胺素浓度梯度为:0 μmol/L、5 μmol/L、10 μmol/L、15 μmol/L、20 μmol/L,每个浓度梯度分别设置光照组和黑暗组。培养48 h,取样700 μL菌液测定RFU与OD600值。
1.7 绿光响应传感器的动态响应实验
接种绿光响应菌株Yl-CVH 进行绿光响应传感器动态响应光照条件变化的性能测试。对Yl-CVH设置3 组不同光照条件:①0~24 h 绿光照射,24~36 h 黑暗,36~48 h 绿光照射,48~60 h 黑暗,60~72 h 绿光照射,72~84 h 黑暗,84~96 h绿光照射,96~108 h 黑暗,108~120 h 绿光照射;②始终绿光照射;③始终黑暗,同时进行光诱导培养(方法参照1.5),并均在0 h、24 h、48 h、72 h 和 96 h 补 加 15 μmol/L 腺 苷 钴 胺 素 。 培 养120 h,每隔12 h取样测定RFU与OD600值。
1.8 对香豆酸合成菌株构建与产量测定
本研究选择来自黏红酵母(Rhodotorula glutinis)的酪氨酸解氨酶(tyrosine ammonia lyase,TAL)编码基因tal(GenBank:KF765779.1)[33],将其置于光诱导型启动子下游并构建工程菌株,以工程菌株的对香豆酸合成产量为考察指标,测试绿光响应系统在天然产物合成方面的潜力。菌株Po1f 中转入经过线性化处理的p13-CV-2CarO-TAL 质粒(步骤如1.3 和1.4),以得到对香豆酸合成菌株Yl-CA。对Yl-CA 设置3 组不同的光照条件:①始终绿光照射;②始终黑暗;③0~48 h 黑暗,48 h 后绿光照射,同时进行光诱导培养(方法参照1.5),培养96 h并取样利用HPLC检测对香豆酸产量。具体检测方法可参照Wei等[34]建立的检测方法。
1.9 柚皮素合成菌株构建与产量测定
在对香豆酸合成菌株中进一步引入来自拟南芥(Arabidopsis thaliana)的4-香豆酸辅酶A 连接酶(4-coumaroyl-CoA ligase,4CL)编码基因4c(lGeneⅠD:841593)、 查 尔 酮 合 酶(chalcone synthase,CHS)编码基因ch(sGene ⅠD:831241)、查尔酮异构酶(chalcone isomerase,CHⅠ)编码基因ch(iGeneⅠD:830409)[33-35],以实现柚皮素的从头合成。菌株Yl-CA 中转入经过线性化处理的p12-4CC 质粒(步骤如1.3 和1.4),得到柚皮素合成菌株Yl-NA。对Yl-NA 设置4 组不同的光照条件:①0~24 h 绿光照射,24 h 后黑暗;②0~48 h 绿光照射,48 h后黑暗;③始终绿光照射;④始终黑暗,同时进行光诱导培养(方法参照1.5),4 组均在0 h 添加15 μmol/L 腺苷钴胺素;其中①和②组分别在24 h和 48 h 再添加 15 μmol/L 腺苷钴胺素,培养 96 h 并取样利用HPLC检测对香豆酸和柚皮素产量。具体检测过程可参照Wei等[34]建立的检测方法。
2 结果与分析
2.1 绿光响应传感器的构建
2.1.1 绿光响应传感器设计
本研究中应用的光响应元件CarH 是一种绿光响应的转录因子[36]。CarH 的 DNA 结合活性和光敏性依赖于辅酶脱氧腺苷钴胺素(AdoB12)。在无光条件下,AdoB12连接的CarH四聚体与启动子序列的CarO 位点结合,发挥转录调节作用,抑制下游基因的转录和表达。Chatelle 等[4]利用真核细胞通用型的激活结构域的激活性能,设计了CarHVP64 复合体,将其原本对下游基因的转录和表达的抑制作用改造为转录激活作用。同理,鉴于底盘细胞Y. lipolytica的真核特性,也可以基于真核细胞通用的转录激活结构域来构建具有转录激活功能的转录响应元件。为此,选用已在Y.lipolytica中验证激活功能的VPRH复合激活结构域作为转录激活组件[28],构建复合型CarH-VPRH 转录因子。利用组成型表达(hp4d 启动子)CarH-VPRH 因子的模块和报告基因输出模块,设计构建绿光响应传感器质粒[图1(a)]。在绿光照射条件下,AdoB12的Co-C 键被破坏,CarH-VPRH 四聚体解离,因此无法再结合诱导型启动子2CarO-TEF,进而使绿光响应系统处于“Off”状态[图1(b)];当传感菌株处在黑暗条件下,CarH-VPRH 四聚体会靶向结合到2CarO-TEF启动子,进而借助VPRH的转录激活功能强化下游基因的表达,使绿光响应系统处于活跃的“On”状态[图1(c)]。
hp4d启动子属于人工合成的复合型启动子[37],含有Leu核心启动子序列以及来源于XPR2启动子的UAS 序列[38],能够有效地驱动下游 CarH-VPRH 的表达,进而为胞内诱导型启动子控制基因的激活表达提供足够的CarH-VPRH因子。驱动报告基因表达的诱导型启动子由TEF启动子序列中的TATA box上游的CarO 位点和核心启动子Ptef 组成。在TATA box上游插入CarO位点的设计避免了对TATA box等核心元件区域的破坏,减小外源插入序列对启动子活性的影响。基于上述元件构建的绿光响应质粒转入Y.lipolyticaPo1f菌株后,分别测试菌株在绿光照射与黑暗条件下的红色荧光信号,考察传感菌株对于绿光诱导的敏感性。结果如[图2(a)]所示,在绿光照射的条件下,菌株在608 nm处没有对应的特异荧光发射谱;而在无光条件下存在明显的荧光发射谱。结果表明复合因子CarH-VPRH在无光条件下能够靶向结合到诱导型启动子上并发挥转录激活作用[图1(c)],且荧光信号输出强度显著高于绿光(P<0.01)[图2(b)],差异高达43倍。此结果表明本研究构建的绿光响应传感器具有良好的绿光响应性能。
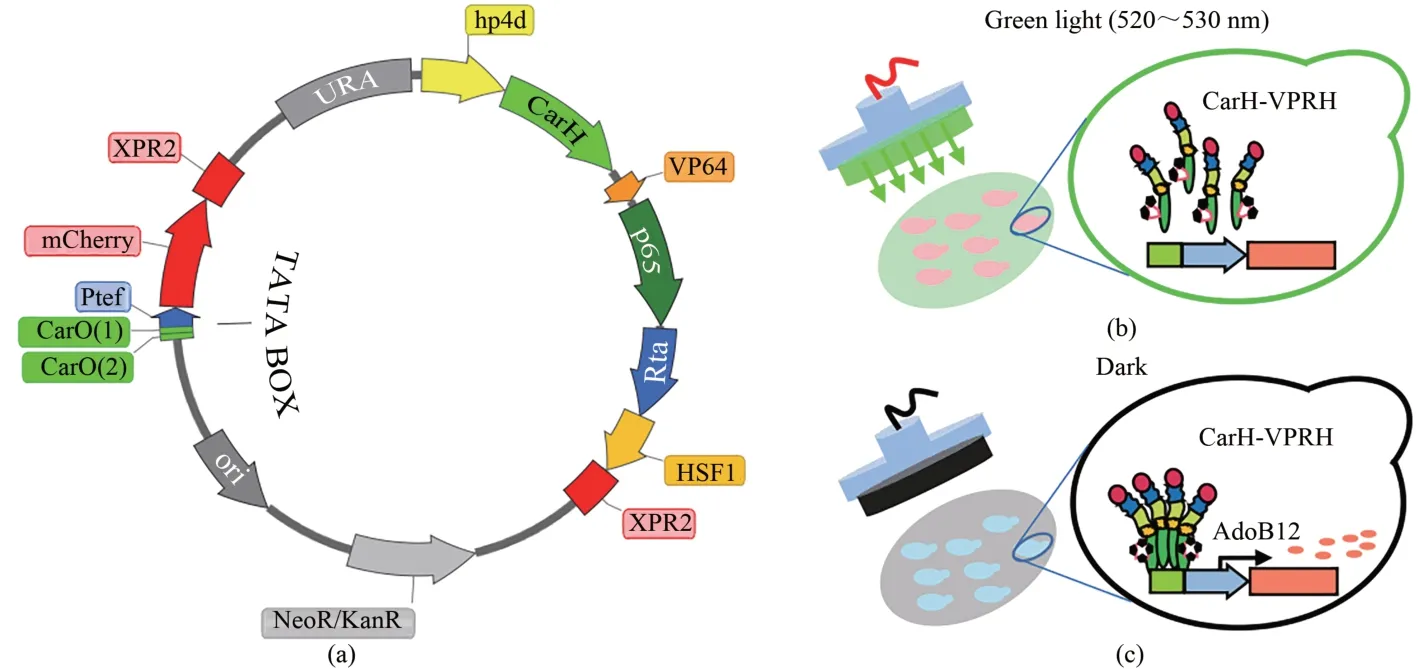
图1 绿光响应传感器的设计Fig.1 Design of the green light response sensor
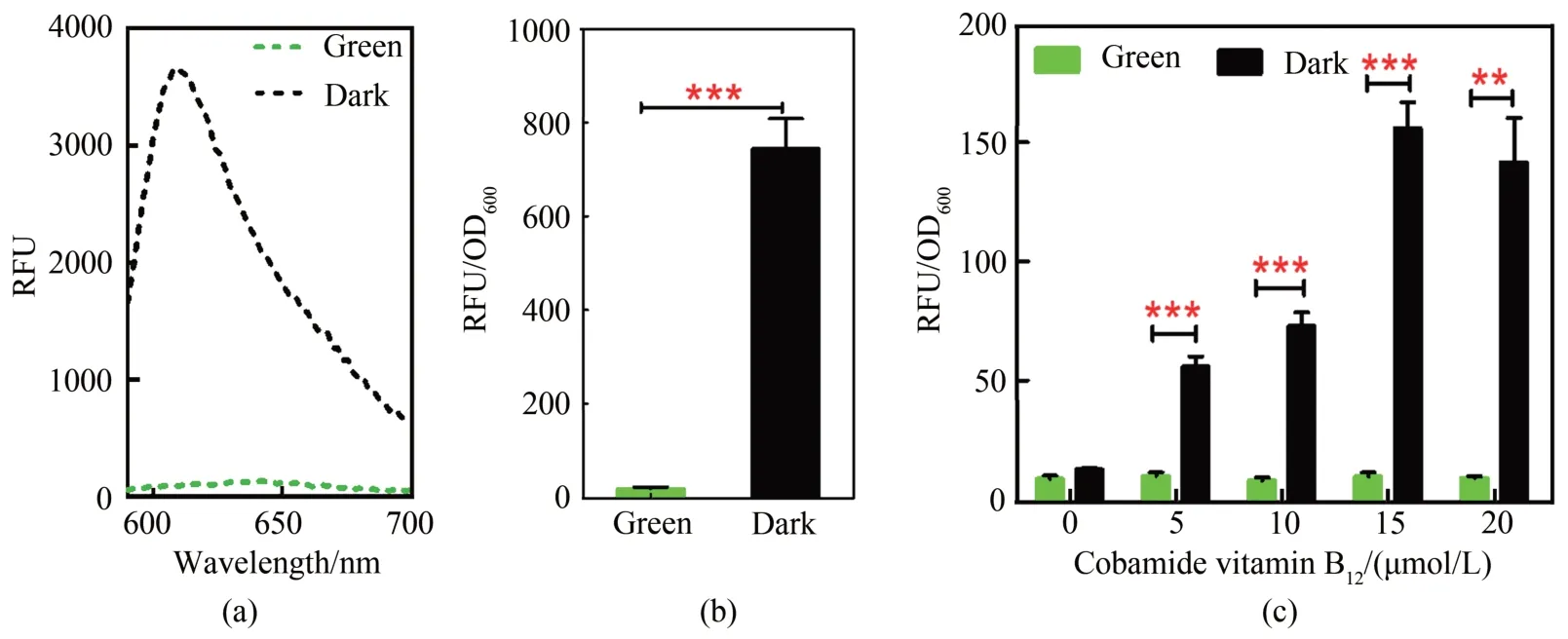
图2 绿光响应传感器的性能表征Fig.2 Performance of the green light response sensor
鉴于本研究选用的绿光感应蛋白CarH 的DNA结合能力受到腺苷钴胺素(cobamide vitamin B12)浓度的影响,进一步考察了腺苷钴胺素浓度与荧光信号输出强度之间的关系。如[图2(c)]所示,Y1-CVH菌株发酵培养48 h后,当腺苷钴胺素的浓度在5~20 μmol/L时,绿光照射和黑暗实验组间的信号输出具有显著的差异。当浓度为15 μmol/L 时,输出信号达到最大值。基于腺苷钴胺素浓度的影响和光控效应,本研究构建的光控系统具有开发为响应二元因素的逻辑门传感器的潜力,即可以通过同时控制腺苷钴胺素的浓度和光照条件来实现不同的调控效果。同时,鉴于腺苷钴胺素的成本问题以及腺苷钴胺素添加对于产物后续纯化等步骤的影响,基于CarH因子的传感系统,将来有必要通过CarH蛋白结构的定向进化改善CarH 与腺苷钴胺素的亲和力、最低饱和浓度等参数,以减少腺苷钴胺素的添加浓度,对推广CarH系统的应用具有重要意义。
2.1.2 绿光响应传感器对光照条件的动态响应
为考察绿光响应传感器对光照条件变化动态响应的灵敏度,在菌株Y1-CVH表达荧光蛋白的阶段(24~120 h),每隔12 h对光照条件进行了切换,同时考虑到光照对腺苷钴胺素的降解作用,在将光照条件由绿光照射切换为黑暗时,再补加15 μmol/L腺苷钴胺素以确保黑暗条件下CarH-VPRH 的激活作用。通过菌体生长量和荧光蛋白表达量的测定,得到绿光响应传感器的动态响应曲线(图3)。结果如图3(a)所示,光照条件动态切换组与始终绿光照射组和始终黑暗组的菌株生长量随时间变化趋势基本一致。红色荧光蛋白动态响应光照条件变化的信号输出如图3(b)所示,对数期(0~24 h)的荧光蛋白表达量均较低,可能是由于处于生长前期的细胞胞内还没有足量的CarH-VPRH 表达积累,从而使依赖于VPRH 转录激活性能的荧光蛋白表达强度较低。始终黑暗组的荧光蛋白表达量在24~60 h内迅速增加,并在生长后期60~120 h 内呈现持续快速增长的趋势,表明此阶段胞内积累的CarH-VPRH已足够激活荧光蛋白的高表达,在120 h 时,单位细胞荧光强度可达到4809.40。始终绿光照射组的荧光蛋白表达量则一直维持在较低水平,荧光信号强度在0~35 之间。光照条件动态切换组在24 h 由绿光照射改为黑暗时,荧光蛋白表达量迅速增加,和始终黑暗组具有相同的速率,36 h再次切换为绿光照射时,荧光蛋白表达量基本保持不变,且在之后的6次光照条件切换中均保持同样快速且灵敏的响应,即黑暗条件下荧光蛋白持续稳定地表达,绿光照射则能及时抑制荧光蛋白的表达,体现了绿光响应传感器对光照条件变化动态响应的高度灵敏性。该系统对绿光的快速响应在时空上精确控制基因表达水平具有一定的发展潜力。

图3 绿光响应传感器对光照条件的动态响应Fig.3 Dynamic response of the green light response sensor to light conditions
2.1.3 绿光响应传感菌株的细胞成像
为更加直观地分析绿光照射和黑暗条件对工程菌株的激活表达差异性,本实验采用尼康激光共聚焦显微镜对菌体进行显微成像(图4)。根据2.2 的实验结果,收集经过72 h 分别在光照和黑暗条件培养的工程菌株Y1-CVH,使胞内的mcherry基因高效表达。如图4所示,黑暗组对应的菌株可明显检测到胞内mCherry的信号,而绿光照射组几乎没有显示出荧光,绿光响应系统具有应用于Y.lipolytica菌株目标基因调控表达的能力。

图4 绿光调控细胞成像Fig.4 Cell imagines regulated by green light irradiation
2.2 绿光响应传感器在对香豆酸及柚皮素合成中的应用
2.2.1 绿光响应传感器在对香豆酸合成中的应用
对香豆酸合成的其中一种方式是通过酪氨酸的解氨作用脱去氨基形成对香豆酸,酪氨酸解氨酶(TAL)是催化酪氨酸转化为对香豆酸的关键限速酶。本研究利用绿光诱导型传感器调控tal基因表达[图5(a)],构建获得一株对光诱导有显著响应的工程菌Yl-CA。通过HPLC 对发酵产物进行分析后发现[图5(b)],绿光照射可明显影响工程菌Yl-CA 的对香豆酸产量,在与对香豆酸标准品出峰时间一致的13.7 min处,光照条件下产物峰面积明显小于黑暗组。之后设置了3组不同的光照条件,考察了对香豆酸在96 h 发酵周期中的产量变化。从不同发酵时间点的产量对比可知,随着菌株培养时间的增加,对香豆酸产量增加,且Yl-CA 在3组不同光照条件下的对香豆酸产量具有明显差异性。如图5(c)所示,第1组始终保持黑暗条件的菌株在96 h对香豆酸产量为99.1 mg/L;第2组始终绿光照射的菌株在96 h 产量仅为49.6 mg/L;第3 组0~48 h 黑暗,48 h 后保持绿光照射的菌株在96 h 对香豆酸产量为82.0 mg/L。黑暗条件与始终绿光诱导相比,对香豆酸产量有2倍的增加;当48 h时将光照条件由黑暗转变绿光照射时,对香豆酸的合成速率减缓,其终产量仅达到始终黑暗条件下的82.7%,表明后期绿光照射对对香豆酸合成能达到一定的抑制效果。此策略可应用于与目标产物竞争相同前体的细胞内必需营养物质的合成调控中,以达到平衡细胞生长和产物合成的目的。由于本研究中菌株的莽草酸途径等前体合成通路未经过全面系统改造,所以对香豆酸产量较低,但光诱导菌株产对香豆酸仍具有较大的提升空间。
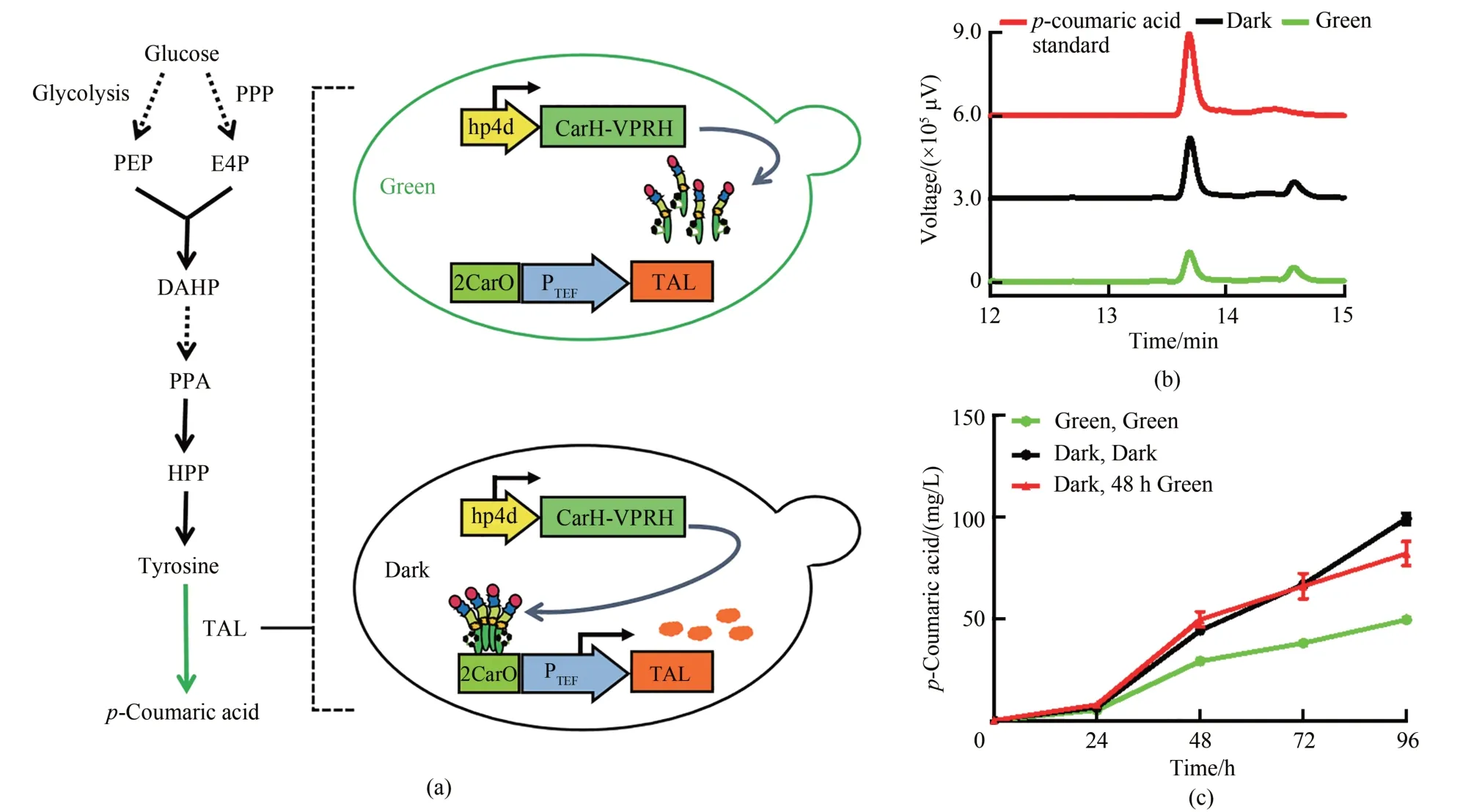
图5 绿光调控对香豆酸合成Fig.5 p-Coumaric acid synthesis regulated by green light irradiation
2.2.2 绿光响应传感器在柚皮素合成中的应用
在前期对香豆酸合成可显著响应光照的基础上,继续探究光控对其衍生产物——柚皮素合成效果的影响[图6(a)]。工程菌株Yl-NA 分别在光照和黑暗条件下,发酵96 h 后收集发酵液样本进行产物测定,可测得中间产物对香豆酸和终产物柚皮素的特异的色谱峰[图6(b)]。之后设置四组不同光照条件,考察不同条件对细胞生长量、对香豆酸和柚皮素产量的影响[图6(c)~(e)]。结果显示,发酵菌株Yl-NA 的生物量在光照组和黑暗组之间具有一定的差异[图6(c)]。在产物合成方面,始终保持黑暗条件的菌株合成对香豆酸和柚皮素的能力强于始终绿光照射组[图6(d)、(e)],在96 h 时两者的产量分别达到4.7 倍和2.6 倍的差异,其中终产物柚皮素在黑暗组条件下的产量最高可达到117.1 mg/L。为了进一步考察不同光照时间的动态变化,设置前期分别绿光照射24 h 和48 h,之后在黑暗条件下继续发酵的两个实验组。结果显示,与始终光照处理的实验组相比,阶段性切换光照条件的实验组中对香豆酸和柚皮素的合成产量明显增加;特别在24 h 将绿光照射转变为黑暗这一组,Yl-NA合成对香豆酸和柚皮素的能力明显增强,且其对香豆酸合成能力略高于始终黑暗组,在96 h 时对香豆酸产量可达161.4 mg/L,比始终黑暗组高出1.2 倍,说明该光控系统具有较好且灵敏的切换响应。在柚皮素合成途径中,对香豆酸浓度是柚皮素合成效率的第一个限速步骤,黑暗组和先光照24 h 再黑暗组中,对香豆酸产量明显高于其他两组[图6(d)],相对应柚皮素的产量也较高[图6(e)],但由于CHS活性高低是限制柚皮素合成的第二个限速步骤[图6(a)][39],所以对香豆酸高产的两组在柚皮素产量上并没有显著区别,后续可将高活性的CHS 进行光控元件构建,达到解除两个限速步骤的目的,使柚皮素的产量在光控条件下进一步提升。此外,菌株Yl-NA 在绿光照射下的生长量略高于黑暗组,且在绿光照射24 h 后切换至黑暗条件的处理组中,对香豆酸产量高于其他组,可能是前期短时间照射可以让细胞更好地生长,从而有利于后期产物的合成。这种结合培养条件或者生理代谢特征的可控表达策略,有利于提升工程菌株的合成性能。Lü 等[40]利用脂肪酸诱导型和柚皮素诱导型系统协调菌株生长、脂肪酸基础代谢与产物合成途径共用malonyl-CoA 前体带来的供需矛盾,促进malonyl-CoA 衍生产物柚皮素的有效合成;Zhou等[41]在大肠杆菌(Escherichia coli)中利用对香豆酸传感器和柚皮素传感器协调产物合成与细胞生长的关系,最终将柚皮素产量提高到原始菌株的8.7 倍。后期研究中如果将环境因子(如光照)响应系统和上述的中间产物及终产物传感器综合使用,可进一步提升工程菌株的合成潜力。综合分析诱导型工具的应用效果以及本研究的实验结果可知,光诱导合成通路的设计,在多步酶催化的天然产物合成方面具有较好的效果,并且在平衡细胞的生长和产物的合成方面具有一定的潜力。同时,因为柚皮素合成基因(4cl,chs及chi)表达强度等参数未系统性优化,导致部分对香豆酸积累及其下游产物转化效率较低;为此在后续研究中一方面需探索光控表达模式在前体高效转化利用方面的应用策略,另一方面需系统优化底盘细胞的合成途径,以实现柚皮素等天然产物在Y. lipolytica底盘细胞中的高效生产。

图6 绿光调控柚皮素合成Fig.6 Naringenin synthesis regulated by green light irradiation
3 结论
随着合成生物学的迅猛发展,如何构建多样化的生物传感器来调控和检测细胞内的代谢产物,定向改造代谢途径提高产量及品质越来越受到关注。在近几十年中,多种化学诱导系统已在酵母细胞的基因表达调控中发挥作用,并得到较好的效果,但由于化学诱导剂在培养过程中扩散、无法去除且成本较高等缺陷,不能满足大规模工业化生产的需求。而光与化学物质相比,是一种理想的基因诱导剂,可以在特定的时间和空间进行精确调控,并已得到了一定的开发和应用[42-43]。本研究所使用的一种响应绿光诱导抑制下游基因转录表达的光控元件CarH-VPRH,可以在真核细胞——解脂耶氏酵母中发挥功能,并且在还未充分优化的条件下,黑暗和光照组的荧光信号在120 h时相差143 倍[图3(b)]。通过每12 h 切换光照和黑暗处理,荧光信号可即时响应光照且抑制和激活荧光蛋白的表达,实现了动态精确调控的目标[图3(b)]。
本研究中还发现,光控系统与细胞生长量存在一定的相关性。在柚皮素和对香豆酸合成过程中,生长量有较为明显的差异[图6(c)],说明代谢产物的积累会对细胞生长产生抑制作用,为了解除抑制效应,可在产物生产到一定阶段,加入光照进行干预调控,停止产物转化和积累,从而转向细胞初级代谢,达到积累细胞生长量的目的。Binder 等[44]在谷氨酸棒状杆菌中利用光控生产朱栾倍半萜,获得高产,由于朱栾倍半萜对菌体生长有严重影响,通过光控在生长期抑制朱栾倍半萜的合成,当菌体达到一定密度后,用光诱导半萜合酶基因表达,从而在不影响菌体生长情况下,获得高产量的朱栾倍半萜。同样,在我们生物合成某些生物质产品过程中,通过精确调控光照时间和强度,可以寻找到代谢产物积累与细胞生长之间的动态平衡,开发动态光照及无光的发酵调控策略,达到细胞生长和产物产量的最大化。
综上,本研究首次设计应用于Y. lipolytica的光控诱导表达系统,该系统能够显著地响应绿光,有效调控靶标基因的转录。在天然产物合成中,实现了动态实时调控细胞响应绿光进行对香豆酸及柚皮素产物合成的目标,虽然目前摇瓶发酵水平与其他研究中的产量具有一定差距,但后续可以从光照强度、时间及代谢合成的区室化策略等方面进一步优化以提升目标产物的产量。绿光诱导传感器又一次重现了Y. lipolytica中原核转录因子与通用型激活结构域协同设计并开发外源转录因子衍生传感器的方法的有效性[27]。后续对于传感器的信号输出规律、信号强度提升策略等还有待进一步研究,促进光诱导传感器在Y. lipolytica的应用。本研究初步建立了在Y. lipolytica中绿光调控抑制某一特定基因的转录的体系,后续可将这一策略推广应用于抑制与目标产物合成竞争性途径的调控,实现产物的规模化生产。
致谢:本研究得到国家重点研发计划“合成生物学”重点专项(2018YFA0900404;2020YFA0908800)和国家自然科学基金(31730004)的支持。
——一道江苏高考题的奥秘解读和拓展

