MiR-378a-5p促进肝癌细胞增殖和侵袭及其在早期肝癌诊断中的作用
何勇勇,方长英,张青松
(1.宣城职业技术学院内科教研室,安徽宣城 242000;2.宣城市中心医院检验科)
肝细胞癌(肝癌)是发病率全球第六和中国第四的恶性肿瘤[1-2],全球55.4 %的新发病例和53.9 %的死亡病例出现在中国,严重威胁我国居民健康[3]。目前肝切除术是肝癌患者首选的治疗方法[4],但由于肝癌恶性程度高,我国肝癌患者5年生存率仅为12.1 %[5]。因此,需要寻找检测方便的分子标志物用于肝癌早期的筛查,以便早发现早治疗提高患者预后效果。
MicroRNA(miRNA)是小的非编码RNA(长度为19~25 nt),源于70~80 nt的miRNA前体转录物,可通过与靶标mRNA的3’非翻译区(UTR)碱基配对相互作用使其降解或抑制其翻译[6-8]。众多研究显示miRNA在各种生理和病理过程中发挥关键作用,如新陈代谢、增殖分化、细胞凋亡、血管生成和人类致癌作用等[9],这些研究结果提示miRNA可作为恶性肿瘤患者诊疗和预后判断的候选分子标志物。miR-378a-5p是miR-378a的两条成熟链之一,以前称为miR-378。前期的研究结果显示miR-378a-5p可以提高细胞存活率,可促进黑色素瘤和非小细胞肺癌的生长和血管生成[10-11];miR-378a-5p过表达会干扰有丝分裂的保真度,与乳腺癌的肿瘤发生有关[12]。本研究旨在检测miR-378a-5p在早期肝癌患者和健康人群血清中的表达差异,分析其对肝癌早期筛查的诊断价值,并应用CCK-8和Transwell实验观察miR-378a-5p对肝癌细胞增殖和侵袭的影响。
1 对象与方法
1.1对象 选择2017年12月至2020年7月在本院肝胆外科就诊的64例肝癌患者作为研究对象(观察组),其中男性54例,女性10例;年龄30~70岁,平均(48.95±9.629)岁。观察组患者纳入标准:(1)本人同意参加实验;(2)病理确诊为肝细胞癌,TNM分期为Ⅰa和Ⅰb期[1];(3)确诊前未做治疗;(4)无其他肝病(肝炎和肝硬化等)、恶性肿瘤、慢性病等。选取同期体检的健康志愿者64人为对照组,其中男性54人,女性10人;年龄24~67岁,平均(48.69±8.884)岁。观察组肝癌患者和对照组志愿者临床资料完整,差异无统计学意义(P>0.05),研究结果具有可比性。采集空腹静脉血15 mL,观察组患者术前2 d采集,对照组志愿者体检时采集。样本采集后3 000 r/min离心5 min取上清液至无酶EP管中,随即将RNA逆转录合成cDNA以备后用。本研究获得医院伦理委员会批准,观察组和对照组参与者均签署知情同意书。
1.2实验方法
1.2.1血清MicroRNA提取和cDNA合成 取500 μL血清和600 μL Serum/Plasma miRNAReagent(北京百奥莱博)加入至无酶EP离心管中,充分混匀后15 000 r/min离心5 min,将上清移至新的无酶EP离心管,加入1 mL异丙醇震荡混均,随后将液体分批倒入吸附柱中,12 000 r/min离心30 s后弃去柱液,再用异丙醇和无水乙醇对吸附柱中的miRNA进行洗涤,最后将吸附柱放入新的无酶EP管中,室温静置5 min待乙醇挥发完毕后,加入30 μL无酶ddH2O溶解miRNA,静置后15 000 r/min离心3 min,洗脱后所得miRNA液体采用分光光度计测量RNA纯度和浓度;按照TaqMan microRNA cDNA Synthesis Kit(北京百奥莱博)说明书进行反转录。取10 μL合格的miRNA液体加入2.5 μL 5×TaqMan miRNA RT Solution A,反应条件为37 ℃ 30 min、85 ℃ 5 min,随后再加入2.5 μL 10×PS TaqMan miRNA RT Primer、2.5 μL 10×TaqMan miRNA RT Solution B、7.5 μL无酶ddH2O,反应条件为30 ℃ 5 min、55 ℃ 60 min、95 ℃ 5 min。合成的cDNA冰箱保存待用。
1.2.2Real-time PCR检测血清中miR-378a-5p表达量 按照TaqMan microRNA qPCR Kit(北京百奥莱博)说明书对血清中miR-378a-5p进行扩增。配制20 μL扩增反应体系:2 μL cDNA模板、4 μL 5×TaqMan qPCR Mix、0.4 μL 50×ROX Reference Dye、1 μL 20×miRNA TaqMan Assay、12.6 μL ddH2O,采用两步法扩增:95 ℃ 15 min;随后95 ℃ 10 s、60 ℃ 60 s,40个循环,实验重复三次。采用2-△△Ct方法计算血液中miR-378a-5p表达量。引物由上海吉玛科技公司设计并合成,引物序列如下:(1)miR-378a-5p:5′-CTCCTGACTCCAGGTCCTGT-3′;(2)内参GAPDH:forward 5′-ATGTGCCGGACCTTGGAAG-3′, reverse 5′-CCTCGGGTTAGCTGAGAGATCA-3′。
1.2.3细胞增殖实验 Huh-7细胞购自海军医科大学临床实验中心,采用10 %胎牛血清的DMEM培养液进行培养。分别用过表达质粒pcDNA- miR-378a-5p(观察组)和空白质粒pcDNA-NC(对照组)转染生长状态良好的Huh-7细胞,48 h后real-time PCR检测转染效果,随后制备单细胞悬液,应用流式细胞仪计数,以1×104细胞/孔种植在96孔板,分别于1 d、2 d、3 d、4 d、5 d后取出96孔板加入CCK-8使用酶标仪测定OD值,实验重复3次。
1.2.4侵袭实验 实验开始前在Transwell小室上室中加入matrigel胶,凝固后待用。收集转染pcDNA- miR-378a-5p和pcDNA-NC的Huh-7细胞,PBS洗涤后流式细胞仪计数,浓度调整至1×105/mL,取200 μL细胞液加入至Transwell小室上室中,下室加入600 μL含10 %胎牛血清DMEM培养液,恒温下培养,分别于12 h、24 h、36 h、48 h后取出Transwell小室,PBS洗涤后擦去未穿过膜的Huh-7细胞,甲醛固定后染色,显微镜观察穿膜细胞数。

2 结果
2.1血清miR-378a-5p表达及其与AFP对早期肝癌诊断价值分析 miR-378a-5p在早期肝癌患者血清中的相对表达量为(2.263±0.964),显著高于其在健康志愿者血清中的表达量(0.936±0.645),差异具有统计学意义(t=9.155,P<0.001);ROC分析结果显示采用血清miR-378a-5p表达量预测早期肝癌时,其曲线下面积为0.868(95 % CI: 0.806-0.931,P<0.001),当cut-off值为1.685,其敏感性和特异性为71.9 %和91.6 %,见图1。血清AFP预测早期肝癌的ROC曲线下面积为0.851(95 % CI: 0.776-0.925,P<0.001),当cut-off值为17.35,其敏感性和特异性为75 %和100 %,见图2。
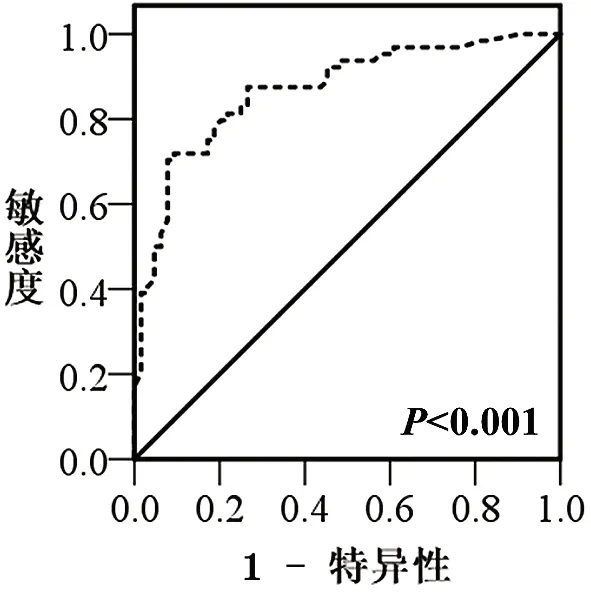
图1 血清miR-378a-5p表达对早期肝癌诊断的ROC分析

图2 血清AFP表达对早期肝癌诊断的ROC分析
2.2血清miR-378a-5p和AFP联合检测对早期肝癌诊断价值分析 采用SPSS二元logitic回归分析血清miR-378a-5p和AFP联合检测,结果见表1,可得logitic回归方程(logitic=-4.521+0.087×AFP+1.687×miR),从而在SPSS中生成联合因子具体数值(联合因子=AFP+19.39×miR)。ROC分析结果表明血清miR-378a-5p联合AFP检测对早期肝癌预测的曲线下面积为0.950(95 % CI: 0.914-0.986,P<0.001),当cut-off值为61.52,其敏感性和特异性为81.3 %和100 %,见图3。两者联合检测筛选早期肝癌的效能优于血清miR-378a-5p(Z=2.233,P=0.026)和AFP(Z=2.354,P=0.019)独立检测。

表1 血清miR-378a-5p和AFP联合检测二元logitic回归分析
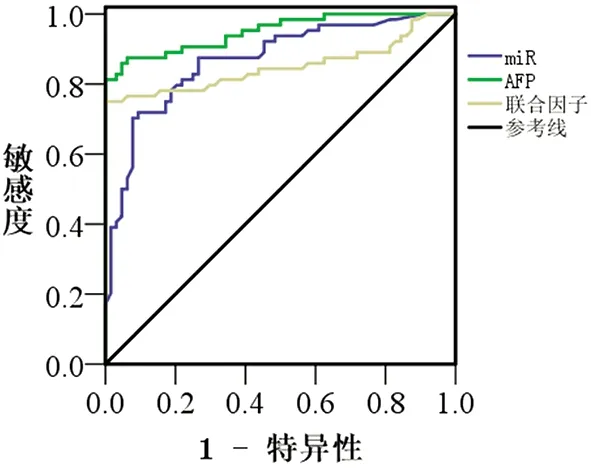
图3 miR-378a-5p和AFP联合检测筛选早期肝癌的ROC分析
2.3血清miR-378a-5p表达与肝癌临床病理参数间的关系 T检验分析早期肝癌血清miR-378a-5p表达与病理参数间的关系,结果显示其表达量与患者性别、年龄、AFP值高低、是否饮酒、有无乙肝病毒感染、有无肝硬化及肿瘤数目无相关性,与肿瘤大小(t=2.417,P=0.019)、肝癌细胞分级(t=4.860,P<0.001)和TNM分期(t=2.696,P=0.009)相关,见表2。

表2 血清miR-378a-5p表达与早期肝癌病理参数的相关性(n=64)
2.4miR-378a-5p过表达后Huh-7细胞增殖和侵袭增强 质粒pcDNA- miR-378a-5p可有效促进Huh-7细胞miR-378a-5p过表达[1 vs (2.191±0.070),t=17.04,P<0.001];CCK-8实验结果显示miR-378a-5p过表达后Huh-7细胞3 d后细胞增殖数目与对照组相比开始增多(t=5.331,P=0.002),4 d后生长速度显著增快(t=7.988,P<0.001),见表3;Transwell实验表明质粒促进miR-378a-5p表达后,Huh-7细胞24 h后穿膜细胞数增多(t=2.553,P=0.043),48 h后细胞侵袭能力显著增强(t=7.643,P<0.001),见表4。

表3 转染组和对照组细胞增殖情况比较

表4 转染组和对照组穿膜细胞数比较
3 讨论
肝细胞癌是一种病因和机制复杂的疾病,很难通过单一分子标志物进行诊断,即使血清AFP作为原发性肝癌唯一可接受的肿瘤标志物也不能单独用于诊断,因为早期肝癌患者AFP假阴性结果高达40 %[13],血清AFP需要和影像学阳性结果结合使用。microRNA的发现为研究新型分子生物标记物用于癌症诊断开辟了新视野。本研究的目的是检测早期肝癌患者血清中循环miR-378a-5p的相对表达量,并评估其在早期肝癌诊断中的价值。
本研究发现,与健康对照组相比,早期肝癌患者血清miR-378a-5p相对表达量显著上调(P<0.001),且肿瘤较大(>5cm)、肝癌细胞分级较差(Ⅲ级和Ⅳ级)、TNM分期Ⅰb期的早期肝癌患者血清miR-378a-5p表达水平显著升高(P均<0.05),说明miR-378a-5p可能与肝癌进展有关。为证实这一观点,本研究利用pcDNA- miR-378a-5p质粒促进Huh-7细胞miR-378a-5p过表达,实验结果显示miR-378a-5p过表达后Huh-7细胞增值和侵袭能力与对照组相比均出现增强,这些研究结果与Lee等人[14]的观点一致。Lee等研究发现甲状腺肿瘤组织中miR-378a-5p相对表达量显著高于正常组织。为深入了解miR-378a-5p特性,该研究通过miR-378a-5p转染实验发现miR-378a-5p可通过与靶标RNA结合抑制融合抑制因子(Sufu)表达,Sufu具有抑癌作用,其功能丧失会导致肿瘤细胞过度增殖。为进一步了解miR-378a-5p在肿瘤生长中的作用,将转染了miR-378a-5p质粒或空白质粒的U87细胞保持在无血清条件下的培养皿中,结果显示转染了miR-378a-5p质粒的U87细胞存活率增加而凋亡减少,随后两组细胞均被注射在裸鼠皮下,4周后注射转染了miR-378a-5p质粒细胞的小鼠皮下肿瘤直径显著大于注射转染了空白质粒细胞的小鼠,随后将裸鼠皮下肿瘤切除并使用抗CD34抗体进行免疫组化染色,由miR-378a-5p质粒转染细胞形成肿瘤的血管密度高于由空白质粒转染细胞形成肿瘤血管密度,其机制为miR-378a-5p可与miR-125a竞争性结合VEGF的3'UTR区域并促进VEGF表达。另一项研究[10]也发现miR-378a-5p过表达增强了黑色素瘤细胞体外侵袭和迁移能力,并促进黑色素瘤形成新生血管结构的能力,转移性黑色素瘤患者肿瘤标本中miR-378a-5p表达显著上升,高表达miR-378a-5p的黑色素瘤患者药物治疗反应降低。上述研究均证实了miR-378a-5p在肿瘤的发生发展中起着重要的作用,可以促使肿瘤细胞生长而抑制其凋亡,同时还可以促进肿瘤血管生成,这些结果说明miR-378a-5p具有癌基因特征。
本研究最后利用ROC分析血清miR-378a-5p表达对早期肝癌的诊断价值,其结果显示miR-378a-5p预测早期肝癌时,其曲线下面积为0.868,当cut-off值为1.685,其敏感性和特异性为71.9 %和91.6 %;AFP预测早期肝癌的ROC曲线下面积为0.851,当cut-off值为17.35,其敏感性和特异性为75 %和100 %;而miR-378a-5p联合AFP检测对早期肝癌预测的曲线下面积为0.950,当cut-off值为61.52,其敏感性和特异性为81.3 %和100 %,Z检验结果显示两者联合检测诊断早期肝癌的效能优于血清miR-378a-5p和AFP独立检测(P均<0.05)。由此可见miR-378a-5p和AFP联合筛查早期肝癌可取得较好的效果,加之血液样本较肝癌组织容易获得及血清miR-378a-5p和AFP检测简单,miR-378a-5p和AFP联合筛查早期肝癌有可能应用于临床。
——一道江苏高考题的奥秘解读和拓展

