根皮素纳米混悬剂的制备及其体内药动学研究
张伟利, 决利利, 李晓婷
(郑州工业应用技术学院,河南 郑州 451150)
根皮素作为黄酮多酚类化合物,主要存在于苹果、梨等水果的根茎中,具有抗糖尿病、抗氧化、抗菌、保护神经系统、抗前列腺癌等多种药理作用[1-2],但该成分在25 ℃水中的溶解度仅为33.64 μg/mL,溶出速率、溶出度均较低,可能会导致其口服吸收困难[3],从而影响药效发挥。因此,提高根皮素的溶解度及溶出度、改善口服吸收生物利用度是首要解决的问题,目前该成分剂型主要有包合物[4]、磷脂复合物[5]、固体分散体[3]等。
纳米混悬剂具有载药量大、工艺简单等优势,可显著提高溶解度及口服吸收生物利用度,该技术是将药物与稳定剂(如PVP K30、SDS、泊洛沙姆188等)通过某种制剂手段(高压均质、超声等)所得到的胶态分散体系[6-9],工业化应用程度相对较高。本实验首先通过单因素试验考察稳定剂种类、用量、超声功率等对根皮素纳米混悬剂粒径、PDI的影响,确定制备工艺,再测定其粒径、Zeta电位、载药量、溶解度、溶出度等情况,最后考察其在大鼠体内的药动学,以期为该剂型进一步开发应用提供参考。
1 材料
Agilent 1260型高效液相色谱仪(配置DAD检测器和自动进样器,美国Agilent公司);MSE 125P-CE型电子天平(配置防风罩,德国Sartorius公司);C-MAG-HS7型恒温加热磁力搅拌器(德国IKA公司);ATS型均质机(美国Seeker公司);BDF-86H50型超低温冰箱(山东博科生物产业有限公司);Nano-S90型粒度分析仪(马尔文帕纳科公司);TYH-2型氮气吹扫仪(广西大学附属科学仪器有限公司)。
根皮素原料药(批号191005-2,纯度98.0%,成都嘉叶生物科技有限公司);根皮素对照品(批号P7912,纯度99.9%,美国Sigma公司);聚乙烯吡咯烷酮K30(PVP K30,批号240379,美国Ashland公司);十二烷基磺酸钠(SDS,批号171114,国药集团化学试剂有限公司);泊洛沙姆188(批号171225,山河药用辅料有限公司)。
SD大鼠,雌雄兼用,体质量(300±20)g,购自河南省动物实验中心,动物生产许可证号SCXK(豫)2016-0001,饲养温度、相对湿度分别为25 ℃、55%。
2 方法与结果
2.1 HPLC法测定根皮素含量
2.1.1 色谱条件 Waters C18色谱柱(150 mm×4.6 mm,5 μm);流动相乙腈-水(35∶65);体积流量1.0 mL/min;柱温35 ℃;检测波长286 nm;进样量20 μL。
2.1.2 线性关系考察 称根皮素对照品20.0 mg,置于100 mL量瓶中,加入约80 mL乙腈超声提取3 min溶解,乙腈定容至0.2 mg/mL,作为贮备液,再配制500 mL 乙腈-水(35∶65)混合液,作为稀释液。精密量取10 mL贮备液,置于100 mL量瓶中,稀释液定容,即得20.0 μg/mL对照品溶液,稀释液依次稀释至10.0、5.0、1.0、0.5、0.05 μg/mL,在“2.1.1”项色谱条件下进样测定。以峰面积(Y)对根皮素质量浓度(X)进行回归,得方程为Y=12.941 8X+44.066 1(r=0.999 9),在0.05~20.0 μg/mL范围内线性关系良好。
2.1.3 方法学考察 取根皮素纳米混悬剂1.0 mL至10 mL量瓶中,加入约7 mL乙腈超声处理3 min后定容,过0.45 μm微孔滤膜,取续滤液0.5 mL至10 mL量瓶中,“2.1.2”项下稀释液定容,即得供试品溶液。取同一份样品,平行制备6份供试品溶液,在“2.1.1”项色谱条件下进样测定,测得根皮素峰面积RSD为1.44%,表明该方法重复性良好。取供试品溶液适量,于0、4、8、12、24、48 h在“2.1.1”项色谱条件下进样测定,测得根皮素峰面积RSD为1.17%,表明溶液在48 h内稳定性良好。取20.0、5.0、0.05 μg/mL对照品溶液,在“2.1.1”项色谱条件下进样测定6次,测得根皮素峰面积RSD分别为0.28%、0.13%、0.21%,表明仪器精密度良好。精密称取根皮素对照品12.0 mg,置于10 mL量瓶中,加入约7 mL乙腈超声处理3 min后定容,即得1.2 mg/mL对照品溶液,再取9份根皮素纳米混悬剂,每份1.0 mL,置于10 mL量瓶中,分为3组,分别加入对照品溶液0.5、1.0、1.5 mL,再加入约7 mL乙腈超声处理3 min后定容,过0.45 μm微孔滤膜,取续滤液0.5 mL至10 mL量瓶中,“2.1.2”项下稀释液定容,在“2.1.1”项色谱条件下进样测定,测得加样回收率分别为100.19%、99.67%、100.37%,RSD分别为0.63%、1.31%、0.94%。
2.2 单因素试验
2.2.1 稳定剂种类 固定稳定剂用量为30 mg,考察不同稳定剂(PVP K30、SDS、泊洛沙姆188)及其组合(PVP K30+SDS、PVP K30+泊洛沙姆188、SDS+泊洛沙姆188,比例均为1∶1)对纳米混悬剂粒径、PDI的影响,结果见表1。由此可知,PVP K30+泊洛沙姆188作为稳定剂时粒径、PDI均较低。

表1 稳定剂种类对粒径、PDI的影响
2.2.2 稳定剂比例 固定稳定剂用量为30 mg,考察PVP K30+泊洛沙姆188不同比例(1∶2、1∶1、2∶1)对纳米混悬剂粒径、PDI的影响,结果见表2。由此可知,PVP K30与泊洛沙姆188比例为1∶1时粒径、PDI均较低。

表2 稳定剂比例对粒径、PDI的影响
2.2.3 稳定剂用量 固定PVP K30与泊洛沙姆188比例为1∶1,考察不同稳定剂用量(20、30、40、50、60 mg)对纳米混悬剂粒径、PDI的影响,结果见表3。由此可知,稳定剂用量过大或过小均会对粒径、PDI产生影响,在40 mg时两者均较低,而超过40 mg时粒径反而上升,可能是过多的稳定剂吸附在纳米粒子表面所致。

表3 稳定剂用量对粒径、PDI的影响
2.2.4 超声功率 固定根皮素用量为60 mg,PVP K30与泊洛沙姆188比例为1∶1,稳定剂用量为40 mg,考察不同超声功率(200、250、300、350、400 W)对纳米混悬剂粒径、PDI的影响,结果见表4。由此可知,超声功率为350 W时粒径、PDI均较低,而进一步增加时粒径反而有所升高,可能是功率过高可提升纳米粒子碰撞几率所致[9]。

表4 超声功率对粒径、PDI的影响
2.2.5 超声时间 固定根皮素用量为60 mg,PVP K30与泊洛沙姆188比例为1∶1,稳定剂用量为40 mg,超声功率为350 W,考察不同超声时间(20、25、30、35 min)对纳米混悬剂粒径、PDI的影响,结果见表5。由此可知,超声时间为30 min时粒径、PDI均较低,而进一步延长时两者反而有所升高。

表5 超声时间对粒径、PDI的影响
2.2.6 制备工艺确定 取60 mg根皮素,置于圆底烧瓶中,加入10 mL无水乙醇得混悬液,磁力搅拌(50 ℃)2.5 h至溶液澄清,作为有机相;称取PVP K30、泊洛沙姆188(比例为1∶1)共40 mg,加入50 mL蒸馏水溶解,作为水相,将有机相滴加至水相中,继续磁力搅拌搅拌2 h,再置于超声仪中超声处理30 min(功率350 W,每工作2 s停止2 s),加入蒸馏水至50 mL,即得。
2.3 纳米混悬剂表征
2.3.1 粒径、Zeta电位 平行制备3批纳米混悬剂,蒸馏水稀释50倍,混匀,取约3 mL至比色皿中,测定粒径、Zeta电位,结果分别见图1~2。由此可知,其平均粒径为167.2 nm,RSD为0.95%;平均PDI为0.138,RSD为0.67%;平均Zeta电位为-36.4 mV,RSD为0.77%,表明处方和工艺重复性良好。

图1 纳米混悬剂粒径分布

图2 纳米混悬剂Zeta电位
2.3.2 载药量 取纳米混悬剂1.0 mL至超滤离心管中,8 000 r/min离心10 min,取外管滤液,在“2.1.1”项色谱条件下进样测定,计算游离根皮素量(M游离);取根皮素纳米混悬剂1.0 mL至10 mL量瓶中,加入约7 mL乙腈超声处理3 min后定容,过0.45 μm微孔滤膜,取续滤液0.5 mL至10 mL量瓶中,“2.1.2”项下稀释液定容,在“2.1.1”项色谱条件下进样测定,测定根皮素总量(M总药);取1.0 mL根皮素纳米混悬剂,冻干(不加冻干保护剂),称定质量(M总),平行3次,计算载药量,公式为载药量=[(M总药-M游离)/M总]×100%,测得其平均值为51.43%,RSD为0.82%。
2.4 冻干粉制备及其溶解度测定 取纳米混悬剂适量,加入4%甘露醇混匀,分成若干份,每份约4 mL,置于-50 ℃冰箱中预冻2 d,再迅速置于-30 ℃真空状态的冷冻干燥机中2 d,于3 h内匀速升温至25 ℃,继续保持3 h后取出,即得,见图3。取适量蒸馏水复溶,测得其平均粒径为193.4 nm,平均PDI为0.166,平均Zeta电位为-27.7 mV,见图4~5。

图3 冻干粉外观

图4 冻干粉复溶后粒径分布

图5 冻干粉复溶后Zeta电位
取过量根皮素、物理混合物(根皮素-辅料,两者比例同纳米混悬剂)、纳米混悬剂冻干粉,置于三角烧瓶中,加入蒸馏水得混悬液,固定于振荡器上,设置温度、转速分别为25 ℃、100 r/min,振荡2 d后取出,12 500 r/min离心15 min,吸取上清液,在“2.1.1”项色谱条件下进样测定。结果显示,根皮素、物理混合物溶解度分别为33.64、68.27 μg/mL,推测后者溶解度升高可能与处方中含有表面活性剂有关;纳米混悬剂冻干粉溶解度达867.35 μg/mL,提高至25.78倍。
2.5 体外释药研究 取根皮素及其纳米混悬剂冻干粉适量(以根皮素计均为8 mg),置于离心管中,加入2 mL蒸馏水得混悬液,剪取透析袋(截留分子量8 000~14 000 Da),去离子水煮沸20 min,常温去离子水洗涤,将混悬液转移至透析袋中,细尼龙绳两端扎紧,每份样品平行制备3份。取蒸馏水适量,超声处理30 min后量取900 mL,作为溶出介质。在温度37 ℃、转速100 r/min条件下,从样品接触溶出介质开始计时,每个取样点取样3 mL后,立即补加3 mL超声后蒸馏水,12 500 r/min离心15 min,吸取上清液,在“2.1.1”项色谱条件下进样测定,结果见图6。由此可知,原料药在240 min内的溶出度仅为36.73%,而其纳米混悬剂冻干粉末在45 min内基本完全溶出。
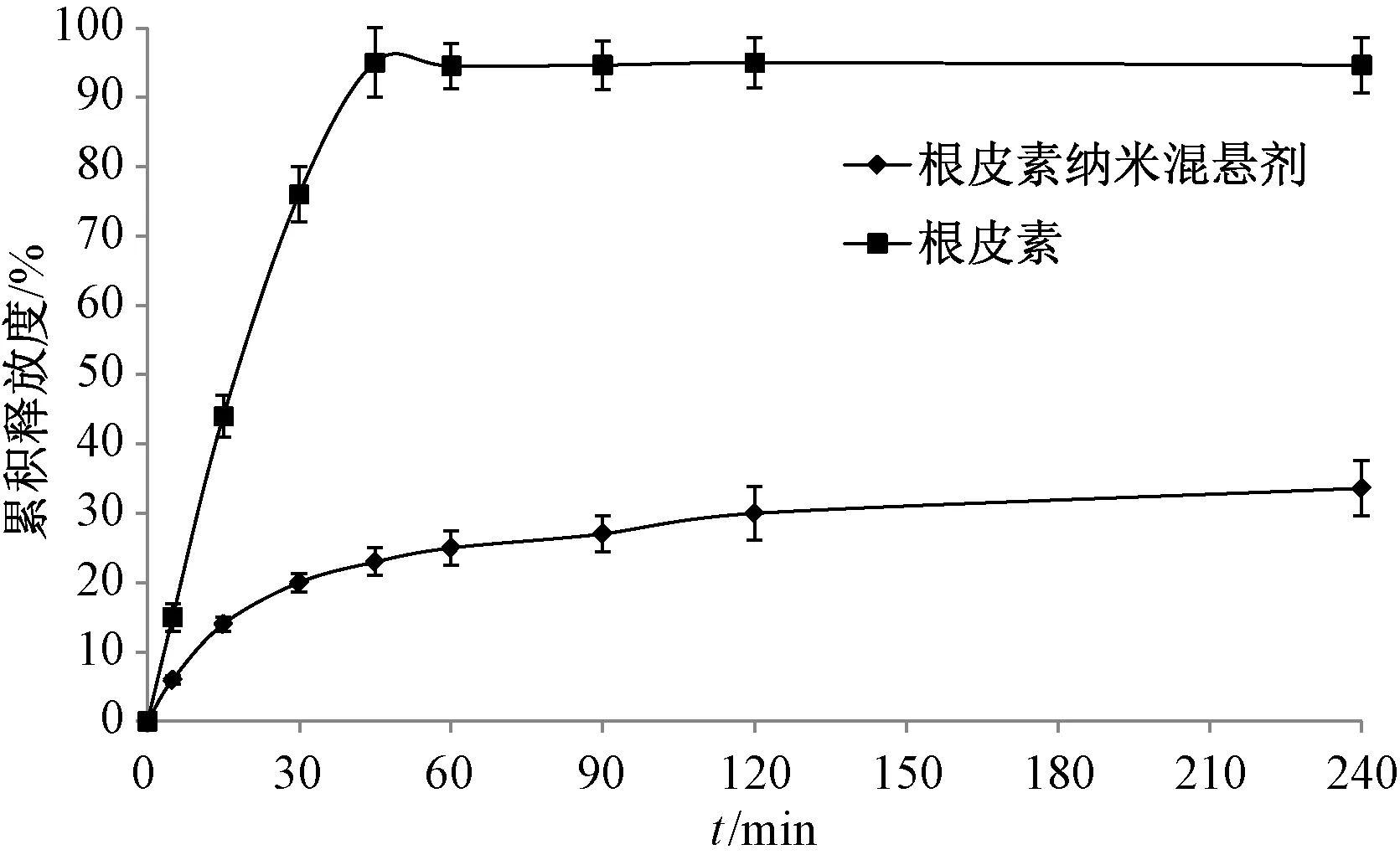
图6 根皮素体外释药曲线(n=3)
2.6 体内药动学研究
2.6.1 灌胃液制备、给药及取血 取根皮素及其纳米混悬剂冻干粉适量,加入0.5% CMC-Na溶液,超声处理30 s,即得12.5 mg/mL灌胃液。取12只SD大鼠,抛币法随机分为2组,每组6只,实验前禁食12 h,自由饮水,按100 mg/kg剂量灌胃给药,于0.167、0.25、0.5、1、1.5、2、3、4、6、8、12 h取血各约0.3 mL,置于肝素浸润的离心管中,混匀后3 000 r/min离心约2 min(视情况延长或缩短时间),取上层血浆,保存于冰箱中。
2.6.2 血浆样品处理 将血浆样品在室温下解冻后,精密吸取0.2 mL至空白离心管中,加入1 mL乙腈涡旋5 min,12 000 r/min离心5 min,转移上清液,45 ℃氮气吹干,0.2 mL乙腈复溶,12 000 r/min离心5 min,在“2.1.1”项色谱条件下进样测定。
2.6.3 线性关系考察 取5.0 μg/mL对照品溶液,乙腈依次稀释至2 500、1 000、500、100、50、20 ng/mL,各取0.2 mL,45 ℃氮气吹干,加入0.2 mL空白血浆,混匀,按“2.6.2”项下方法处理,即得血浆对照品溶液,在“2.1.1”项色谱条件下进样测定。以峰面积为纵坐标(Y),血浆对照品溶液质量浓度为横坐标(X)进行回归,得方程为Y=0.013 3X+0.461 5(r=0.994 2),在20~2 000 ng/mL范围内线性关系良好。
2.6.4 方法学考察 取空白血浆、血浆样品、血浆对照品溶液,在“2.1.1”项色谱条件下进样测定,结果见图7,可知血浆内源性物质不干扰根皮素色谱峰,专属性良好。取血浆样品6份,按“2.6.2”项下方法处理,在“2.1.1”项色谱条件下进样测定,测得根皮素峰面积RSD为1.42%,表明该方法重复性良好。取20、500、2 500 ng/mL血浆对照品溶液,在“2.1.1”项色谱条件下进样测定6次,测得根皮素峰面积RSD分别为7.31%、5.94%、2.34%,表明该方法日内精密度良好;各质量浓度每天进样测定1次,连续6 d,测得根皮素峰面积RSD分别为10.11%、7.04%、4.87%,表明该方法日间精密度良好。取血浆样品,于0、4、12、24、36、48 h在“2.1.1”项色谱条件下进样测定,测得根皮素峰面积RSD为7.77%,表明该方法稳定性良好。取2 500、500、20 ng/mL血浆对照品溶液,在“2.1.1”项色谱条件下进样测定,将实际质量浓度与配制质量浓度进行比较,测得加样回收率分别为93.61%、89.25%、91.73%,RSD分别为7.01%、8.46%、9.08%。
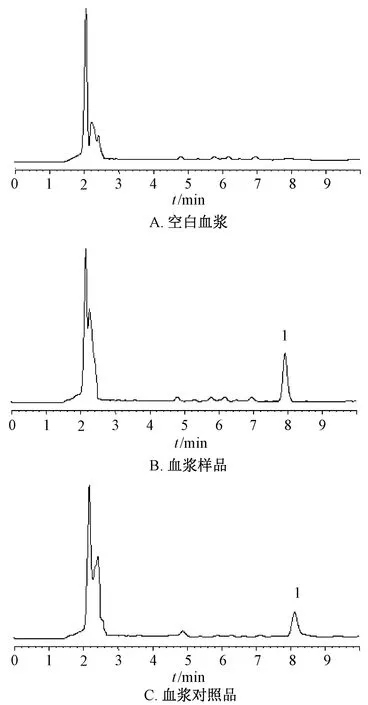
1.根皮素
2.6.5 药动学研究 图8、表6显示,与原料药比较,纳米混悬剂tmax缩短(P<0.05),Cmax、AUC0~t、AUC0~∞升高(P<0.01),相对生物利用度增加至3.47倍,而物理混合物均无明显变化(P>0.05)。
表6 根皮素主要药动学参数

图8 根皮素血药浓度-时间曲线(n=6)
3 讨论
本实验发现,当溶有根皮素的有机相接触到水相时,乙醇会迅速扩散到水相中,由于该成分在水中的溶解度较低,从而会析出形成纳米级别的微小晶核,同时稳定剂可形成空间阻力,有效防止晶核聚集[10-12],最终形成纳米混悬剂。与原料药比较,纳米混悬剂tmax显著提前,可能是由于该剂型可提高根皮素溶出速率,加快了后者进入体循环的速度;Cmax、生物利用度显著升高,可能是由于纳米混悬剂将根皮素的溶解度提高至25.78倍,后者溶出度、溶出速率也得到很大改善,表明该剂型可增加药物与胃肠道的接触面,有助于后者被充分吸收[13],而且吸收途径也发生了改变[14]。
马记平等[5]采用磷脂复合物增溶技术提高了根皮素水溶性和脂溶性,但它由于黏性较大,导致溶出受限[15];本实验制备的纳米混悬剂不仅改善了药物溶解度和溶出度,而且还能发挥纳米制剂特殊的促吸收机制,使其口服生物利用度升高程度高于磷脂复合物[16]。另外,尽管纳米混悬剂技术在促进药物体内吸收、提高生物利用度方面得到了制剂研究人员的认可,但不同药物纳米混悬剂促吸收的程度存在较大差别,可能与药物本身性质[17](如稳定性、脂溶性等)、粒径等因素有关,具体有待进一步研究。

